冠心病患者血清Lp-PLA2与HCY检测及其与冠状动脉病变程度的相关性分析*
刘亚东,冯莉莉,王海晶,王丽萍,李永莉
(1.延安大学附属医院心脑血管病区检验科,陕西延安 716000;2.安康市汉滨区第二医院检验科,陕西安康 725021)
在我国居民疾病死因构成中,心血管疾病死亡占40%左右,高据各种疾病死亡之首,并呈逐年升高趋势,而冠心病(coronary heart disease,CHD)是导致该趋势的主要原因[1],其中95%的CHD是由冠状动脉粥样硬化(atherosclerosis,AS)引起的[2],但传统的危险因素(血脂异常、高血压、吸烟、肥胖、糖尿病等)不能完全解释其发病机制[3]。炎症介质是AS形成的重要因素[4],脂蛋白相关磷脂酶A2(Lp-PLA2)是一种血管特异性炎症因子,直接影响AS的形成[5]。同型半胱氨酸(homocysteine,HCY)是CHD的独立危险因素[6],主要通过影响脂质代谢、刺激血管平滑肌细胞增殖及诱导血栓形成等方面参与AS形成[7~9]。本实验通过回顾性分析我院诊治的CHD病例,分析CHD患者血清HCY,Lp-PLA2水平与冠状动脉病变程度的关系。
1 材料与方法
1.1 研究对象 选取2017年1月~2018年5月延安大学附属医院收治的266例冠心病患者为实验组,其中男性161例,平均年龄57.3±8.5岁,女性105例,平均年龄61.1±11.6岁。纳入标准:①冠状动脉造影证实至少有一支冠状动脉狭窄;②病史资料及血清生化指标等理化资料完整者。选取同一时期在我院冠脉造影阴性的180例健康体检者为对照组,其中男性97例,平均年龄54.6±10.5岁,女性83例,平均年龄47.5±6.3岁。记录所有纳入者性别、年龄、糖尿病史、卒中病史、心肌梗死病史、吸烟史、饮酒史及HCY,Lp-PLA2,空腹血糖(FBG)、三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)和脂蛋白(a)[Lp(a)]等指标。
1.2 仪器与试剂 Lp-PLA2测定使用贝克曼AU2700全自动生化分析仪和德赛试剂及配套校准品,HCY,FBG,TG,TC,LDL-C,HDL-C,Lp(a)测定使用贝克曼AU2700全自动生化分析仪和宁波美康试剂及配套校准品。所用项目均通过室间质评及性能验证,且当日室内质控在控。
1.3 方法
1.3.1 Gensini积分分组:采用标准方法进行经皮冠状动脉造影,冠状动脉狭窄程度采用Gensini评分定量评定[10]:Gensini低积分组(Gensini积分<14分)、Gensini中积分组(Gensini积分14~28分)和Gensini高积分组(Gensini积分>28分)三组[11],比较各组之间HCY,Lp-PLA2水平的差异。
1.3.2 冠状动脉不同病变支数分组:根据冠状动脉病变支数分:冠状动脉1支病变组、冠状动脉2支病变组和冠状动脉3支及3支以上病变组三组,比较各组之间HCY,Lp-PLA2水平的差异。
1.3.3 实验室检测:所有纳入者均在临床治疗前采血测定血液学指标并记录。测定方法:使用促凝管采集清晨空腹血液5 ml,待标本凝集后以3 000 r/min离心10 min,检测血清HCY,TG,TC,LDL-C,HDL-C,Lp(a),FPG和Lp-PLA2等水平,所有检测在2 h内完成。

2 结果
2.1 实验组和对照组一般资料比较 见表1。实验组与对照组吸烟史、饮酒史及HCY,Lp-PLA2,Lp(a) 水平差异均有统计学意义(t或χ2=7.78~18.75,均P<0.05)。
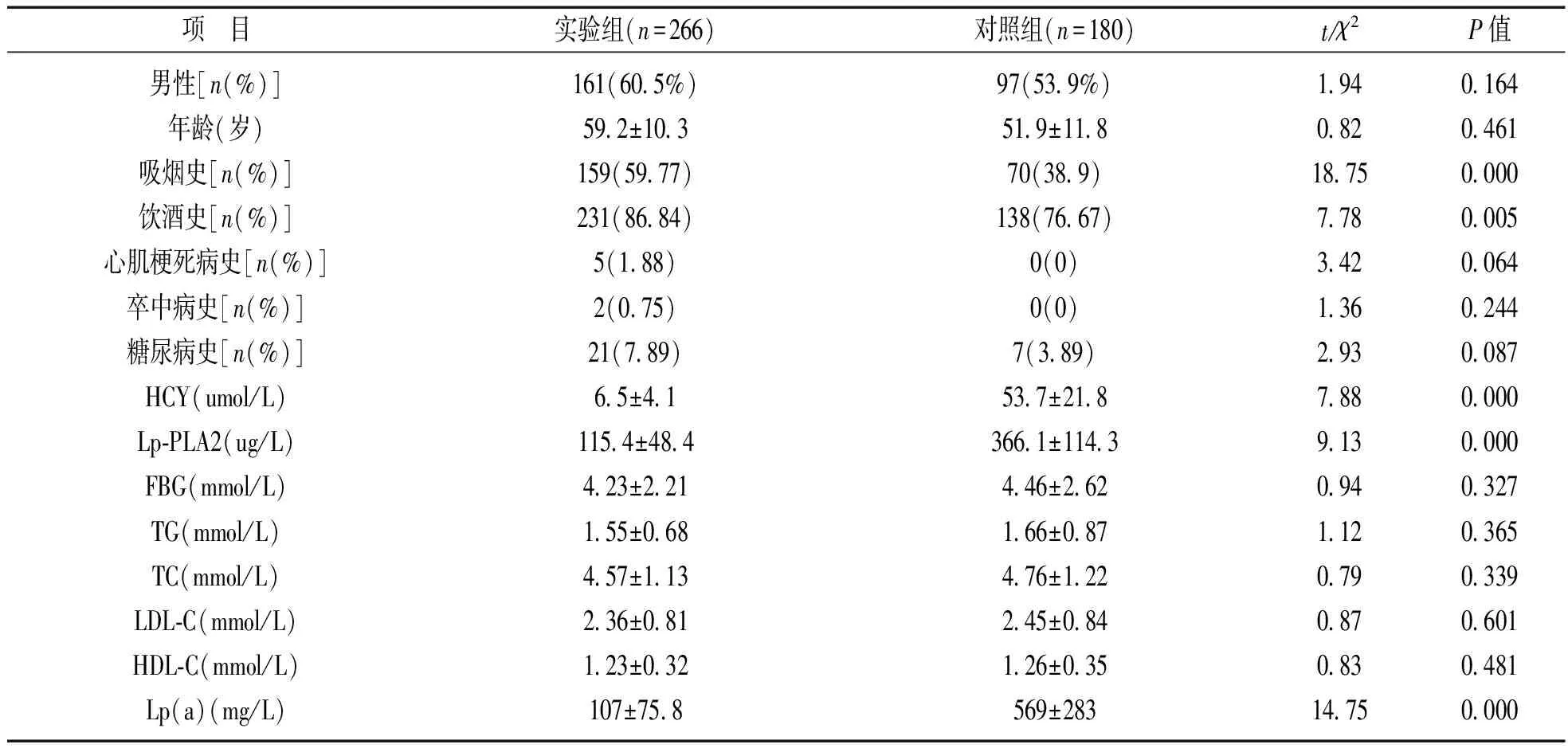
表1 实验组与对照组患者基线资料比较
2.2 Gensini积分组Lp(a),HCY和Lp-PLA2水平比较 见表2。采用秩和检验比较Gensini低积分组、中积分组和高积分组Lp(a),HCY,Lp-PLA2水平差异,三组HCY,Lp-PLA2水平差异有统计学意义(Z=5.81,15.25,均P<0.05)。进一步使用t检验对三组HCY,Lp-PLA2水平进行两两比较,结果三组HCY,Lp-PLA2水平由低到高依次为:Gensini低积分组 表2 Gensini积分组Lp(a),HCY和Lp-PLA2水平比较 2.3 冠状动脉不同病变支数组Lp(a),HCY和Lp-PLA2水平比较 见表3。 表3 冠状动脉不同病变支数组Lp(a),HCY和Lp-PLA2水平比较 采用秩和检验比较冠状动脉1支病变组、冠状动脉2支病变组、冠状动脉3支及3支以上病变组Lp(a),HCY,Lp-PLA2水平的差异,三组HCY,Lp-PLA2水平差异有统计学意义(Z=5.63,17.91,均P<0.05),使用t检验对三组HCY,Lp-PLA2水平进行两两比较,结果Lp-PLA2水平由低到高依次为:冠状动脉1支病变组<冠状动脉2支病变组<冠状动脉3支及3支以上病变组,差异有统计学意义(t=5.43~16.57,均P<0.05);冠状动脉1支病变组和冠状动脉2支病变组HCY水平差异无统计学意义(t=0.82,P=0.84),但均小于冠状动脉3支及3支以上病变组,差异有统计学意义(t=14.18,13.42,均P<0.05)。 2.4 Gensini积分与Lp(a),HCY,Lp-PLA2水平的相关性分析 见表4。采用Pearson法进行相关性分析,结果Gensini积分与HCY,Lp-PLA2水平呈显著正相关(r=0.991,0.454,均P<0.05)。 表4 实验组Gensini积分与Lp(a),Lp-PLA2,HCY水平的相关性 2.5 Lp-PLA2与HCY水平相关性分析 实验组Lp-PLA2与HCY水平呈正相关(r=0.336,P<0.05),对照组Lp-PLA2与HCY水平无相关性(r=0.062,P=0.586)。 Carson于1962年最早发现HCY尿症患者有更高的动静脉血栓发生率,以后陆续发现冠心病、全身性动脉硬化、肾功能衰竭等许多疾病与高HCY(HHCY)相关。而机体炎症变化被认为是诱发冠状动脉粥样硬化的主要危险因素,新型炎症介质Lp-PLA2更是受到广泛关注。为进一步研究血清HCY和Lp-PLA2水平与冠状动脉病变程度的关系,本实验通过实验组(冠心病患者)和对照组(健康体检者)一般资料比较,并将实验组分别按照Gensini积分分组和冠状动脉不同病变支数分组,分别比较各组内HCY和Lp-PLA2水平差异,发现随冠状动脉病变程度增加及冠状动脉病变支数增多,HCY和Lp-PLA2水平逐渐升高,与黄晖等[18,19]研究结果一致,且相关性分析显示冠状动脉病变程度与HCY和Lp-PLA2水平呈正相关,表明检测血清HCY和Lp-PLA2水平在一定程度上可以反映冠状动脉的病变程度。 新型炎症介质Lp-PLA2是由单核细胞、巨噬细胞、肥大细胞、T淋巴细胞等分泌的,又称血小板活化因子-乙酰水解酶(PAF-AH)。循环血液中约有80%的Lp-PLA2与LDL-C结合,剩余的主要与HDL-C结合。有学者认为Lp-PLA2具有抗动脉粥样硬化作用[12,13]:①可将血小板活化因子(PAF)水解使其失去活性,抑制炎症与血栓的形成。②活化的Lp-PLA2可水解血液循环中的氧化磷脂类物质,降低机体的免疫原性、保护细胞不受活性氧簇诱导的凋亡。③一部分循环中的Lp-PLA2与HDL结合为HDL-Lp-PLA2,具有抗炎和抑制动脉粥样硬化作用,从而抑制泡沫细胞的形成及降低巨噬细胞内ox Lp(a),ox-LDL积累量,限制其转化为泡沫细胞。而更多的研究认为Lp-PLA2是一种血管特异性炎症标志物,与动脉粥样斑块形成密切相关[14~16]:①Lp-PLA2可水解氧化型低密度脂蛋白(ox-LDL)产生溶血磷脂酰胆碱(Lyso-PC)和氧化型脂肪酸(ox FFA),ox FFA和Lyso-PC可使血管壁内皮细胞功能障碍,同时诱导血管内皮细胞表达黏附分子,使得LDL-C,T淋巴细胞及巨噬细胞进入内膜,起始AS的发展过程。②ox FFA和Lyso-PC还可促使巨噬细胞表达促炎介质肿瘤坏死因子 α(TNF-α),白细胞介素-6(IL-6)等,激活该区域炎症反应、产生泡沫细胞、形成坏死核、促使斑块不稳定。HCY是蛋氨酸代谢产生的一种非蛋白质含硫蛋氨酸,也称2-氨基-4-巯基丁酸,其代谢主要有两条途径:①在胱硫醚β合成酶的作用下需Vit B6辅助,与丝氨酸结合生成胱硫醚。②在蛋氨酸合成酶的作用下再甲基化生成甲硫氨酸。任意一条代谢途径发生障碍均可使HCY水平升高,形成HHCY血症,致CHD的机制为:①HHCY可降低一氧化氮(NO)对血管内皮细胞的保护作用及增加血管壁厚度,损伤血管内皮细胞及平滑肌细胞。②HHCY通过损伤内皮细胞使白细胞介素-8、单核细胞趋化蛋白-1、细胞黏附分子-1 (CAM-1)等分泌增加,上调趋化及黏附分子,促使T细胞及单核细胞进入血管病变区域,促使炎症反应。③HHCY使细胞内活性氧簇 (ROS) 增加,过核因子-κB(NF-κB)和Toll样受体(TLR4)过表达,还可抑制环氧化酶(COX)的活性和COX-17的表达,促使内皮细胞凋亡。④ HCY破坏谷胱甘肽过氧化物酶(GP)和超氧化物歧化酶(SOD),进一步增加HCY诱导的氧化应激。⑤激活Ⅴ,Ⅹ,Ⅻ等凝血因子并抑制前列腺素和肝素合成,使机体处于血栓前状态。⑥使机体DNA去甲基化水平降低而致病[17]。本实验还发现CHD患者血清HCY和Lp-PLA2水平呈正相关。但是这种关系对CHD患者冠状动脉病变程度的影响还需进一步研究。 综上所述,HCY和Lp-PLA2是CHD的危险因素,检测CHD患者血清HCY和Lp-PLA2水平可反映冠状动脉的病变程度。


3 讨论

