茶树菇生长发育过程中几种胞外酶活性的变化
吴亚召,张文隽,雷 萍,杜 芳
(陕西省微生物研究所,陕西 西安 710043)
茶树菇(Arocybeaegirita)隶属担子菌亚门(Basidiomycotina)、层菌纲(Hymenomycetes)、伞菌目(Agaricales)、粪锈伞科(Bolbitiaceae)、田头菇属(Agrocybe),又名茶薪菇、油茶菇[1],其味道鲜美,脆嫩可口;含有人体所需的18种氨基酸,其中有人体不能合成的8种氨基酸,还含有丰富的B族维生素和多种矿物质元素,长期食用还具有补肾、润肺、醒脑、抗衰老和降低胆固醇等功效,是一种营养价值、药用价值均较高的珍稀食用菌[2-3]。
食用菌在生长发育过程中,为满足自身生长发育的需要,往往会通过分泌胞外酶将培养基中的大分子营养物质分解为小分子营养物质,用于菌丝的吸收、转化和利用[4-6]。这些大分子物质的分解转化过程与菌丝体生长发育不同阶段分泌的胞外酶活性关系密切,因此了解胞外酶活性的变化规律,可以很好地了解食用菌不同生长阶段对营养的分解利用情况[7]。国内诸多学者对栽培规模较大的食用菌营养生理进行了研究,大部分研究结果表明,通过研究不同食用菌的胞外酶分泌特点、活性大小以及动态变化规律,可以推测该食用菌在不同生长发育阶段对培养基中纤维素、淀粉等大分子营养成分的降解动态[8-14]。但有关茶树菇的胞外酶研究国内尚未见报道,本研究拟以3株茶树菇菌株为对象,分析栽培过程中菌丝生长与子实体生长发育阶段分泌的相关酶活性的关系,以期为了解各菌株对培养料中不同组分的分解利用能力提供参考。
1 材料与方法
1.1 供试菌株
3株茶树菇ZK08、JX09、Ag16,均为陕西省微生物研究所微生物资源中心保藏菌种。
1.2 培养基
母种培养基:综合PDA培养基。
栽培培养基:棉籽壳39%,木屑30%,麸皮20%,玉米粉8%,蔗糖1.5%,石膏1.5%(均为质量分数);含水量62%左右。
1.3 菌种培养及粗酶液的制备
菌丝生长阶段培养条件为温度25 ℃,遮光,空气相对湿度50%~60%,母种培养10 d,原种35 d,栽培料培养50~60 d;出菇采用常规管理[15],出两潮菇后采收。
分别在8个阶段取样[16],按照菌丝生长半袋、满袋、现蕾、出一潮菇、一潮菇子实体成熟、出二潮菇、二潮菇子实体成熟和二潮菇采收1周的发育时段采样。分别取培养基上、中、下部位的培养料20 g,加入100 mL蒸馏水混匀,20 ℃浸泡4 h后过滤,4 000g离心5 min,取上清液即为粗酶液。
1.4 酶活性的测定
1.4.1 羧甲基纤维素(CMC)酶、淀粉酶和滤纸纤维素(FP)酶 参考Mandels等[17]和王玉万等[18]的方法测定酶活性。CMC酶和淀粉酶:30 min内催化底物生成1 mg葡萄糖所需的酶量为一个活力单位;FP酶:60 min内催化底物生成1 mg葡萄糖所需的酶量为一个活力单位。
1.4.2 半纤维素酶(HC) 参考Shamala等[19]的方法测定酶活性。30 min内催化底物生成1 mg木糖所需的酶量为一个活力单位。
1.4.3 漆酶(LAC)、多酚氧化酶和过氧化物酶 参考潘迎捷等[20]和张志良[21]的方法测定酶活性。每分钟使OD值改变0.01所需的酶量为一个活力单位。
1.5 数据统计分析
采用Excel软件进行数据统计和制图。
2 结果与分析
2.1 茶树菇不同生长阶段羧甲基纤维素酶活性的变化
3株茶树菇菌种ZK08、JX09和Ag16不同生长阶段羧甲基纤维素酶活性变化见图1。从图1可以看出,在整个生长发育过程中,3株茶树菇菌种胞外羧甲基纤维素酶活性变化规律基本一致,但不同菌株在同一发育时期的酶活性差异较大。在菌丝生长阶段羧甲基纤维素酶活性均较低,增长缓慢;在现蕾期之后酶活性迅速增加,至一潮菇子实体成熟时,酶活性达到最大值,ZK08、JX09和Ag16分别为24.83,21.64和26.57 U;在二潮菇现蕾至采收期间酶活性迅速降至最低,分别为6.64,4.88和8.44 U。其中以茶树菇Ag16在栽培过程中产生的羧甲基纤维素酶活性最大。

1.菌丝生长半袋;2.满袋;3.现蕾;4.出一潮菇;5.一潮菇子实体成熟;6.出二潮菇;7.二潮菇子实体成熟;8.二潮菇采收1周后。下图同1.Hypha growing half bag;2.Full bag;3.Budding;4.First mushroom;5.Fruiting bodies mature of the first mushroom;6.Second mushroom;7.Fruiting bodies mature of the second mushroom;8.One week after picking the second mushroom.The same below图1 3株茶树菇不同生长阶段羧甲基纤维素酶活性的变化Fig.1 Changes of CMC enzyme activities at different growth stages
2.2 茶树菇不同生长阶段淀粉酶活性的变化
3株茶树菇菌种ZK08、JX09和Ag16栽培过程中的淀粉酶活性变化见图2。由图2可以看出,3株菌淀粉酶活性的变化规律基本一致,在同一生长阶段不同菌株的酶活性有一定差异,且以ZK08产生的淀粉酶活性最大。在菌丝生长期,淀粉酶活性增长缓慢,可能是因为对淀粉类物质的需求不是很大,诱导产生的淀粉酶量也较少;在一潮菇幼菇形成至一潮菇子实体采收时因需要分解淀粉类物质提供营养,淀粉酶活力达到最大,ZK08、JX09和Ag16分别为12.38,8.65和11.64 U;一潮菇采收后培养基中的淀粉类物质被消耗,因此3株菌的淀粉酶活性均迅速减小,至二潮菇采收时,分别为3.10,2.03和2.15 U。
2.3 茶树菇不同生长阶段滤纸纤维素酶活性的变化
3株茶树菇不同生长阶段滤纸纤维素酶活性变化见图3。从图3可以看出,茶树菇菌种ZK08和Ag16的滤纸纤维素酶活性变化趋势基本一致,菌丝生长期酶活性不断增大,在满袋时达到最大,分别为13.36,14.06 U;菌丝长满至一潮菇子实体成熟期间酶活性呈下降趋势,二潮菇幼菇形成期间酶活性有小幅上升,之后一直下降至最低,分别为4.19,6.18 U;茶树菇菌种JX09的滤纸纤维素酶活性在菌丝生长期间不断升高,现蕾期最大为12.67 U,之后一直呈下降趋势,在二潮菇子实体采收后降至最低(3.07 U)。不同菌株在同一生长时期的酶活性差异较大,且以茶树菇Ag16产生的滤纸纤维素酶活性最大。
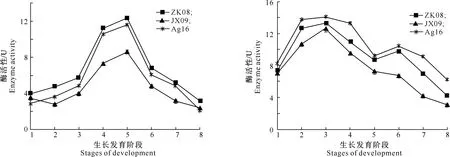
图2 3株茶树菇不同生长阶段淀粉酶活性的变化Fig.2 Changes of amylolytic enzyme activities at different growth stages
2.4 茶树菇不同生长阶段半纤维素酶活性的变化
从图4可以看出,3株茶树菇菌种ZK08、JX09和Ag16的半纤维素酶活性变化规律基本一致,但3株菌在同一生长阶段的酶活性有一定差异性,具体表现为菌丝生长前期半纤维素酶活性增长缓慢,随着茶树菇菌丝的不断生长,需要分解培养基中的纤维素类物质来满足生长需求,从而诱导产生大量半纤维素酶,因此其酶活性快速上升,至一潮菇幼菇形成时达到最大,ZK08、JX09和Ag16分别为5.63,5.17和4.93 U;在一潮菇子实体生长至二潮菇子实体成熟期间,3株菌的半纤维素酶活性均迅速减小,至二潮菇采收时,分别为0.54,0.42和1.08 U。总体而言,在栽培过程中以ZK08产生的半纤维素酶活性最大。
2.5 茶树菇不同生长阶段漆酶活性的变化
由图5可以看出,3株茶树菇菌种ZK08、JX09和Ag16在栽培过程中漆酶活性变化规律基本一致,不同菌株在同一生长时期的酶活性有一定差异。整个生长过程中酶活性都呈下降趋势,二潮菇子实体成熟时均降至最低,ZK08、JX09和Ag16分别为3.20,3.17和3.40 U。菌丝生长半袋时3株菌的酶活性最大,分别为23.52,16.63和20.10 U。
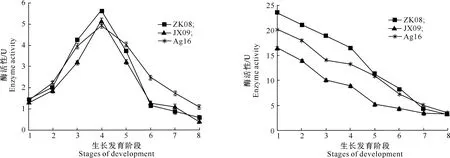
图4 3株茶树菇不同生长阶段半纤维素酶活性的变化Fig.4 Changes of HC enzyme activities at different growth stages
2.6 茶树菇不同生长阶段多酚氧化酶活性的变化
从图6可以看出,3株茶树菇菌种ZK08、JX09和Ag16的多酚氧化酶活性变化规律基本一致,在同一生长时期3株菌的酶活性存在一定差异性。整个栽培过程中酶活性一直呈下降趋势,ZK08、JX09和Ag16分别从菌丝半袋时的20.32,19.87和17.34 U下降至二潮菇采收1周后的5.02,4.24和3.38 U。
2.7 茶树菇不同生长阶段过氧化物酶活性的变化
从图7可以看出,在栽培过程中茶树菇菌种ZK08和JX09过氧化物酶活性变化规律基本一致,在整个栽培过程中酶活性一直呈下降趋势,分别从菌丝半袋时的14.69,15.73 U降至二潮菇采收1周后的4.13,3.02 U;Ag16酶活性在菌丝生长期有小幅升高,之后的变化规律同ZK08和JX09,一直呈下降趋势,酶活性从最初的13.58 U降至二潮菇采收1周后的3.83 U。3株茶树菇菌种在同一生长时期分泌的酶活性差异不明显。
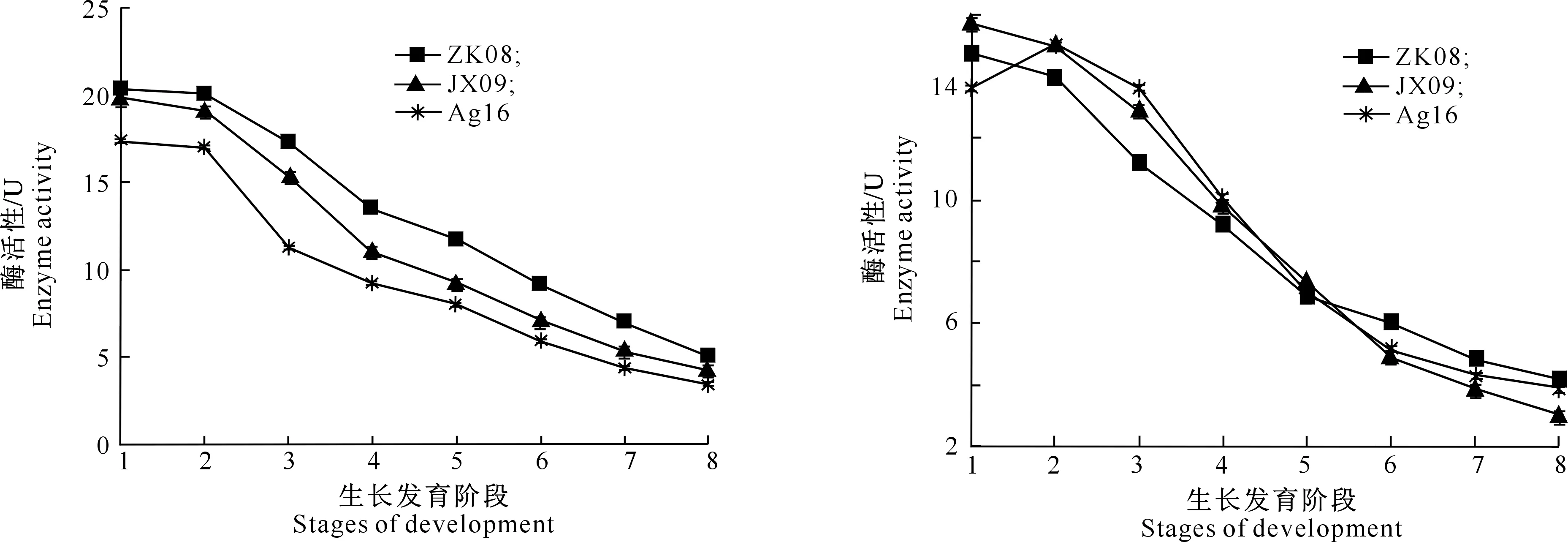
图6 3株茶树菇不同生长阶段多酚氧化酶活性的变化Fig.6 Changes of polyphenol oxidase activities at different growth stages
3 讨 论
食用菌胞外酶活性在其生育期内处于动态变化中[22-25]。本研究通过测定3株茶树菇不同生长阶段羧甲基纤维素酶、淀粉酶、滤纸纤维素酶、半纤维素酶、漆酶、多酚氧化酶和过氧化物酶的活性,发现不同菌株在整个生长发育期内酶活性变化有别。
羧甲基纤维素酶、滤纸纤维素酶和半纤维素酶可以分解基质中的纤维素、半纤维素,来满足生长、繁殖所需的营养。本研究中,3株茶树菇的这3种酶在菌丝生长后段都呈上升趋势,有利于菌丝对纤维素、半纤维的降解吸收,可为子实体生长发育积累充足的碳源营养;在子实体不同生长阶段酶活性又都有不同程度上升,可能是因为菌丝体生长贮存的营养物质已不能满足子实体迅速生长的需要,从而诱导分泌纤维素分解酶以分解利用培养基中的纤维素和木质素物质;在子实体形成后,由于培养基内纤维素类物质已被消耗,因此这3种酶活性均迅速下降。
本研究中,当蔗糖在菌丝生长阶段被消耗之后,大量的淀粉酶被诱导产生,以降解淀粉类物质,满足菌丝生长和生殖生长初期的营养需求。在一潮菇幼菇形成时,淀粉酶活性达到最大,此后随着淀粉类物质被消耗殆尽,酶活性越来越低,直至最后采收。因此,在培养基内添加适量淀粉类物质,可提高菌丝体生长的活力,为生殖生长积累充足的营养,促进生殖发育。
漆酶、多酚氧化酶和过氧化物酶均是参与木质素降解的3种酶类[26]。本研究中,3株茶树菇的木质素降解酶活性在菌丝生长初期均较高,随着菌丝的不断生长,酶活性缓慢下降,原基形成后下降趋势明显。这表明菌丝生长阶段对木质素的降解速率较快,以提供充足的碳源满足菌丝体生长营养需求,并为生殖生长积累充足的营养。木屑中含有20%以上的木质素,对纤维素的酶解具有物理性的屏障作用,需要被优先分解利用,之后纤维素和半纤维素才进一步分解。所以漆酶、多酚氧化酶和过氧化物酶的高峰值比羧甲基纤维素酶、半纤维素酶来得早。
本研究中,茶树菇胞外纤维素酶活性的动态变化规律可以用Chanter[27]提出的数学模型进行解释,即在子实体发育前期,营养物质被菌丝以一定速度积累,营养物质积累到某个值时,便引发子实体发生;随着子实体生物量的增加,菌丝体中的营养物质不断被消耗,当营养物质到一定下限水平时,相应的子实体发育就受阻停滞。这表明胞外纤维素酶和半纤维素酶与子实体发育之间存在某种内在的调控机制,但该调控机制尚需进一步研究。

