两种深色有隔内生真菌的铅耐受性
杨 超,谢清哲,楚文卉,冯 欢,刘 莹,张收霞,王春燕
(西北农林科技大学 林学院,陕西 杨凌 712100)
重金属污染已经成为严重的环境问题[1],铅(Pb)是普遍的重要污染物之一。重金属Pb污染不仅能够引起土壤组成、结构和功能的变化,还能够抑制作物根系生长和光合作用,致使作物减产甚至绝收,更为严重的是Pb通过食物链在人体内富集,从而威胁人体健康[2],因此重金属污染土壤生态修复技术研究已成为多个科技领域的热点和难点[3]。植物根际与微生物系统的相互促进作用能够有效提高污染土壤的生物修复能力,已成为生物修复领域的研究热点[4];同时,微生物因其具有繁殖速度快、反应条件温和、处理效率高等优势,显示出了广阔的应用前景[4]。已有研究报道,腐生真菌具有良好的重金属污染修复能力,如大孢蘑菇(Agaricusmacrosporus)对重金属铜、铅和镉的最高吸收率分别为96%,89%和96%[5]。研究表明,真菌的抗氧化酶系统能有效降低活性氧的伤害,分泌多种有机酸,可螯合、沉淀重金属离子,从而降低重金属的毒害,这可能是真菌免受重金属毒害的重要机制之一[6]。
深色有隔内生真菌(dark septate endophytes,DSE)是自然界中普遍定殖于植物根部的内生真菌[7],广泛分布于重金属污染区,对这些地区植物的生长具有保护和促进作用[8]。已有研究表明,DSE菌丝具有较强的重金属耐受性和吸附能力,如嗜鱼外瓶霉(Exophialapisciphila)对镉具有很强的吸收和富集能力[9],枝状枝孢菌(Cladosporiumcladosporioides)B142的非活性菌丝对Pb的吸附能力较强[10]。目前,有关Pb耐受性DSE菌株的筛选和抗性机制研究还相对较少,本研究采用液体摇瓶培养方法,比较了2种DSE对重金属Pb的耐受性和富集能力,检测了相关的生理生化特征,并初步分析了可能的耐受机制,以期为DSE在重金属污染土壤治理和污染区植被修复中的应用提供理论依据。
1 材料与方法
1.1 供试菌种
供试DSE菌种为Phialocephalafortinii和Phaeoacremoniummortoniae,分离自陕西秦岭火地塘油松(PinustabulaeformisCarr.)根部,纯化后保存于西北农林科技大学林学院森林微生物实验室。将保存的菌种接种于马铃薯葡萄糖琼脂(potato dextrose agar,PDA)固体培养基平板上,25 ℃暗培养10 d后用打孔器(直径1 cm)在菌落边缘打取菌饼备用。
1.2 硝酸铅母液的配制
精确称取1.6 g分析纯Pb(NO3)2,溶于灭菌(121 ℃,30 min)蒸馏水中并定容到100 mL,即可得到Pb2+质量浓度为10 g/L的硝酸铅母液,使用前用0.22 μm微孔滤膜过滤除菌。
1.3 2种DSE的铅耐受性和铅富集量
将150 mL马铃薯葡萄糖液体培养基(potato dextrose broth,PDB)装入250 mL的三角瓶中灭菌(121 ℃,30 min),冷却至室温,用移液枪分别准确吸取4.639,9.574,14.835,20.455 mL硝酸铅母液于150 mL PDB培养基中,充分摇匀后即可得到Pb2+质量浓度分别为300,600,900,1 200 mg/L的液体培养基(预试验发现,当Pb2+质量浓度超过1 200 mg/L后,2种菌丝生长缓慢,受到抑制,因此,本试验中Pb2+质量浓度最高设为1 200 mg/L),以不添加硝酸铅母液的处理为对照(CK)。每个Pb2+质量浓度设3个平行。每瓶液体培养基中接入2个菌饼,25 ℃振荡(120 r/min)培养21 d后用滤纸过滤收集菌丝体。滤液用于测定pH值和有机酸含量,菌丝体用去离子水冲洗3次后于80 ℃烘干至质量恒定,称量菌丝体干质量,计算真菌的铅半致死浓度(EC50)[11]。
精确称取0.1 g各处理干燥的菌丝体,采用浓硝酸-高氯酸(均为分析纯)湿法消化[12],用去离子水稀释定容,用原子吸收分光光度计测定铅含量,据此计算菌丝体中的铅含量(mg/kg,干质量)和2种DSE的铅富集量[13]。
1.4 测定项目及方法
1.4.1 菌丝中超氧化物歧化酶(SOD)活性和可溶性蛋白含量 称取0.5 g新鲜菌丝(收集方法同1.3)于预冷的研钵中,加2 mL粗酶提取液(50 mmol/L pH 7.8磷酸缓冲液,内含体积分数1%聚乙烯吡咯烷酮)和少量石英砂,冰浴下充分研磨后定容至10 mL;4 ℃离心15 min(8 000 r/min)后取上清液,分别用文献[14]和[15]的方法测定SOD活性及可溶性蛋白含量。
1.4.2 菌丝内还原型谷胱甘肽(GSH)和丙二醛(MDA)含量 精确称取0.5 g新鲜菌丝,加入少量5%(体积分数)偏磷酸溶液冰浴研磨至匀浆后定容到10 mL,4 ℃离心(5 000 r/min,10 min)2次后取上清液,用紫外分光光度计在波长412 nm处测定吸光值并计算菌丝内的GSH含量[16]。另取新鲜菌丝0.5 g,加入少许石英砂和5 mL 0.05 mol/L磷酸缓冲液(pH 7.8)冰浴研磨成匀浆,4 ℃离心(5 000 r/min,10 min)后取上清液,加入1倍体积0.5%体积分数的硫代巴比妥酸,混匀并置于沸水浴上反应15 min,迅速冷却后再离心,以体积分数0.5%的硫代巴比妥酸为空白对照,用紫外分光光度计在波长450,532,600 nm处测定吸光值,并计算菌丝内的MDA含量[17]。
1.4.3 滤液pH值和有机酸质量浓度 用pH计(PHD-3C-02紧密型,上海三信仪表厂)测定滤液的pH值。用高效液相色谱仪(D-7000,日本HITACHI公司)测定滤液中的有机酸质量浓度(样品先用0.1 mol/L H2SO4酸化,并用0.22 μm微孔滤膜过滤),色谱条件为:Diode Array L-7455紫外检测器,检测波长210 nm;Agilent TC-C18柱,柱温30 ℃;0.01 mol/L KH2PO4-KH2PO4(pH 2.8)为流动相,流速0.5 mL/min;进样量10 μL。釆用外标法,分别以标准品(草酸、乙酸、苹果酸、柠檬酸、琥珀酸和酒石酸)和去离子水为对照,测定和计算培养液中的有机酸质量浓度(峰面积法)[18]。
1.5 数据处理与分析
用Microsoft Excel 2007软件进行试验数据整理,计算平均值及标准差并进行绘图,试验数据均以“平均值±标准差(SD)”(n=3)表示,用SPSS 17.0进行差异显著性方差分析,以P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 2种DSE的铅耐受性和富集作用
表1显示,Pb2+质量浓度为0~1 200 mg/L时,2种DSE均有不同程度的生长,但它们的菌丝干质量随着培养液中Pb2+质量浓度的增加而逐渐减小,表明重金属铅对2种菌的生长均有抑制作用,除Pb2+质量浓度为300 mg/L时P.fortinii菌丝体干质量略低于对照外,2种DSE菌丝体干质量在其余Pb2+质量浓度下均显著低于对照(P<0.05)。不加Pb2+时,P.mortoniae的生长明显优于P.fortinii,菌丝体干质量显著高于后者(P<0.05);当Pb2+质量浓度为300~1 200 mg/L时,随Pb2+质量浓度的增加,P.mortoniae生长速率快速下降;同一Pb2+质量浓度下,P.mortoniae菌丝干质量均显著低于P.fortinii(P<0.05),其铅半致死浓度(EC50)(431.0 mg/L)也显著低于P.fortinii(951.5 mg/L),表明铅对P.mortoniae生长的抑制作用明显大于P.fortinii,即P.fortinii的铅耐受性优于P.mortoniae。
表1还显示,2种DSE菌丝中的Pb2+含量随培养液中Pb2+质量浓度的增加而显著增大,在Pb2+质量浓度为1 200 mg/L时均达到最大值,同一Pb2+质量浓度下,P.mortoniae菌丝中的Pb2+含量均高于P.fortinii,尤其当Pb2+质量浓度为900~1 200 mg/L时二者差异达到显著水平,表明相同Pb2+质量浓度下进入P.mortoniae菌丝体内的Pb2+较多,这可能是其铅耐受性较低的原因之一。随培养液中Pb2+质量浓度的增加,P.fortinii的菌丝Pb2+富集量显著增大;而P.mortoniae菌丝中的Pb2+富集量则先升高后降低,在Pb2+质量浓度为900 mg/L时达到最大值,当Pb2+质量浓度为1 200 mg/L时降低,这与Pb2+质量浓度较高时其生长受到抑制,菌丝干质量快速降低直接相关。此外,在各Pb2+质量浓度下,P.fortinii菌丝体的Pb2+富集量均高于P.mortoniae,除Pb2+质量浓度为300 mg/L外,其余Pb2+质量浓度下二者差异均达到显著水平,尤其在Pb2+质量浓度为1 200 mg/L时,P.fortiniiPb2+富集量约为后者的2.5倍,显示出了较强的Pb2+富集能力。

表1 2种深色有隔内生真菌(DSE)的铅耐受性和富集能力Table 1 Lead tolerances and enrichment abilities of two DSE
注:不同小写字母表示处理间差异显著(P<0.05),不同大写字母表示2种真菌差异显著(P<0.05)。
Note:Different lowercase letters indicate significant difference (P<0.05) among different lead concentrations,while capital letters indicate significant difference (P<0.05) among the two fungi under same lead mass concentrations.
2.2 铅胁迫对2种DSE菌丝生化指标的影响
2.2.1 SOD活性 图1-A显示,与对照相比,铅胁迫下2种DSE菌丝的SOD活性总体增加,除P.mortoniae在Pb2+质量浓度为1 200 mg/L时极显著低于对照(P<0.01)外,其余Pb2+质量浓度下2种DSE菌丝的SOD活性都极显著高于对照。随培养液中Pb2+质量浓度的增加,2种DSE菌丝的SOD活性均呈先升高后降低的趋势,其中P.fortinii在Pb2+质量浓度为600 mg/L时SOD活性达到最大值(P<0.01),而P.mortoniae在Pb2+质量浓度为300 mg/L时SOD活性达到最大值。此外,不加铅时,2种DSE菌丝的SOD活性无显著差异(P>0.05),随培养液中Pb2+质量浓度的增加,P.fortinii菌丝的SOD活性除在Pb2+质量浓度为300 mg/L时极显著低于P.mortoniae外,其他Pb2+质量浓度(600~1 200 mg/L)下均显著高于P.mortoniae,尤其是在Pb2+质量浓度为600和1 200 mg/L时二者差异达到极显著水平(P<0.01),这可能也是P.fortinii的铅耐受性高于P.mortoniae的原因之一。
2.2.2 GSH含量 图1-B显示,与对照相比,铅胁迫下2种DSE菌丝的GSH含量极显著增加。随培养液中Pb2+质量浓度的增加,P.fortinii菌丝的GSH含量快速升高,并在Pb2+质量浓度为600 mg/L 时达到最大(P<0.01),但与Pb2+质量浓度为900~1 200 mg/L时无显著差异(P>0.05);P.mortoniae菌丝的GSH含量则是先升高,在Pb2+质量浓度为600 mg/L时达到最大,之后又快速下降。Pb2+质量浓度为300~1 200 mg/L时,P.fortinii菌丝的GSH含量均显著高于P.mortoniae,尤其是在Pb2+质量浓度为1 200 mg/L时,前者约是后者的2.7 倍(P<0.01),这可能也是P.fortinii的铅耐受性高于P.mortoniae的原因之一。
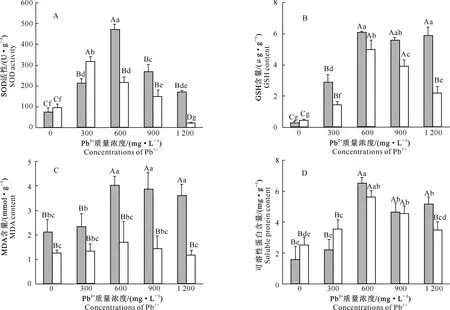

2.2.3 MDA含量 图1-C显示,P.fortinii菌丝的MDA含量随培养液中Pb2+质量浓度的增加先升高,在Pb2+质量浓度为600 mg/L时达到最大值,之后随Pb2+质量浓度的增加略有下降,但均极显著高于对照和Pb2+质量浓度300 mg/L处理。随Pb2+质量浓度的增加,P.mortoniae菌丝的MDA含量也呈先升高后降低的趋势,并在Pb2+质量浓度为600 mg/L 时达到最大值,之后略有降低,但是Pb2+胁迫处理与对照差异均不显著,表明铅胁迫对其影响较小。除Pb2+质量浓度为0~300 mg/L外,P.fortinii菌丝的MDA含量均极显著高于P.mortoniae,且随Pb2+质量浓度的增加,2种DSE之间菌丝的MDA含量差异逐渐增大。
2.2.4 可溶性蛋白含量 图1-D显示,铅胁迫下2种DSE菌丝的可溶性蛋白含量均有所升高,除Pb2+质量浓度为300 mg/L外,P.fortinii菌丝的可溶性蛋白含量均极显著高于对照(P<0.01);除Pb2+质量浓度为1 200 mg/L外,P.mortoniae菌丝的可溶性蛋白含量也显著高于对照。随培养液中Pb2+质量浓度的增加,2种DSE菌丝的可溶性蛋白含量均呈先升高后降低的趋势,且都在Pb2+质量浓度为600 mg/L时达到最大。此外,P.fortinii菌丝的可溶性蛋白含量在Pb2+质量浓度较低(0~300 mg/L)时低于P.mortoniae;而在Pb2+质量浓度较高(600~1 200 mg/L)时均高于P.mortoniae,在Pb2+质量浓度为1 200 mg/L时,P.fortinii菌丝的可溶性蛋白含量约是P.mortoniae的1.5倍,说明高质量浓度Pb2+胁迫下P.fortinii菌丝可溶性蛋白含量的增幅明显高于P.mortoniae,这可能也是P.fortinii的铅耐受性高于P.mortoniae的原因之一。
2.3 铅胁迫对2种DSE培养液pH值和有机酸质量浓度的影响
图2-A显示,随Pb2+质量浓度的增加,2种DSE培养液的pH值均下降,除在Pb2+质量浓度为300 mg/L时P.mortoniaepH值与对照无显著差异外(P>0.05),2种DSE培养液pH均显著低于对照(P<0.05)。Pb2+质量浓度为0~1 200 mg/L时,随Pb2+质量浓度的增加,P.fortinii的pH值由不加铅时的8.2降至3.9,且在Pb2+质量浓度为600 mg/L时pH急剧下降(P<0.01),Pb2+质量浓度高于900 mg/L后趋于平稳;P.mortoniae的pH值由不加铅时的7.4降至5.7,降幅相对较小,且在Pb2+质量浓度达900 mg/L后趋于平稳。Pb2+质量浓度为0~300 mg/L时P.fortinii的pH值显著高于P.mortoniae;随Pb2+质量浓度的增加(600~1 200 mg/L),P.fortinii的pH值快速下降,降幅明显大于P.mortoniae,且极显著低于P.mortoniae,尤其是在Pb2+质量浓度为600 mg/L时二者差异达到最大。
值得注意的是,2种DSE培养液pH值的变化与其菌丝干质量呈正相关,即菌丝干质量均随pH值的降低而减小。与对照相比,Pb2+质量浓度较低(300 mg/L)时,P.fortinii培养液pH值显著减小,但菌丝干质量无显著变化;P.mortoniae培养液pH值无显著变化,但菌丝干质量却显著减小;而在Pb2+质量浓度较高(600~900 mg/L)时,2种DSE培养液pH值急剧降低,菌丝干质量也显著减小;随着Pb2+质量浓度的持续增加,2种DSE培养液pH值均保持稳定,P.fortinii菌丝干质量无显著变化(P>0.05),而P.mortoniae菌丝干质量则显著降低。可见,较低的Pb2+质量浓度和较高的pH对P.fortinii菌丝体的生长无显著影响,而在Pb2+质量浓度较高(600~1 200 mg/L)时,较低的培养液pH值对P.fortinii菌丝体的生长影响更为显著;P.mortoniae菌丝体生长受Pb2+胁迫影响显著,而受培养液pH影响较小。
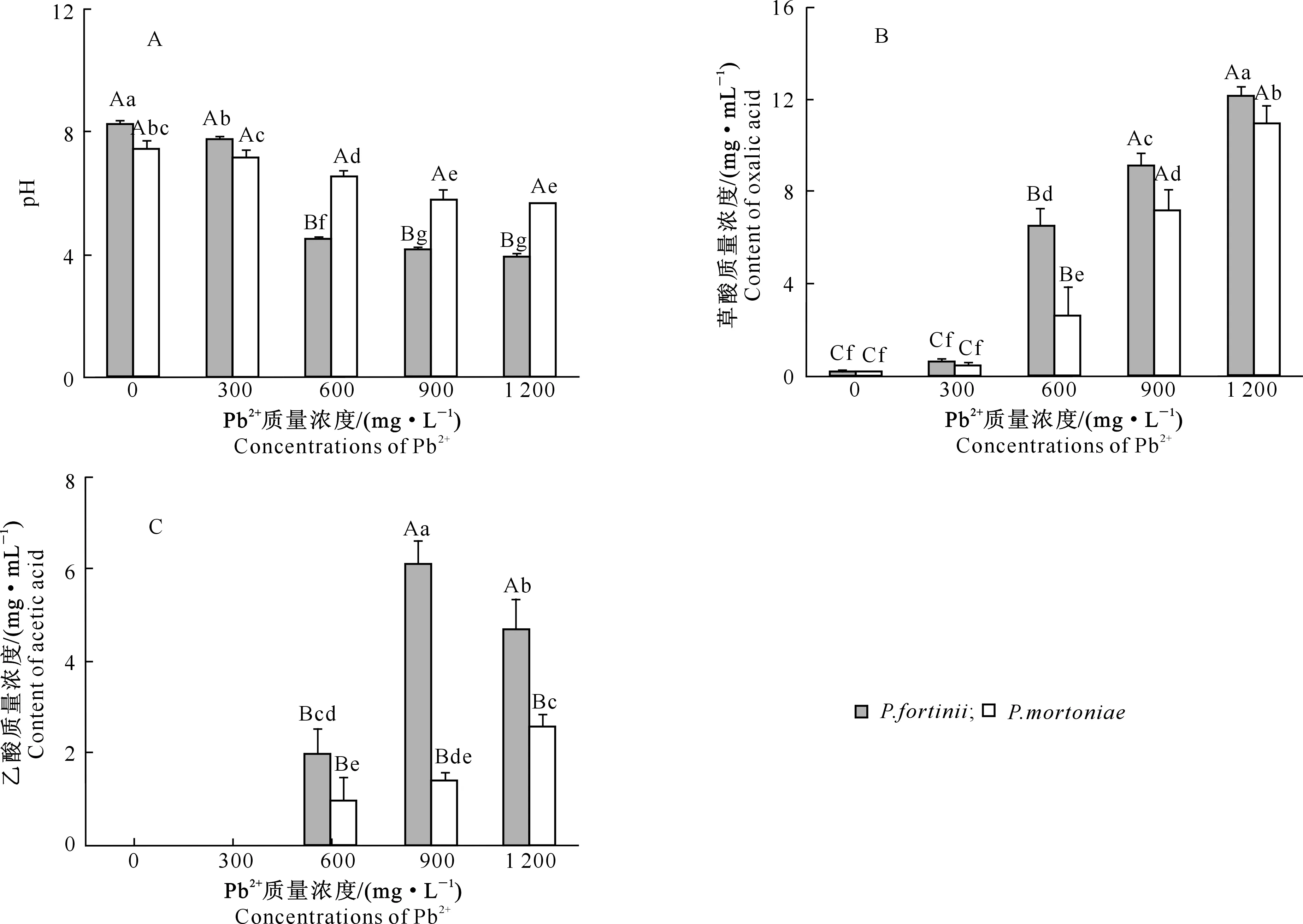
图2 铅胁迫对2种深色有隔内生真菌(DSE)培养液pH值和有机酸质量浓度的影响Fig.2 Effects of Pb2+ stress on pH and organic acids concentrations of liquid culture media of two DSE
从2种DSE培养液中仅检测到草酸和乙酸2种小分子有机酸,故对这2种有机酸进行测定,结果见图2。由图2-B可知,无论有无Pb2+存在,2种DSE培养液中都含有草酸,但只是其质量浓度在对照中极低;在Pb2+质量浓度较低(300 mg/L)时草酸质量浓度虽有增加,但与对照相比无显著差异;而在Pb2+质量浓度较高(600~1 200 mg/L)时,随Pb2+质量浓度增加草酸质量浓度急剧升高,在Pb2+质量浓度为1 200 mg/L时达到最大值(P<0.01)。此外,P.fortinii的草酸质量浓度在各Pb2+质量浓度(0~1 200 mg/L)下均高于P.mortoniae,除Pb2+质量浓度为0~300 mg/L时二者之间无显著差异外,二者差异均达到显著水平。
由图2-C可知,乙酸只在Pb2+质量浓度较高(600~1 200 mg/L)时才产生,P.fortinii培养液中的乙酸质量浓度随Pb2+质量浓度的增加呈先升高后降低的趋势,在Pb2+质量浓度为900 mg/L时达到最大值(P<0.01),Pb2+质量浓度为1 200 mg/L时虽有下降但仍极显著高于Pb2+质量浓度600 mg/L处理。P.mortoniae培养液中的乙酸质量浓度随Pb2+质量浓度的增加则逐渐升高,且在Pb2+质量浓度为1 200 mg/L时达到最大值。此外,P.fortinii培养液中的乙酸质量浓度均显著高于P.mortoniae。
总而言之,高质量浓度(600~1 200 mg/L)Pb2+胁迫下P.fortinii培养液中的有机酸质量浓度显著高于P.mortoniae(P<0.05),这与P.fortinii培养液中的pH值在Pb2+质量浓度较高时显著低于P.mortoniae相对应,这可能也是P.fortinii铅耐受性相对较高的原因之一。
3 讨论与结论
3.1 2种DSE的铅耐受性和富集作用
菌丝生长量是判定真菌抗重金属能力的可靠指标之一[19]。张淑彬等[20]研究表明,重金属在较低质量浓度时能刺激某些真菌菌丝的生长,在高质量浓度时则会抑制真菌生长。而黄志基等[21]发现,液体培养条件下美味牛肝菌(Boletusedulis)和铆钉菇(Gomphidiusviscidus)的生物量与重金属离子的质量浓度呈反比。本研究中,2种DSE的菌丝干质量随着重金属Pb2+质量浓度的增加而逐渐下降,表明Pb2+对这2种真菌生长具有明显的抑制作用,与上述研究结果相一致。从菌丝干质量下降幅度和铅半致死浓度来看,P.fortinii比P.mortoniae具有更高的铅耐受性,这可能是因为在各Pb2+质量浓度下进入P.mortoniae菌丝中的Pb2+含量均高于P.fortinii,Pb2+对P.mortoniae造成的毒害程度更重,从而抑制了其菌丝生长[22]。因而使得P.fortinii菌丝体的铅富集量也高于P.mortoniae;P.fortinii则通过阻止Pb2+进入胞内,降低了菌丝体中的铅含量和毒害,从而增强了其对重金属铅的耐受性。
3.2 2种DSE铅耐受性的潜在机制
3.2.1 SOD活性提高 重金属胁迫下生物体内会产生活性氧(ROS)的累积,打破了活性氧产生与清除系统的平衡,从而引起膜脂的过氧化伤害[23],导致细胞的新陈代谢无法正常进行,从而使真菌的生长受到抑制[24];而生物体诱导产生的抗氧化酶(SOD、CAT、POD等)能清除活性氧,对生物体起到保护作用[25]。本研究中2种DSE菌丝内的SOD活性均随着Pb2+质量浓度的增加呈现先增加后降低的趋势,与前人的研究结果[26]相一致,表明低Pb2+胁迫可以在一定程度上提高这2种DSE菌丝的SOD活性,以应对重金属Pb2+造成的过氧化损伤和由此产生的活性氧自由基,从而减少Pb2+对菌丝细胞的损伤[27];而当Pb2+质量浓度增加,Pb2+造成的损伤超出了菌丝所能承受的范围时,细胞的自我调节机制就不再起作用,SOD活性随之降低[22]。可见菌丝SOD活性的提高是这2种DSE具有铅耐受性的潜在机制之一。在Pb2+质量浓度较高(600~1 200 mg/L)时,P.fortinii菌丝的SOD活性显著高于P.mortoniae(P<0.05),表明高质量浓度Pb2+胁迫下P.fortinii菌丝的SOD活性较强,可以更好地清除活性氧,从而使P.fortinii表现出较强的铅耐受性,这是P.fortinii的铅耐受性高于P.mortoniae的原因之一。
3.2.2 GSH含量升高 作为生物体内最主要的非蛋白巯基和含量最丰富的低分子量多肽,GSH在真菌抗逆过程中直接或间接地参与了许多功能活动[28]。一方面,GSH作为一种螯合剂具有很强的重金属亲和力,可螯合许多重金属(如铅、镉等)形成无毒化合物,进而降低细胞内游离重金属离子的浓度[29],防止金属离子敏感酶因变性而失活,从而减轻重金属对真菌的毒害作用[30]。另一方面,GSH也是一种高化学活性的有机物,能通过巯基二硫化反应清除生物体内的活性氧自由基,从而减轻其对机体的伤害[29]。本研究中,2种DSE菌丝的GSH含量在Pb2+胁迫下明显增加,均极显著高于对照(P<0.01),表明这2种DSE在受到重金属Pb2+胁迫后不断产生GSH以螯合重金属Pb2+,从而减轻其毒害作用,提高自身的铅耐受性,这与前人研究结果[31]相一致。本研究中,P.fortinii菌丝的GSH含量在Pb2+质量浓度为300~1 200 mg/L时均显著高于P.mortoniae(P<0.05),这也是P.fortinii的铅耐受性高于P.mortoniae的原因之一。
3.2.3 MDA含量先升后降 MDA是生物体在逆境条件下产生的膜脂过氧化重要产物之一[32],其含量是反映生物器官衰老进程和受逆境胁迫程度的重要指标之一。本研究中,2种DSE菌丝内的MDA含量在Pb2+胁迫下增加,且随Pb2+质量浓度的增加均呈先升高后降低的趋势,并在Pb2+质量浓度为600 mg/L时达到最大值,表明Pb2+胁迫使这2种DSE的菌丝体受到了不同程度的毒害作用;当Pb2+质量浓度为900~1 200 mg/L时,菌丝的MDA含量开始下降,表明菌丝受到的重金属毒害有所降低,这与高质量浓度Pb2+胁迫下菌丝内GSH和有机酸的大量积累正好相反,可见GSH和有机酸的积累可能是2种DSE减轻重金属毒害的可能机制之一。
3.2.4 可溶性蛋白含量升高 生物体受到逆境胁迫时,体内会启动一系列保护系统,大部分可溶性蛋白质作为酶类参与生物体代谢过程,通过调节细胞渗透势和维持渗透压平衡来抵御外界伤害[33]。真菌可通过分泌可溶性蛋白螯合重金属以降低体内的重金属含量,从而减少重金属胁迫造成的损伤[34]。冯欢等[22]发现,2种外生菌根真菌的可溶性蛋白含量均随Pb2+质量浓度的增加呈先增加后降低的趋势。本研究中,重金属Pb2+胁迫下,P.fortinii和P.mortoniae菌丝内可溶性蛋白含量均高于对照,且随着Pb2+质量浓度的增加也呈先增加后降低的趋势,表明低质量浓度Pb2+胁迫促进了菌丝可溶性蛋白的分泌,通过调节细胞内渗透压和增进酶促反应形成自我保护机制,而随着Pb2+质量浓度的持续增大,细胞内需要大量的可溶性蛋白以螯合过量的重金属离子,因而高质量浓度Pb2+胁迫时菌丝的可溶性蛋白含量逐渐下降[35]。可见菌丝内可溶性蛋白的积累对于提高2种DSE的重金属铅耐受性发挥了积极的作用。此外,高质量浓度(600~1 200 mg/L)Pb2+胁迫下P.fortinii菌丝的可溶性蛋白含量明显高于P.mortoniae,这也是P.fortinii的铅耐受性高于P.mortoniae的重要原因之一。
3.2.5 有机酸产生 真菌抵抗重金属胁迫的一个重要机制是向胞外分泌小分子有机酸,如草酸、柠檬酸、苹果酸、琥珀酸等,这些有机酸与重金属配位结合后可改变环境中重金属的存在形态,从而直接降低环境中重金属的有效浓度[36-37]。此外,真菌不仅能通过调节有机酸的分泌量,还可通过调节分泌的有机酸种类来应对不同程度的重金属胁迫[31]。Fomina等[38]研究发现,一定质量浓度的重金属胁迫能诱导许多真菌分泌草酸,而草酸在胞外易与重金属离子发生微沉淀作用,形成难溶的草酸盐,进而降低了环境中的重金属离子质量浓度,虽然草酸的分泌没有改变环境中重金属的绝对含量,但却降低了重金属的毒性。湛方栋[9]发现,在Cd2+质量浓度为50~400 mg/L时,嗜鱼外瓶霉草酸分泌量增加了2.1~14.7倍。本研究中,2种DSE培养液的pH值随Pb2+质量浓度的增加而下降,这与有机酸的产生和积累呈正相关。无论有无Pb2+存在,2种DSE培养液中都可检测到草酸,但草酸在对照处理中极少,Pb2+质量浓度较低(300 mg/L)时略有增加;而在Pb2+质量浓度较高(600~1 200 mg/L)时,随Pb2+质量浓度增大而急剧升高。此外,在2种DSE有机酸总量中草酸的分泌量占绝对优势,其质量浓度明显高于乙酸。可见铅胁迫对2种DSE草酸分泌有显著的刺激和促进作用,且Pb2+质量浓度越高,促进作用越明显,表明草酸的分泌在缓解2种DSE菌丝体的铅毒害、提高铅耐受性方面发挥了至关重要的作用。
与外生菌根真菌只在高质量浓度Pb2+胁迫时产生琥珀酸[22]相似,本研究中,当培养液中Pb2+质量浓度达到600 mg/L时,才开始刺激2种DSE分泌乙酸,这可能是2种DSE缓解高质量浓度铅胁迫的关键因子之一。另外,铅胁迫下P.fortinii培养液中的草酸和乙酸质量浓度均显著高于P.mortoniae(P<0.05),这也是P.fortinii铅耐受性相对较高的原因之一。以上结果表明,这2种DSE可通过调节有机酸的种类和分泌量来应对重金属铅不同程度的胁迫。
综上所述,P.fortinii和P.mortoniae具有较好的铅耐受性及富集能力,且前者表现优于后者;菌丝中SOD活性的提高,以及GSH、可溶性蛋白和有机酸(草酸和乙酸)含量的大量积累是这2种DSE具有较好铅耐受性的潜在机制,也是P.fortinii的铅耐受性高于P.mortoniae的原因。

