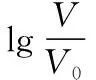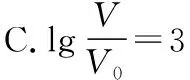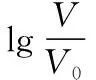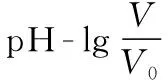突破电解质溶液中的图象问题
文丽娟 杨恩健
湖北
分析近几年全国及部分省市高考试题,电解质溶液中的图象题频繁出现,此类试题综合性强,呈现出难度加大、坐标多元化的趋势,不仅考查学生定性与定量相结合的分析思维,还考查学生数形结合识图用图的能力,也要求学生能深入微观世界认识各种化学过程来解决微粒浓度大小问题。这是高考的重点与难点,对学生能力上的要求不断提升,包括观察和分析图象的能力、分析和处理数据的能力、化学知识综合迁移的能力等,通常学生对这类问题比较困惑,在进行高考复习备考中较为棘手,应将这类问题进行归纳汇总,以专题的形式进行复习突破。
一、关于滴定曲线的考查
1.一元强酸(碱)滴定一元弱碱(酸)曲线
【例1】用0.1 mol/L的NaOH溶液分别滴定体积均为20 mL,浓度均为0.1 mol/L的HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积的变化如图所示。下列说法正确的是
( )
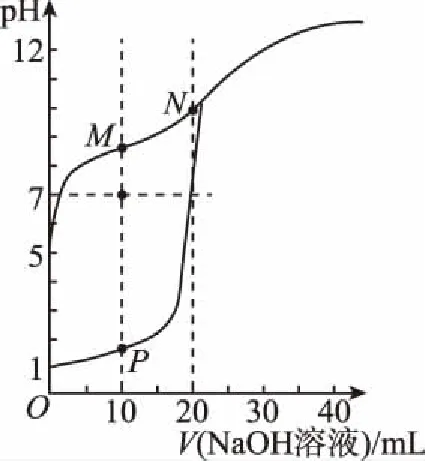
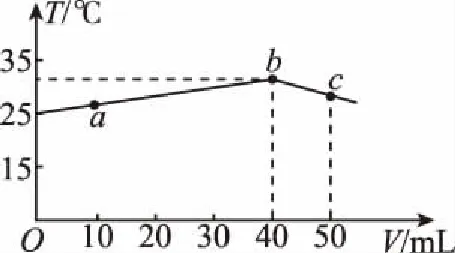
A.HX的电离平衡常数Ka约为1×10-5
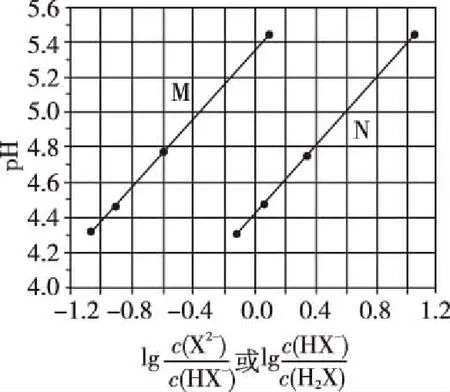
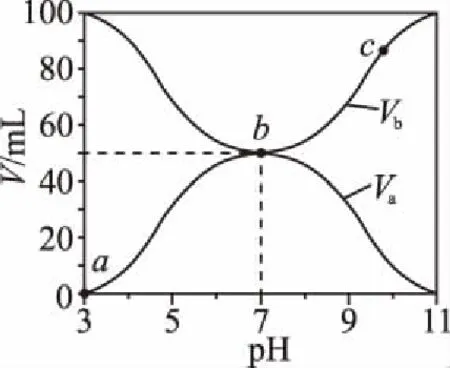
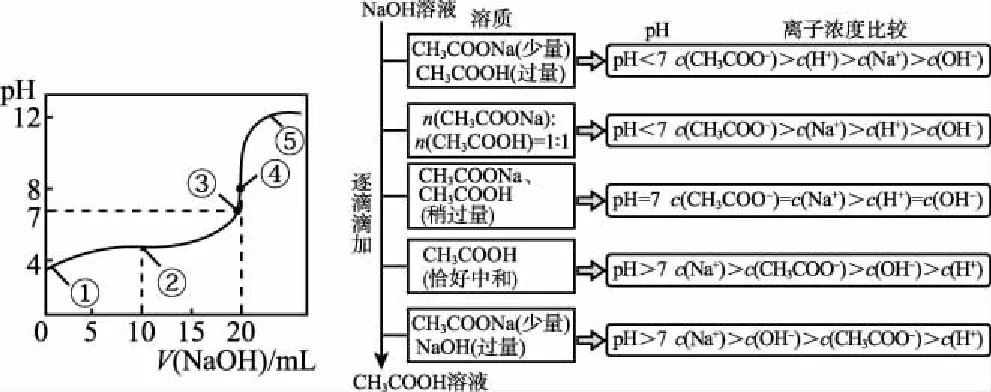
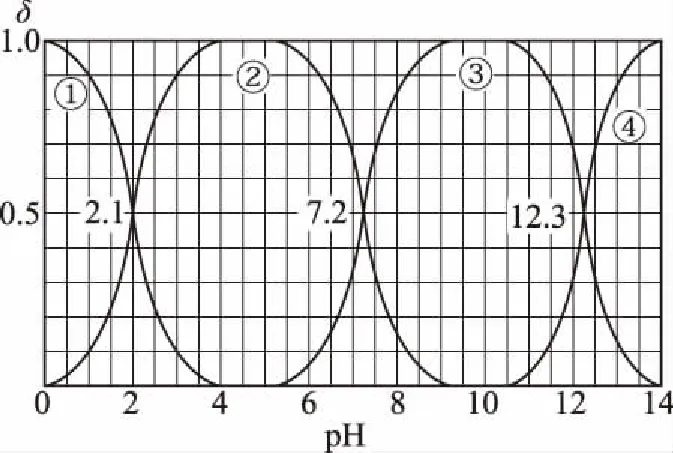
B.M点对应溶液中:c(HX) C.P点对应溶液中:c(Cl-)=0.05 mol/L D.N点对应溶液中:c(Na+)>c(X-)>c(OH-) >c(H+) 【答案】D 【例2】25℃时,向盛有50 mL pH=3的HA溶液的绝热容器中加入1.0 mol/L pH=14的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。下列叙述正确的是 ( ) A.HA溶液的物质的量浓度为0.10 mol/L B.a→b的过程中,混合溶液中不可能存在:c(A-)=c(Na+) C.b→c的过程中,温度降低的主要原因是溶液中A-发生了水解反应 D.25℃时,HA的电离常数K约为1.25×10-6 【答案】D 【例3】(2017年高考新课标Ⅰ卷·13题)常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是 ( ) A.Ka2(H2X)的数量级为10-6 C.NaHX溶液中c(H+)>c(OH-) D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-) 【答案】D 这样的题目往往有两条曲线相对应,一定要看清楚图中纵横坐标表示的意义,找出关键的点并理解其含义。 【例4】25℃时,将浓度均为0.1 mol/L、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100 mL,Va、Vb与混合液pH的关系如图所示。 下列说法正确的是 ( ) A.Ka(HA)的值与Kb(BOH) 的值不相等 B.b点时,水电离出的c(H+)=10-7mol/L C.c点时,c(A-)>c(B+) 【答案】D 【例5】(2018新课标Ⅲ卷·12题)用0.100 mol/L AgNO3滴定50.0 mL 0.050 0 mol/L Cl-溶液的滴定曲线如图所示。下列有关描述错误的是 ( ) A.根据曲线数据计算可知Ksp(AgCl)的数量级为10-10 B.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl) C.相同实验条件下,若改为0.040 0 mol/L Cl-,反应终点c移到a D.相同实验条件下,若改为0.050 0 mol/L Br-,反应终点c向b方向移动 【答案】C 【解析】本题应该从题目所给的图象入手,寻找特定数据判断题目中沉淀滴定的具体过程。注意横坐标是加入AgNO3溶液的体积,纵坐标是Cl-浓度的负对数。A.选取横坐标为50 mL的点,此时向50 mL 0.05 mol/L的Cl-溶液中,加入了50 mL 0.1 mol/L的AgNO3溶液,所以计算出此时溶液中过量的Ag+浓度为0.025 mol/L (按照Ag+和Cl-1∶1沉淀,同时不要忘记溶液体积变为原来2倍),由图示得到此时Cl-约为1×10-8mol/L(实际稍小),所以Ksp(AgCl)约为0.025×10-8=2.5×10-10,所以其数量级为10-10,选项A正确。B.由于Ksp(AgCl)极小,所以向溶液滴加AgNO3溶液时就会有沉淀析出,溶液一直是AgCl的饱和溶液,所以c(Ag+)·c(Cl-)=Ksp(AgCl),选项B正确。C.滴定的过程是用AgNO3滴定Cl-,所以滴定的终点应该由原溶液中Cl-的物质的量决定,将50 mL 0.05 mol/L的Cl-溶液改为50 mL 0.04 mol/L的Cl-溶液,此时溶液中的Cl-的物质的量是原来的0.8倍,所以滴定终点需要加入的AgNO3的量也是原来的0.8倍,因此应该由c点的 25 mL变为25×0.8=20 mL,而a点对应的是15 mL,选项C错误。D.卤化银从AgF到AgI的溶解度应该逐渐减小,所以Ksp(AgCl)应该大于Ksp(AgBr),将50 mL 0.05 mol/L的Cl-溶液改为50 mL 0.05 mol/L的Br-溶液,这是将溶液中的Cl-换为等物质的量的Br-,因为银离子和Cl-或Br-都是1∶1沉淀的,所以滴定终点的横坐标不变,但是因为AgBr更难溶,所以终点时,Br-的浓度应该比终点时Cl-的浓度更小,所以终点由c点移向b点。选项D正确。 【解题策略】 1.酸碱中和滴定曲线变化较多,解题时首先分析清楚纵横坐标的含义,图中曲线关键的点(起点、转折点、交点)与纵横坐标的含义。计算电离常数用电离常数表达式代入特殊点的数据,比较离子浓度大小先要判断溶液的酸碱性,注意结合电荷守恒和物料守恒解决问题。这种题型考查的知识点多,灵活性、综合性较强,有较好的区分度,它能有效地测试出学生对强弱电解质、电离平衡、水的电离、pH、离子反应、盐类水解等基本概念的掌握程度以及对这些知识的综合运用能力。解决这类题目必须掌握的知识基础有:掌握强弱电解质判断及其电离、盐类的水解,化学平衡理论(电离平衡、水解平衡),电离与水解的竞争反应,化学反应类型,化学计算,甚至还要用到“守恒”来求解。 2.常温下,一元强酸(碱)与一元弱碱(酸)滴定曲线是酸碱中和滴定曲线中最简单的一种,答题时首先要计算出酸碱恰好完全反应时所需酸(碱)的体积。水的电离程度最大的点是酸碱恰好完全反应的点,离子浓度大小比较时先确定溶液显酸性还是显碱性,再根据电荷守恒和物料守恒解答。 3.常温下,一种强碱滴定几种弱酸的曲线:通过观察图象,首先要根据pH判断出弱酸酸性相对强弱。计算酸的电离常数要找出关键的点,求出各微粒的浓度代入平衡常数表达式;根据越弱越水解比较离子浓度大小;注意电荷守恒、物料守恒的应用。 4.在绝热环境中的反应,需要注意酸碱中和反应是放热反应,随着酸(碱)的不断加入,溶液的温度逐渐升高。水的电离过程是吸热过程。 【思维建模】 酸碱中和滴定曲线的分析方法: 以一元强碱(NaOH)滴定一元弱酸(CH3COOH)为例,滴定曲线主要考查以下几个关键点(起点、转折点、交点): 一元酸和一元碱的中和滴定为例,滴定曲线主要考查 4个点: ①滴定起点,根据酸、碱的浓度及pH可以判断酸、碱的强弱。 ②恰好反应点,此处为正盐溶液,往往考查离子浓度大小比较。 ③溶液中性点,此处为中性溶液,往往考查消耗酸溶液或碱溶液的体积。 ④滴定2倍点,此处为等物质的量浓度的酸及其正盐或碱及其正盐的混合溶液,往往考查质子守恒。 二元弱酸(或盐)溶液中离子浓度(或分数)图象是近两年高考试题中常出现的题型,主要考查弱电解质电离常数计算、电解质溶液中离子浓度的变化、离子浓度关系等,解题时要看清每条曲线代表的离子种类以及曲线的变化趋势,计算电离常数时应利用曲线的交点(有两种离子浓度相等)。 【例6】25℃,向0.1 mol/L H3PO4溶液中不断加入浓NaOH溶液(溶液体积变化忽略不计),含磷微粒物质的量分数δ随pH的变化曲线如图所示。下列说法正确的是 ( ) 【答案】B 【解题策略】 1.读图:弄清图象含义,通过观察弄清横坐标、纵坐标的含义及单位;搞清特殊点的意义,如坐标轴的原点,曲线的起点、终点、交叉点、极值点、转折点等;分析曲线的变化趋势如斜率的大小及升降。 2.识图:进行信息提取,挖掘隐含信息、排除干扰信息、提炼有用信息,在统摄信息的基础上进行逻辑推理或运用数据计算 【思维建模】 这类题型通常有以下几种考查方式: 1.弱电解质的电离常数计算问题 计算电离常数看清楚是一级电离还是二级电离常数,根据电离方程式,写出电离常数表达式,再找与电离平衡有关的离子浓度相等的点,代入电离平衡表达式;一般采用表达式中分子分母两种酸根浓度相同(通常找交点)时的点进行平衡常数的计算。 2.考查溶液中离子浓度变化趋势 根据溶液中离子浓度或离子浓度比值变化趋势随pH变化,先明确变化的pH范围,用电离平衡或水解平衡的移动解答;离子浓度大小关系则要用物料守恒或电荷守恒解答,同时还要借助图中曲线进行分析。 3.考查溶液中离子浓度关系 比较溶液中离子浓度大小要注意在哪一点或哪一pH范围,利用物料守恒和电荷守恒解答,如果是一个不明确的关系式,需物料守恒和电荷守恒结合构造一个新的关系式判断。离不开反应原理与平衡思想,离不开电荷守恒、物料守恒、质子守恒等守恒关系,离不开挖掘隐含在图象中各种微粒的定性与定量关系。 ( ) A.HX、HY都是弱酸,且Ka(HX)>Ka(HY) D.分别向稀释前的两种溶液加盐酸至pH=7时,c(X-)=c(Y-) 【答案】A 【解题策略】 1.pH相同的一元强酸与一元弱酸加水稀释:由于弱酸溶液中存在电离平衡,根据越稀越电离的原则,在稀释过程中n(H+)逐渐增大,在稀释相同的倍数后,弱酸的c(H+)大于强酸的c(H+);加水稀释后pH相同,弱酸中加水的量多。对强酸来说,溶液稀释到原来的10倍,pH增大一个单位,溶液稀释到原来的10n倍, pH增大n个单位; 对弱酸来说,由于存在电离平衡,溶液稀释到原来的10倍,pH增大小于一个单位;对于弱酸来说,升高温度促进弱电解质的电离。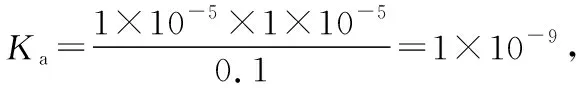
2.绝热条件下,一元强酸(碱)与一元弱碱(酸)中和的滴定曲线
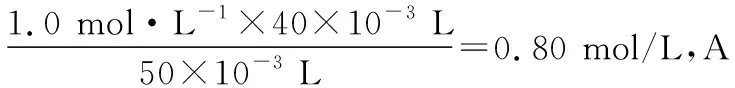
3.一元强碱滴定二元弱酸的曲线

4.酸碱混合后总体积不变的中和滴定曲线
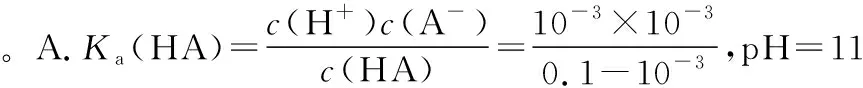
5.沉淀滴定曲线

二、分布曲线的考查

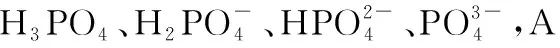
三、稀释曲线的考查