对“原电池”的教学研究
徐 昭
贵州
原电池是中学化学的重要内容,是氧化还原反应的重要应用,是高考的重要考点。原电池考查的核心在于电极的确定以及电极反应式的书写,如何分析原电池,特别是分析陌生度很高的原电池,如何确定电极及正确写出电极反应式既是教学和考试的重点,也是学生学习的难点。
众所周知,现行人教版化学《必修2》第二章(化学反应与能量)第2节(化学能与电能),实验2-4科学探究和思考与交流分别做了Cu - 稀硫酸 - Zn原电池实验,金属(Mg、Cu、Fe)果汁(橙汁、苹果汁、柠檬汁等)实验及苹果电池实验。学到这里,学生手舞足蹈,表现出强烈的兴趣。表面上看,电化学的学习有了良好的开始,但是学到《选修四》第4章“电化学基础”时,半数以上的学生感到困难,电化学的知识并没有刚接触时那么好学,不会做题,反复遭遇失败,信心受到重创。笔者通过不断实践、反思,找到了存在问题的原因在于氧化还原反应的概念教学中没有到位。只有概念教学到位、对应练习到位、课前铺垫到位、课后训练到位,一鼓作气,教学效果才会更棒。那么,怎样操作才能使期望实现呢?解决问题的方法是什么呢?笔者通过以下方法对教学进行调整,取得了不错的教学效果。
一、研究《考试大纲》要求
《考试大纲》中对氧化还原反应的要求是了解氧化还原反应的本质是电子的转移,了解常见的氧化还原反应,掌握常见氧化还原反应的配平和相关计算,了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式,了解常见化学电源的种类及其工作原理。
二、研究考题规律
近年来,高考试题凸显对主干知识的考查。统计发现,氧化还原反应、离子反应、电解质溶液、电化学……这些主干知识几乎每年必考。事实说明,在新课程核心素养背景下的高考,呈现的是相对稳定的过渡和传承。如:2010—2018年,全国卷Ⅰ、卷Ⅱ连续八年都考查了电化学的知识。2016—2018年全国卷Ⅲ第11题,分别考查了“锌 - 空气燃料电池”“固态锂硫电池”“锂 - 空气电池”的电化学知识。
三、研究教学铺垫
1.复习氧化还原反应相关概念
明确什么叫氧化反应?什么叫还原反应?什么叫氧化还原反应?氧化反应的实质是什么?还原反应的实质是什么?氧化还原反应的实质是什么?氧化反应与还原反应的关系是什么?以上概念在氧化还原反应的初次教学中讲解到位,练习到位。根据艾宾浩斯对遗忘规律的研究,进入原电池内容之前,最好检测复习氧化还原反应相关概念,使学生对概念烂熟于心。
2.复习“电流”这一概念,讲清楚原电池的概念
我们知道,氧化还原反应的实质是电子的转移,但是电子并没有定向移动,也就是说,氧化还原反应中的电子转移是自由移动的,那么如何将电子的自由移动变成电子的定向移动呢?借助一个装置,就可以使氧化还原反应中电子的转移(自由移动)转变成电子的定向移动,这个装置就是原电池。由于这个装置形成了电流,所以就有了电能。能量守恒定律告诉我们,能量不会创生,也不会消失,只会从一种形式转化成另一种形式,从一个物体转移到另一个物体,在转化和转移的过程中,总量保持不变。化学反应会释放化学能,毋庸置疑,化学能也可以转化成其他形式的能。因此,从能量转化的角度来看,这个装置将化学能转变成了电能。所以,原电池就是将化学能转变成电能的装置,如教材上的单池原电池、双池原电池。这样,学生就基本掌握了原电池的概念。
3.讲清电极的概念和电极的分类
电极就是电子流入或流出的端口,如生活中的插头、插座、插线板等都是电极。在原电池中,电子流出的电极叫负极,电子流出就是失去电子,所以负极发生氧化反应,带正电,吸引阴离子移向负极。所以,在原电池中,负极可以定义为(1)失电子的电极叫负极;(2) 发生氧化反应的电极叫负极;(3)带正电的电极叫负极;(4)阴离子移向的电极叫负极。讲清楚负极,大多数学生就能自学领悟正极。
电子流入的电极叫正极,电子流入就会有粒子在正极上得到电子,所以正极发生还原反应,带负电,吸引阳离子移向正极。所以,在原电池中,正极可以定义为(1)得电子(电极本身或其他粒子)的电极叫正极;(2) 发生还原反应的电极叫正极;(3)阳离子移向的电极叫正极。
4.讲清电子与电流运动的路径
突出核心素养中“宏观辨识与微观探析”这一要素。电子总是从负极出发,经过外电路到达正极,在内电路(介质为电解质溶液、熔融电解质或固体电解质)中,是阴阳离子移动导电,即阴离子移向负极,阳离子移向正极,电子运动方向与电流方向正好相反,根据电子运动方向可以判断电流运动方向。所以,不论是知道电子运动方向、还是电流运动方向,都可以确定原电池的正负极。
5.讲清原电池构成的条件
(1)有两个电极(大多数不同,也可能相同,如氢氧燃料电池等);(2)有电解质(电解质通常是溶液,也可能是熔融状态或固体电解质);(3)有闭合回路(首尾连通,教学时展示各种闭合回路);(4)有自发的氧化还原反应。
笔者在授课时,用图1强调原电池工作原理,抓住原电池工作原理本质,以不变的工作原理应对万变的情景,突出核心素养中“证据推理与模型认知”这一要素。

图1
用图2、图3介绍不同类型的原电池,从原电池工作原理的角度触类旁通,达到举一反三的效果。
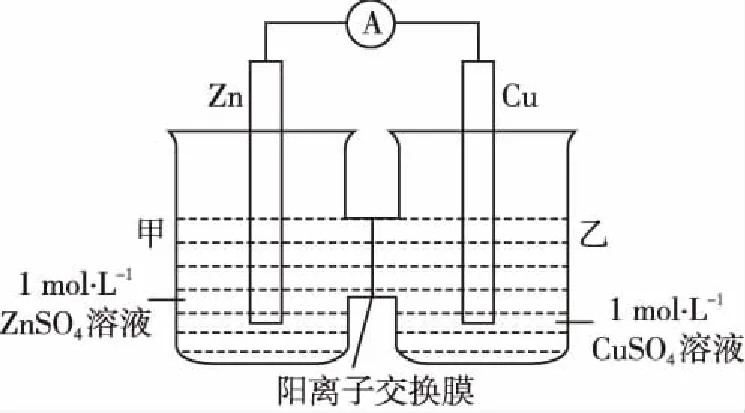
图2

图3
6.讲清原电池电极反应式书写步骤
[列物质、标得失]→负极失电子,氧化反应;正极得电子,还原反应。
↓
[看环境、配守恒]→电极产物在电解质环境下,应稳定且大量存在。
↓
[两相加、验总式]→两电极反应式相加,与总反应式对照验证。
四、例题示范,变式强化
例1.以Pt为电极材料,KOH溶液为电解质溶液的氢 - 氧燃料电池。



变式1:以Pt为电极材料的H2- H2SO4(aq) - O2燃料电池。



变式2:一次电池,Mg - NaOH(aq) - Al电池。


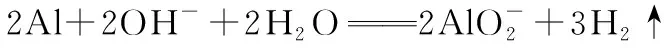
变式3:CO燃料电池,熔融盐(铂为两极,Li2CO3和Na2CO3的熔融盐作电解质,CO为负极燃气,空气与CO2的混合气为正极燃气)。
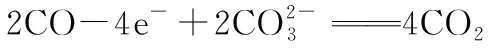
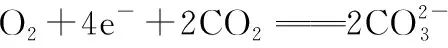

五、直面新题、明确方向
例2.(2018·天津卷·10题节选)O2辅助的Al - CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
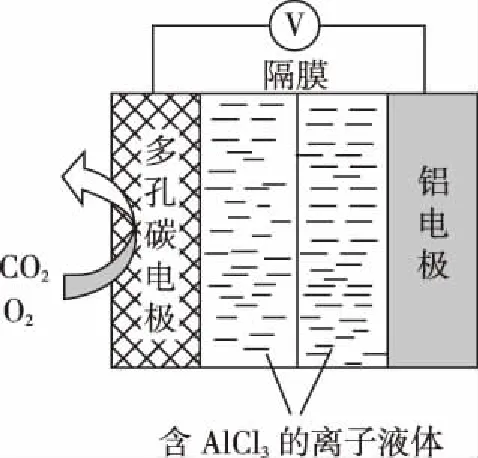
电池的负极反应式:_______________________。
反应过程中O2的作用是_______________________。
该电池的总反应式:_______________________。


( )
B.充电时释放CO2,放电时吸收CO2

【解析】原电池中负极失去电子,发生氧化反应,正极得到电子,发生还原反应,阳离子向正极移动,阴离子向负极移动,充电可以看作是放电的逆反应。



六、总结归纳
原电池正负极的判断方法:
1.根据原电池反应的方程式判断
原电池反应均为自发进行的氧化还原反应,在原电池反应方程式中,先判断出元素化合价升降,元素化合价升高失电子是还原剂,还原剂所在的电极是负极。元素化合价降低得电子是氧化剂,氧化剂所在的电极是正极。
2.根据电流方向或电子移动方向判断
在外电路中,电子总是由负极流向正极,电流由正极流向负极,电子移动方向与电流流动方向相反(内电路中,电流由负极流向正极)。
3.根据电解质溶液里离子的移动方向判断
在原电池的电解质溶液里,阳离子移向的电极是正极,阴离子移向的电极是负极。
4.根据两极发生的反应判断
原电池的负极总是失去电子发生氧化反应,正极总是得到电子发生还原反应。
5.根据原电池的两极判断
一般情况下,较活泼的金属为负极,较不活泼的金属或导电的非金属为正极,但也有特殊情况如:Mg - NaOH(aq) - Al原电池中,Al作负极、Mg作正极。
6.根据电极产生的现象判断
一般情况下,质量减小的一极为负极,质量增大或有气泡产生的一极为正极(如:Pb - H2SO4(aq) - PbO2蓄电池中,原电池工作时,负极Pb转化为PbSO4,正极PbO2转化为PbSO4,负极和正极质量均增加)。


