安胃汤干预肝郁脾虚证胃溃疡大鼠胃窦组织蛋白质组学研究
朱梓铭 唐友明 吴德坤 陈夏 韩叶芬 牛豫杰 郑景辉
1广西中医药大学(南宁 530001);2广西中医药大学附属瑞康医院(南宁 530011)
胃溃疡,属于中医腹痛、胃脘痛、痞满的范畴,其中气郁伤肝,肝失条达,横逆犯胃为主要病机的肝郁脾虚型胃溃疡是其中常见的证型。安胃汤是在全国名老中医林沛湘教授治疗慢性胃病的验方基础上组方而成,方中白芍柔肝健脾止痛,配以柴胡、乌药疏肝解郁止痛,合半夏入胃,更能和胃降逆,燥湿开结,通降气机;薏苡仁健脾除湿;少佐黄连泻火解毒,干姜温中逐寒,寒热同施,辛开苦降;配合百合、炙甘草,则养津护胃,酸甘化阴以生津液,临床疗效显著。但是,现阶段中医药治疗胃溃疡的研究仍存在研究深度不够,缺乏对指标间相互关联探索的问题[1]。为此,本课题组采用蛋白组学与生物信息学分析的手段,从机体、组织或细胞等不同层次的“整体”蛋白质活动的角度,揭示安胃汤治疗肝郁脾虚型胃溃疡大鼠的分子机制,力求更深入地探究中药多靶点在生物分子层面的作用与联系。
1 材料与方法
1.1材料
1.1.1实验动物Wistar雄性大鼠45只,体质量130~170 g。实验过程中对动物处置符合科学技术部关于发布《关于善待实验动物的指导性意见》(国科发财字〔2006〕398号)的要求。动物许可证号:SCXK(桂)2014-0002。
1.1.2药物安胃汤药物组成:半夏(Pinellia ternata)13 g,黄连(Coptis chinensis)5 g,干姜(Zingiber officinale)5 g,乌药(Lindera aggregata)7 g,丹参(Salvia miltiorrhiza)15 g,百合(Lilium brownii)20 g,白芍(Paeonia lactiflora pall)20 g,薏苡仁(Semen coicis)10 g,炙甘草(Glycyrrhiza uralensis)5 g。其制剂制备由广西中医药大学附属瑞康医院中药制剂室提供。鉴定人为唐友明(主任医师,广西中医药大学附属瑞康医院)。
1.1.3主要试剂M-PER蛋白提取试剂盒(批号KGP2100南京凯基生物有限公司),Bradford蛋白浓度测定试剂盒(货号WB013西安赫特生物科技有限公司),蛋白分子量Marker(批号DM111-01北京全式金生物有限公司),质谱级胰蛋白酶(P8101-22S美国Pierce),iTRAQ 4-plex标记试剂盒及缓冲液(批号4381557美国AB Sciex)。
1.1.4主要仪器Agilent 1100 seriesⅡ色谱分离系统(美国Agilent),TempoTMLC MALDI高效液相色谱仪(美国SCIEX),5800 Plus MALDI TOF/TOF串联质谱分析仪(美国SCIEX),Zorbax Bio-SCX SeriesⅡ强阳性离子交换柱(美国Agilent),C18 spin column除盐柱(The Nest Group公司),Magic C18 AQ反相柱(美国Michrom Bioresources),ProteinPilot 2.0软件(美国SCIEX)。
1.2方法
1.2.1模型建立及切片制备
1.2.1.1模型的建立及分组给药将45只清洁型大鼠随机分为正常组、模型组和安胃汤组,每组15只,正常组每日上午3 mL生理盐水灌服,自由饮食,共14 d;模型组与安胃汤组大鼠以多因素复合模拟中医病因并结合乙酸法建立模型[2]:(1)每日上午以每只3 mL灌服大黄制剂液;(2)每日上午以木夹夹大鼠尾中部每只30 min;(3)每日下午将动物负重:于大鼠尾根部缠绕重量为该大鼠体质量10%的保险丝,放入水深50 cm,水温28℃的水槽中游泳,以力竭为度,即大鼠鼻尖没入水面10 s。共14 d。自由饮食;(4)第15天禁食,于禁食24 h后,水合氯醛麻醉下施行剖腹术,打开腹腔,暴露胃体,在富有腺体的部位注射50%的冰乙酸0.05 mL,针头与注射部位呈15°,回纳胃体,关闭腹腔。禁食,不禁水。造模成功后第3天开始给药治疗。安胃汤组大鼠以成人等效剂量的6.17倍灌服[2]。正常组与模型组大鼠予等量生理盐水灌胃。给药21 d后,予以处死大鼠取胃窦组织。
1.2.1.2样本病理切片制备将胃窦组织经甲醛固定,逐级脱水、石蜡浸蜡包埋、连续切片和脱蜡,HE染色,封片,进行组织形态学观察,作病理学诊断。
1.2.2组织样本同位素标记相对和绝对定量(isobaric tags for relative and absolute quantification,iTRAQ)蛋白质组学检测
1.2.2.1蛋白制备及蛋白浓度测定在两组离心管中各加入1 mg/mL BSA蛋白标准溶液各0、2.5、5、7.5、10、12.5、15 μL,然后再分别加入无离子水分别为100、97.5、95、92.5、90、87.5、85 μL,混匀,配制成一系列不同浓度的BSA溶液。各管均加入Bradford工作液1 mL,混匀,静置3 min后测定A595值,重复3次,取其平均值。以BSA蛋白量0~15 μL为纵坐标,所测的相应A595值的平均值为横坐标,绘制标准曲线。标本蛋白浓度测定:取适量的待测蛋白溶液,加实验用缓冲液至100 μL,再加入1 mL Bradford工作液,静置3 min后测定A595值,重复3次,取其平均值。根据标准曲线,计算蛋白样品的浓度。必要时需稀释样品,使其浓度在所测标准曲线的范围内。
1.2.2.2蛋白的酶解和iTRAQ标记将蛋白样品加入胰蛋白酶消化过夜,将酶解样品真空干燥后,溶于iTRAQ溶液缓冲液中。iTRAQ试剂114、115标记模型组,116、117标记安胃汤组,将标记后的所有肽段混合,标记后的样品经过C18 spin column除盐柱除盐,冻干。
1.2.2.3强阳离子柱色谱分离及反相液质联用分析干燥标记后的肽段用缓冲液A(10 mmol/L KH2PO4,25%ACN,pH 2.7)复溶,进到SCX强阳离子预装柱(5 μm,2.1 mm×200 mm),以200 μL/min的速率进行梯度洗脱,缓冲液B(10 mmol/L KH2PO4,350 mmol/L KCl,25%ACN,pH 2.7)洗脱5 min,随后将缓冲液B的比例由5%,对应5 min,至25%对应40 min按20个梯度上升,收集不同梯度浓度条件下洗脱的多肽。收集到的各组份样品稀释后进行反相C18柱(5 μm,77 μm×150 mm)用缓冲液B以5 min由5%到70 min上至35%梯度淋洗和点靶。
1.2.2.4质谱分析与数据处理质谱鉴定和相对定量分析采用5800 Plus MALDI TOF/TOF串联质谱分析仪,用Protein Pilot 2.0联合Uniprot数据库进行检索鉴定蛋白,物种类别选择大鼠,以满足P<0.05,Unused Score>1.3且至少有1个肽段(peptides>1)为鉴定标准报告 Confidence Interval>95%的蛋白,以组间表达差异大于20%区分差异蛋白[3],用114、115、116、117试剂报告离子的峰面积积分进行相对定量分析,以114、115为对照,按照116和117∶114和115的比值,即上调>1.2,下调<0.8,且P<0.05的结果为差异蛋白。
1.2.3差异蛋白生物信息学分析蛋白的功能分析通过DAVID 6.8在线数据库结合GO数据库进行搜索注释和富集分析。提交90个差异蛋白作为进一步分析的蛋白集合,同时选择相对应的标识符为“UNIPROB ACCESION”,勾选大鼠全基因组作为背景基因,用“Convert Tool”对基因标识一体化,然后选择“Functional Annotation Tool”作为分析工具,连接KEGG数据库搜索进行信号传导通路分析。
1.2.4蛋白-蛋白互作(protein-protein interaction,PPI)分析String是研究蛋白与蛋白相互作用的在线生物信息学网站,将本研究表达差异显著蛋白信息导入,最低相互作用分值设置中度置信档,利用Cytoscape构建相互作用拓扑结构图。
2 结果
2.1胃窦组织形态学变化HE染色结果显示,正常大鼠胃窦组织细胞排列正常,黏膜内腺体分布均匀,形状规整;模型对照组黏膜层腺体减少,炎性细胞大量浸润,肉芽组织及纤维组织增生;安胃汤组黏膜腺体分布广泛,形状欠规整,炎性细胞散在浸润。见图1。

图1 大鼠胃窦组织HE染色(×100)Fig.1 The rat gastric tissue stained by HE(×100)
2.2差异蛋白表达筛选结果安胃汤组与模型组比较,质谱分析结果显共鉴定出453个差异表达的蛋白。经筛选共有90个蛋白表达差异具有统计学意义,表达上调的蛋白有60个,表达下调的蛋白有30个(表1)。
2.3差异蛋白GO富集分析结果经分析共有40种生物学过程,10种细胞成分,9种分子功能GO分析显著富集(P<0.05),见图2(生物学过程仅列出前10种)。
2.4差异蛋白富集信号转导通路分析结果差异蛋白主要集中在80条信号转导通路上,其中经Benjamini校正P<0.05的有包括PI3K-AKT(图3)、JAK-STAT、Alzheimer′s Disease等在内的62条通路(图4)。

表1 安胃汤对胃溃疡肝郁脾虚大鼠胃窦组织作用的上下调蛋白Tab.1 Up-regulation and down-regulation of proteins in gastric ulcer rats with syndrome of liver constraint and spleen deficiency treated by Anwei decoction

图2 差异蛋白的GO富集分析结果Fig.2 Results of GO enrichment analysis of differential proteins
2.5PPI分析结果差异表达蛋白相互作用拓扑网络线路清晰,中心性较强,分散中心及孤立结点较少,作用相关性较强,其中AKT1、AKT2、PRKAA1、PIK3CG等蛋白为网络图的互作焦点(图5)。
3 讨论
安胃汤具有修复胃溃疡组织,改善幽门螺杆菌感染,降低远期复发率[4-5],并减少萎缩性胃炎胃黏膜萎缩程度[6]的作用。本研究基于蛋白质组学分析不同层次的“整体”的蛋白质动态变化揭示和阐明疾病与证候的形成,药物与机体相作用的生物学过程,是探讨安胃汤干预肝郁脾虚证胃溃疡机制的一个新切入点。
差异蛋白中富集分析发现:(1)蛋白质磷酸化、氨基酸合成以及多种能量代谢相关的生物学过程方面较为突出,细胞成分较多集中在能量供应的细胞器;(2)通路分析结果共得出PI3K-AKT、JAK-STAT、Alzheimer′s Disease等在内的 62条通路,涉及不同系统,提示部分蛋白作用位可能恰好处于多条信号通路的重要交叉点或部分通路的亚级通路,有可能存在串扰机制;(3)PPI分析发现各节点联系较强,分散中心及孤立结点较少。
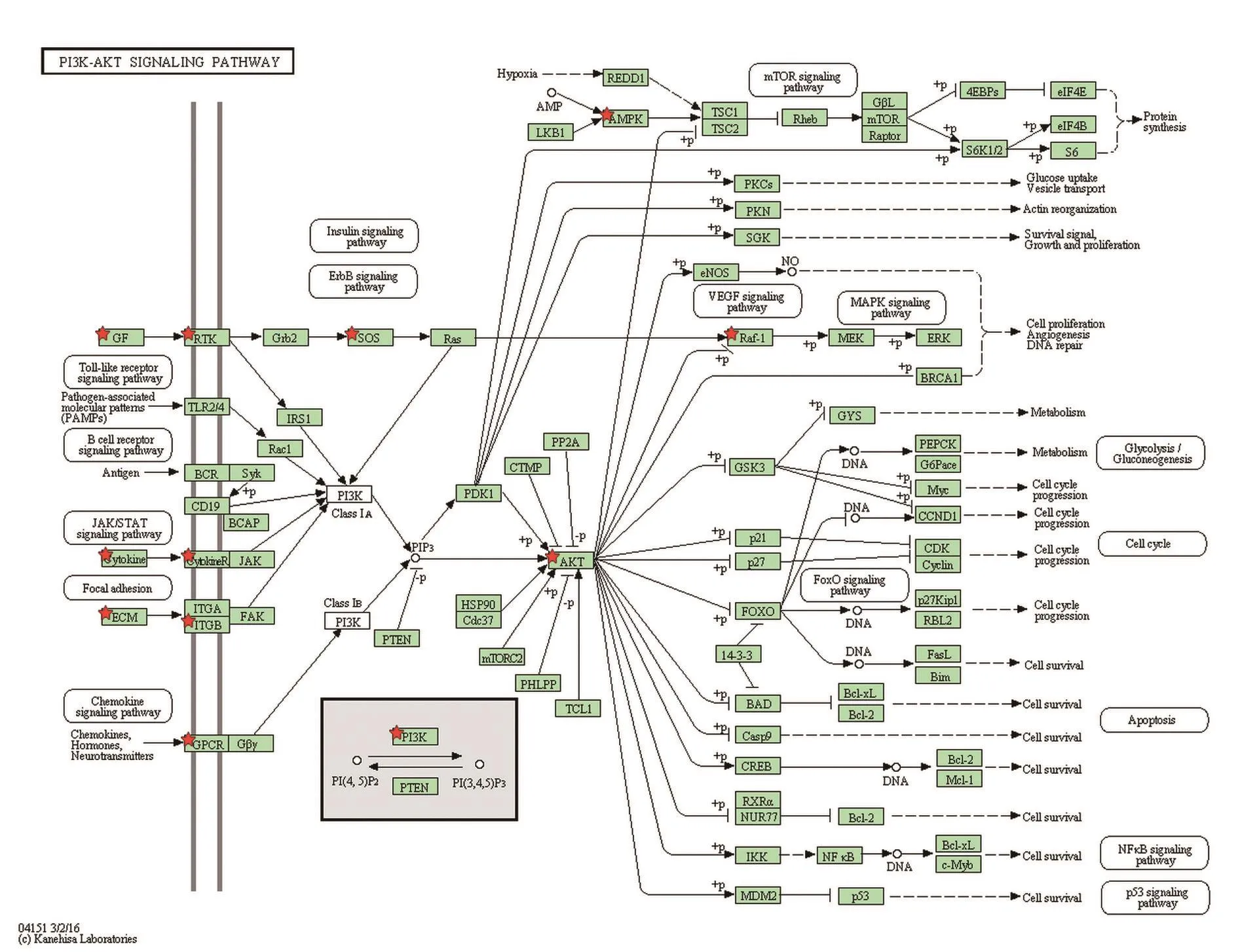
图3 PI3K-AKT信号转导通路示意图(标注五星的位置为本研究中差异蛋白)Fig.3 PI3K-AKT signaling pathway(the five-star marked indicates differential proteins in our study)

图4 差异蛋白KEGG通路富集条形图(条形图表示本研究中差异蛋白在该通路中的数量)Fig.4 KEGG enrichment analysis bar chart of differential protein(bar chart represents the counts of our differential protein in each pathways)
胃溃疡发生的病因复杂,在病理形成阶段,组织黏膜细胞大量破坏,发生能量代谢障碍是其共同特点[7]。其中通过提供必需的氨基酸原料或降低代谢消耗,可以支持胃黏膜的修复并促进愈合[8-11]。富集分析表明多种能量代谢过程被进一步增强和激活,安胃汤有可能具备了类似机制。
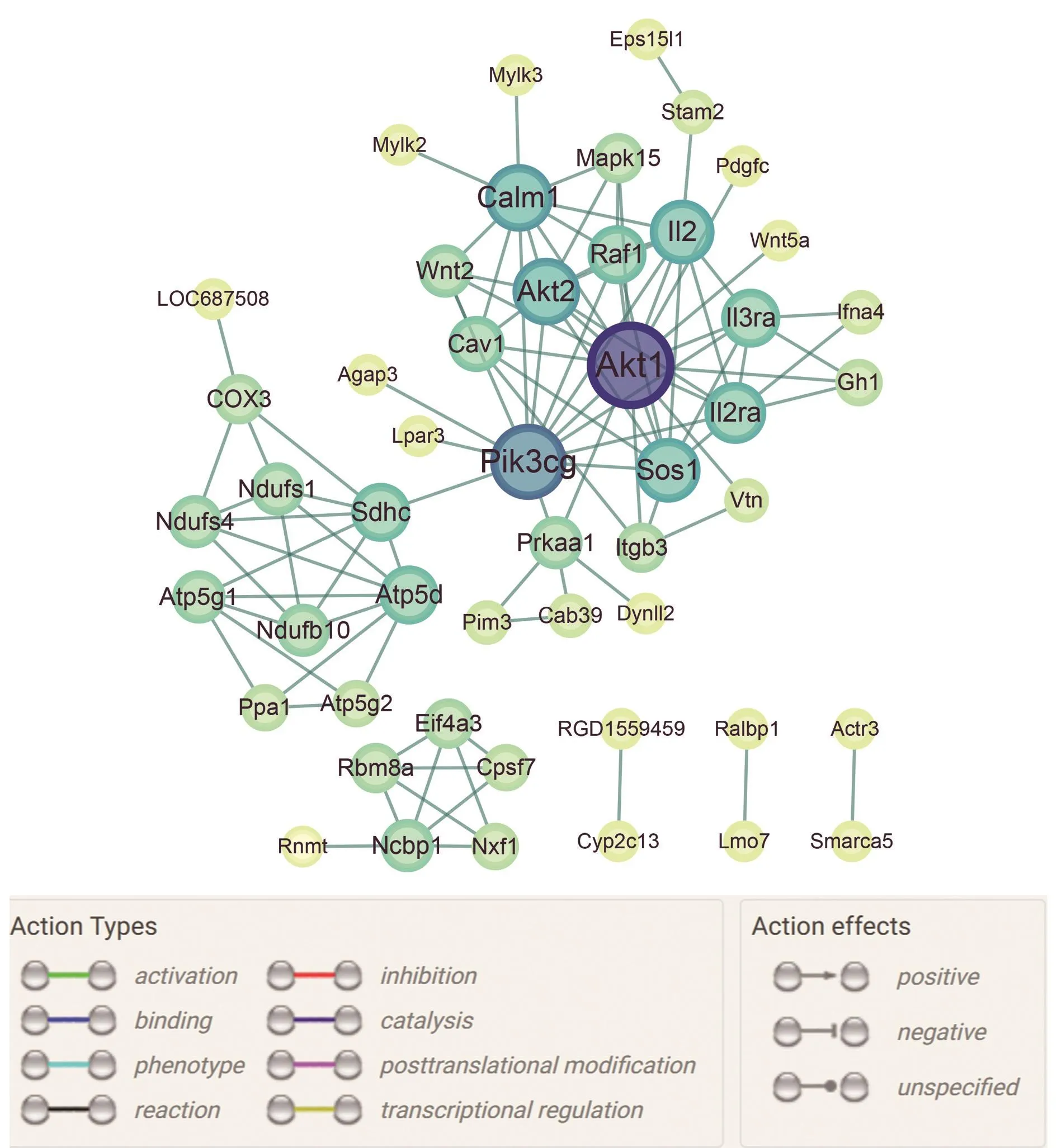
图5 PPI网络拓扑结构图Fig.5 Protein-protein interaction and topological structure diagram of differential proteins
值得注意的是PI3K-AKT信号通路,该通路能调节细胞增殖、分化、凋亡和葡萄糖转运等多种机制,其中PI3K及AKT的激活可以抑制多种细胞凋亡,相反抑制其表达常用于促进肿瘤细胞凋亡[12-13]。前期研究发现安胃汤可通过抑制PI3K-AKT表达从而对慢性萎缩性胃炎发挥疗效[14]。本次结果中PRKAA1、PIK3CG、AKT2上调与治疗萎缩性胃炎的调控方向相反,可能与预防胃溃疡组织细胞凋亡、防治胃黏膜损伤有关。另外,SUN等[15]和SHEN等[16]的研究也发现肠三叶因子、康复新液等的胃黏膜保护作用与PI3K-AKT通路激活有关。
另外,该通路下游的Ras通路、VEGF通路、ErbB通路也显著富集,EGF和VEGF表达量增加是促进黏膜血管再生修复并恢复胃溃疡损伤组织功能的机制之一[17-18]。桃叶珊瑚甙、龙胆苦甙、石斛多糖等在修复不同证型的胃溃疡中,与EGF、VEGF表达的变化也有明显关联[19-22]。前期研究已证实安胃汤能促进胃黏膜EGF的表达[5],本次实验中该通路的RAF1、SOS1等蛋白的差异表达,与前期研究有一定吻合。
PI3K-AKT下游mTOR通路也被富集,许多肿瘤细胞中存在有编码mTOR信号通路内相关蛋白的突变基因并且存在该通路蛋白的过度激活[23],因此抑制该通路表达对治疗癌变有一定价值[24],中药在治疗功能性消化不良、癌前病变上通过调控该通路发挥疗效[25-26]。安胃汤在治疗慢性萎缩性胃炎上有一定疗效[4],该结果对后续进一步研究起到前瞻性作用。
综上,本研究基于蛋白质组学分析了安胃汤治疗胃溃疡的机制,可能与调节代谢、抑制细胞凋亡、促进黏膜再生等有关,其中PI3K-AKT通路及其下游信号通路与安胃汤前期研究机制存在部分切合,值得后续进一步探究。

