Sox5促进胰腺癌细胞迁移侵袭和上皮间质化
余 伟 马 达 刘礼军 张志标
胰腺癌是一种死亡率极高的消化道癌症[1]。由于胰腺癌早期诊断困难,仅有20%的患者在确诊后具有手术机会,但其5年生存率不到5%[2]。因此,针对胰腺癌的早期诊断和个体化治疗将有望延长胰腺癌患者的生存时间,是该领域研究的重点。
Sox(SRY-related High-mobility-group-box)家族根据氨基酸序列的同源性分为A-J共10个亚组族,Sox5为Sox D家族的主要成员[3]。Sox5除了与良性疾病有关,还与淋巴瘤、肝癌、乳腺癌、前列腺癌和结直肠癌的发生发展密切相关[4]。Sox7在胰腺癌细胞PANC-1、SW1990中沉默表达,BXPC-3、CFPAC-1细胞中高表达[5]。但Sox5在胰腺癌中的作用及机制尚未完全阐明。上皮间质转化(Epithelial-mesenchymal Transitions, EMT)是上皮细胞失去原有的常态极性和与基底膜连接的上皮细胞表型,以获得抗凋亡、降解细胞外基质和较高迁移侵袭能力的过程[6]。其主要分子特征为E-cadherin、α-catenin、β-catenin、细胞角蛋白和桥粒蛋白等上皮细胞标志物表达下调,波形蛋白、纤连蛋白和N-钙黏蛋白等间质表型标记物表达上调[7]。这些变化使细胞黏附能力下降,运动能力、迁移能力和侵袭能力增加,利于肿瘤浸润转移[8]。除此之外,转录因子的表达上调,上皮表型蛋白的丢失及信号转导通路的激活等均利于肿瘤生长。EMT在多种癌症,如膀胱癌、肺癌、乳腺癌、结肠癌和宫颈癌中均发挥重要作用[9-14]。有报道,EMT可以调控胰腺导管腺癌细胞的迁移、侵袭力[15]。但EMT在胰腺癌中的作用尚未完全清楚。
本研究将检测胰腺癌细胞中Sox5的表达,探讨沉默及过表达Sox5对胰腺癌细胞迁移、侵袭和EMT的影响,以期为胰腺癌的靶向治疗提供新靶标。
1 材料与方法
1.1 细胞、药剂和仪器
人正常胰腺细胞HPDE6-C7、胰腺癌细胞PANC-1和AsPC-1购自中国科学院上海细胞库;shSox5、shControl、pcDNA 3.1-Sox5、Scrambled、载体pcDNA 3.1、Sox5抗体、E-cadherin抗体、N-cadherin抗体、Vimetin抗体、Snail抗体 和Twist1抗体、Matrigel基质胶购自美国Invitrogen公司;Transwell小室(货号:3413)购自美国Corning公司;PVDF膜(货号:ISEQ00010)购于德国罗氏诊断有限公司;LipofectamineTM2000脂质体(货号:11668-027)、SDS-PAGE 试剂盒(货号:P1200-1/P1200-2)、ECL发光液(NCI:4106)和RIPA蛋白裂解液(货号:R0020)均购自碧云天生物技术公司;DMEM培养基(货号:31600)、胎牛血清(货号:16000-044)、BCA蛋白定量试剂盒(货号:P0012-8)、逆转录试剂盒(货号:FSQ-101)购于大连Takara公司;半干转膜仪购自美国BIO-RAD公司;ABI 7500型实时荧光定量PCR系统购自美国ABI公司;Genesys 10系列紫外分光光度计购自美国Thermo公司;310系列细胞培养箱购自美国Forma Scientific公司;T100 PCR 仪购自美国BIO-RAD公司。
1.2 方法
1.2.1 细胞培养:人正常胰腺细胞HPDE6-C7(HPDE6-C7组)、胰腺癌细胞PANC-1(PANC-1组)和AsPC-1(AsPC-1组)均用含10%胎牛血清的DMEM培养液进行常规细胞培养。每2-3天更换培养液消化传代一次。取对数生长期的细胞采用qRT-PCR和Western blot分别检测Sox5 mRNA和蛋白水平。
1.2.2 转染:将shSox5、shControl、pcDNA 3.1-Sox5和Scrambled应用LipofectamineTM2000脂质体转染胰腺癌细胞PANC-1,分别标记为shSox5组、shControl组、pcDNA 3.1-Sox5组和Scrambled组。将转染后的细胞培养至对数生长期进行qRT-PCR实验、Western Blot 实验和Transwell实验。
1.2.3 qRT-PCR实验:取适量对数生长期的转染细胞及HPDE6-C7、PANC-1、AsPC-1组细胞,Trizol裂解液裂解细胞,RNA抽提试剂盒提取RNA,分光光度计法进行RNA定量。立即用逆转录试剂盒合成cDNA,qRT-PCR试剂盒进行各转染细胞Sox5 mRNA、E-cadherin mRNA、N-cadherin mRNA、Vimetin mRNA、Snail mRNA和Twist1 mRNA的检测及HPDE6-C7、PANC-1、AsPC-1细胞中Sox5 mRNA水平的检测。以GAPDH为内参照,采用2-△△Ct法计算目的mRNA相对表达量。实验重复3次。
1.2.4 Western blot 实验:取适量对数生长期的转染细胞及HPDE6-C7、PANC-1、AsPC-1细胞,RIPA裂解后CBA进行蛋白定量,沸水变性10 min离心取上清准备上样。准备好相对应的Sox5(1∶100)、E-cadherin(1∶500) 、N-cadherin(1∶250) 、Vimetin(1∶200) 、Snail(1∶250) 和Twist1(1∶250)抗体。实验步骤按照免疫蛋白电泳实验技术手册操作。以目的条带灰度值与GAPDH灰度值的比值表示目的蛋白的表达情况。
1.2.5 Transwell实验:取适量对数生长期的转染细胞,调整细胞密度为106个/孔接种于6孔板,常规培养至细胞融合度达到70%,更换为无血清培养基培养过夜。另调整各组细胞密度为105个/ml,取100μl加入上室内,600μl含血清的培养基加入下室内,继续培养过夜。取出小室,用棉签擦去上室内的细胞,PBS洗涤2次,甲醇固定30min,0.1%结晶紫染色20min,PBS洗涤2次。显微镜下观察小室下表面附着的迁移细胞,随机取5个视野拍照计数,取平均数,计算各组迁移细胞数。另取Transwell小室,将小室的上室涂适量基质胶后再加入100μl适当密度的转染胰腺癌细胞,其它操作与检测细胞迁移数相同,最后显微镜下观察小室下表面附着的细胞数量,随机取5个视野拍照计算,取平均值,计算各组侵袭细胞数。
1.3 统计学处理
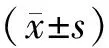
2 结果
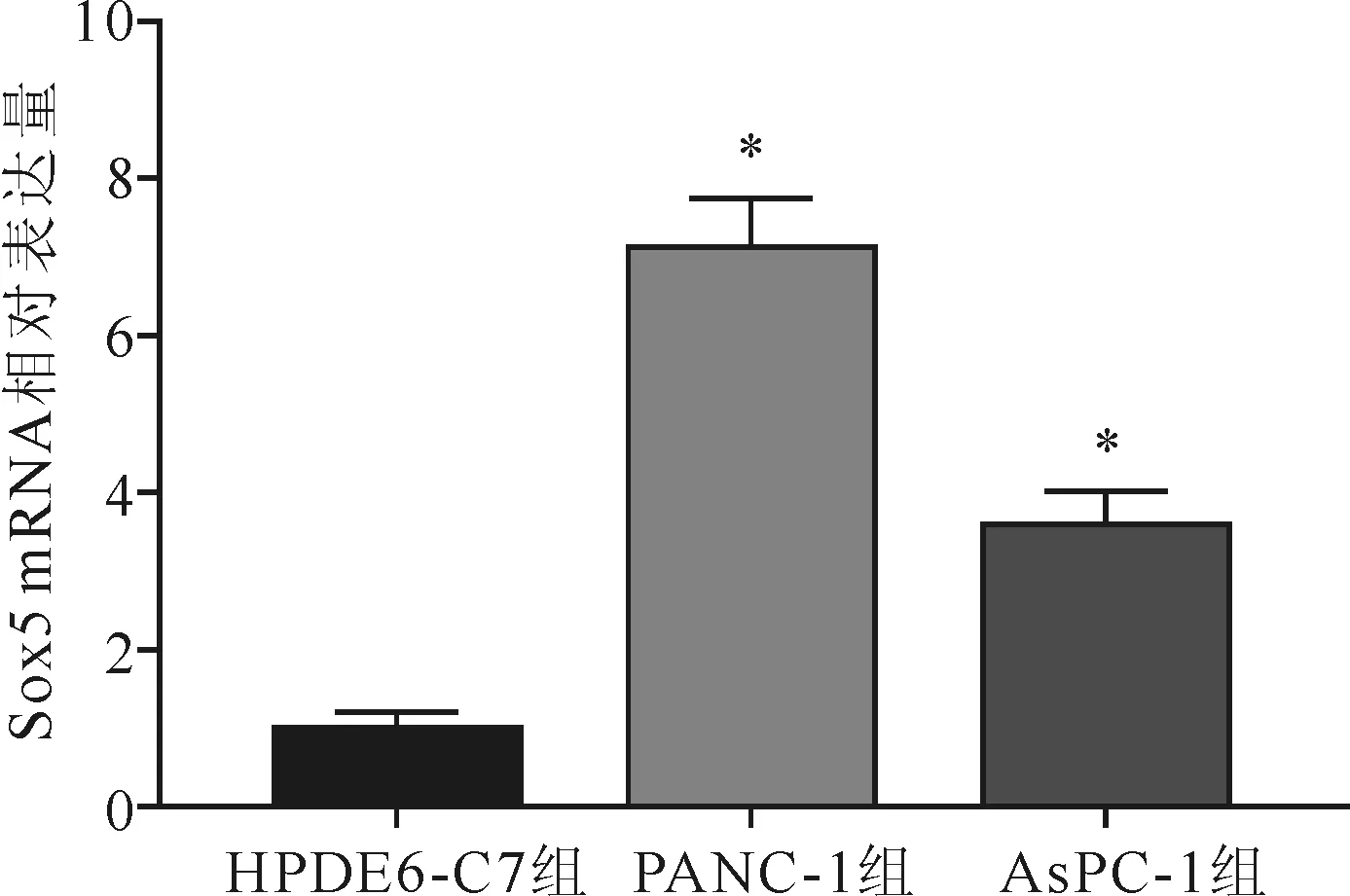
2.1 正常胰腺细胞和胰腺癌细胞Sox5 mRNA和蛋白水平
各组Sox5 mRNA(1.01±0.25,7.25±0.67,3.68±0.45)和蛋白表达水平(0.23±0.06,0.80±0.06,0.55±0.06)差异均具有统计学意义(FmRNA=123.571,F蛋白=68.028,P<0.01)。与HPDE6-C7组比较,PANC-1组和AsPC-1组Sox5 mRNA和蛋白表达水平均升高(mRNA:t1=22.156,t2=9.480;蛋白:t1=16.455,t2=9.238;P均<0.01)。见图1、图2。
注:与HPDE6-C7组比较,*P<0.01
注:与HPDE6-C7组比较,*P<0.01
2.2 干预Sox5对凋亡相关基因 mRNA表达的影响
shControl组、shSox5组、Scrambled组、pcDNA 3.1-Sox5组凋亡相关基因Sox5(1.00±0.09,0.20±0.07,1.00±0.09,2.22±0.24)、E-cadherin(1.04±0.31,2.99±0.21,1.01±0.11,0.59±0.09)、N-cadherin(1.07±0.20,0.31±0.08,1.04±0.19,2.65±0.30)、Vimetin(1.02±0.25,0.35±0.04,0.99±0.16,1.95±0.39)、Snail(1.01±0.15,0.46±0.04,0.99±0.21,1.71±0.20)和Twist1(1.02±0.13,0.33±0.11,1.02±0.23,3.79±0.40) mRNA表达水平差异均具有统计学意义(FSox5=105.937,FE-cadherin=86.426FN-cadherin=67.684,FVimetin=21.530,FSnail=29.156,FTwist1=116.865,P<0.01)。与shControl组比较,shSox5组Sox5、N-cadherin、Vimetin、Snail和Twist1的mRNA表达显著降低,E-cadherin mRNA表达显著升高(tSox5=9.879,tE-cadherin=16.866,tN-cadherin=6.339,tVimetin=4.720,tSnail=5.792,tTwist1=4.860,P均<0.01);与Scrambled组比较,pcDNA-3.1-Sox5组Sox5、N-cadherin、Vimetin、Snail和Twist1的mRNA表达显著升高,E-cadherin mRNA表达显著降低(tSox5=15.065,tE-cadherin=3.633,tN-cadherin=13.428,tVimetin=6.763,tSnail=7.582,tTwist1=19.510,P均<0.01)。见图3。

注:与shControl相比较,*P<0.01;与Scrambled组比较,#P<0.01
2.3 干预Sox5对凋亡相关蛋白表达的影响
shControl组、shSox5组、Scrambled组、pcDNA 3.1-Sox5组EMT和凋亡相关蛋白Sox5(0.67±0.09,0.24±0.02,0.33±0.03,0.59±0.08)、E-cadherin(0.37±0.05,0.83±0.05,0.85±0.04,0.46±0.04)、N-cadherin(0.87±0.03,0.21±0.03,0.24±0.03,0.75±0.04)、Vimetin(0.69±0.05,0.25±0.03,0.43±0.05,0.62±0.07)、Snail(0.84±0.03,0.43±0.04,0.62±0.06,0.85±0.04)和Twist1(0.63±0.05,0.25±0.05,0.35±0.03,0.74±0.04)表达水平差异均具有统计学意义(FSox5=31.968,FE-cadherin=90.183,FN-cadherin=325.465,FVimetin=43.657,FSnail=62.597,FTwist1=84.947,P均<0.01)。与shControl组比较,shSox5组Sox5、N-cadherin、Vimetin、Snail和Twist1的蛋白表达显著降低,E-cadherin蛋白表达显著升高(tSox5=11.850,tE-cadherin=17.597,tN-cadherin=34.866,tVimetin=14.667,tSnail=16.186,tTwist1=10.748,P均<0.01);与Scrambled组比较,pcDNA-3.1-Sox5组Sox5、N-cadherin、Vimetin、Snail和Twist1的蛋白表达显著升高,E-cadherin 蛋白表达显著降低(tSox5=7.165,tE-cadherin=14.919,tN-cadherin=26.942,tVimetin=6.333,tSnail=9.080,tTwist1=11.031,P均<0.01)。见图4。

注:与shControl组比较,*P<0.01;与Scrambled组比较,#P<0.01
2.4 干预Sox5对胰腺癌细胞迁移、侵袭的影响
运用Transwell法检测胰腺癌细胞的迁移、侵袭量,shControl组、shSox5组、Scrambled组、pcDNA 3.1-Sox5组胰腺癌细胞迁移量(153.72±19.10,44.93±13.07,149.60±11.60,228.72±10.47)和侵袭量(107.66±10.99,31.43±7.71,107.83±9.65,150.58±5.68)的差异均具有统计学意义(F迁移=87.805,F侵袭=96.576,P<0.01)。与shControl组比较,shSox5组胰腺癌细胞迁移、侵袭量均显著降低(t迁移=13.495,t侵袭=15.105,P<0.01);与Scrambled组比较pcDNA-3.1-Sox5组胰腺癌细胞迁移、侵袭量均显著升高(t迁移=9.815,t侵袭=8.471,P<0.01)。见图5、图6。

图5 Transwell实验观察各组细胞迁移和侵袭(光学显微镜,×400)
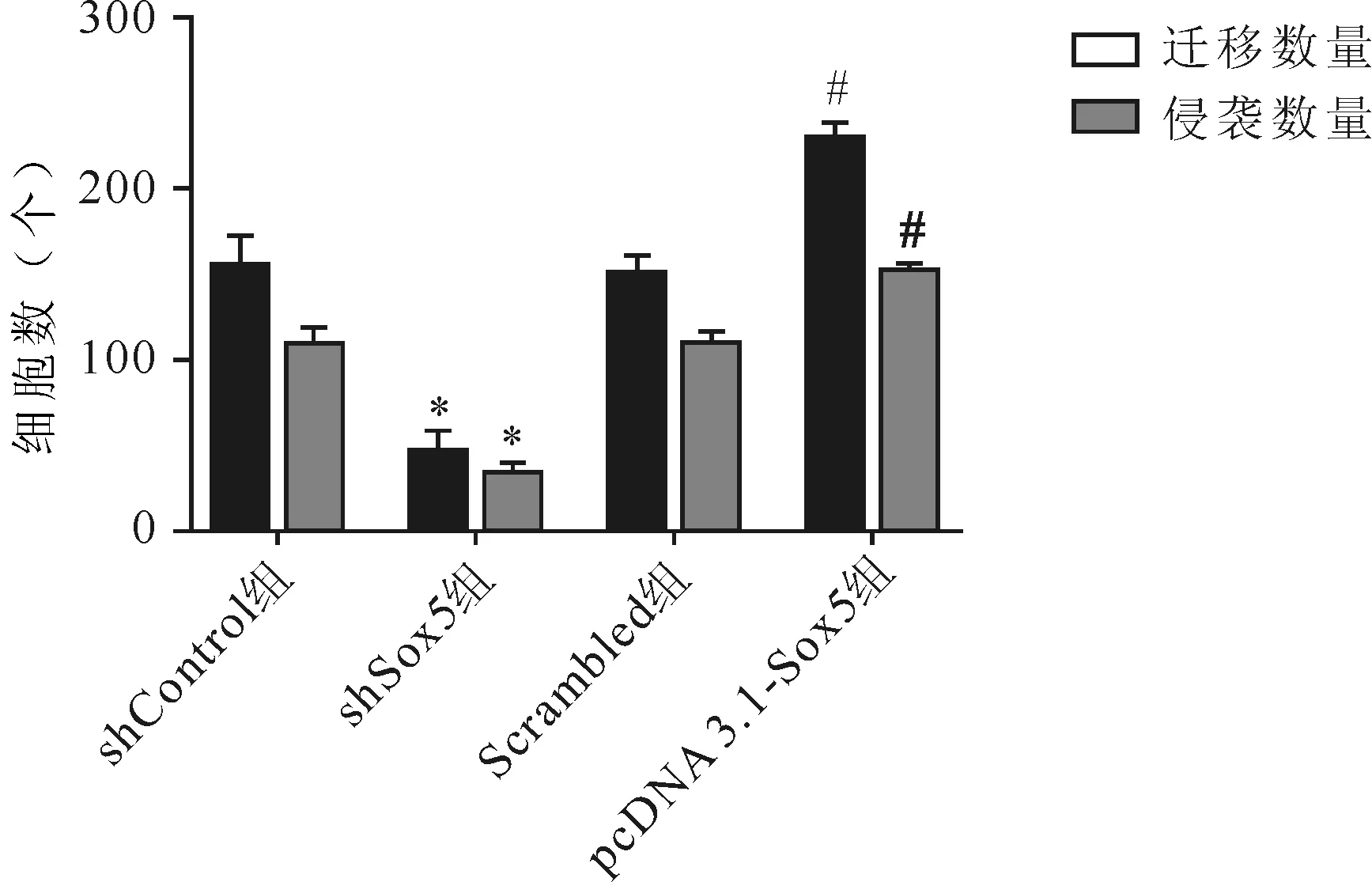
注:与shControl组比较,*P<0.01;与Scrambled组比较,#P<0.01
3 讨论
Sox5是Sox家族中的重要一员,该基因位于12p12.1,共包含29个外显子,经过转录翻译成为Sox5蛋白,具有HMG(High-mobility-group)结构域,可直接结合DNA或与其它蛋白结合调节基因表达[16]。 Sox5 蛋白作为转录因子广泛参与胚胎发育、神经生长、干细胞形成等重要生长发育过程,是细胞命运和细胞分化的调控者[17]。已有研究发现,Sox5不仅调节正常的生理过程,还参与肿瘤的发生发展[18]。有研究报道,Sox5在乳腺癌中高表达为其易发生转移和预后差的分子标记物,可通过转录上调Twist1活性,促进EMT发生,有利于乳腺癌转移[19]。李景峰等[20]在研究肉骨瘤的过程中,通过沉默Sox5脂质体转染肉骨瘤细胞MG63,采用免疫印迹检测迁移和侵袭相关蛋白发现,Sox5能促进肉骨瘤细胞的迁移和侵袭。胡接平[21]在前列腺癌的研究中发现,在持续性雄激素治疗前列腺癌的过程中,AR对于Sox5的抑制作用消失,导致Sox5的表达升高,癌细胞的增殖能力恢复,癌细胞可能受到TGF-β等细胞因子作用发生EMT,促进癌症转移,并建议针对前列腺癌的治疗,阻断Sox5及其下游因子可能为新的策略。Wang等[22]发现,Sox7在胰腺癌组织中表达下调,与胰腺癌患者的病理分级密切相关。Higashihara等[23]在研究胰腺癌中证实,具有高表达Sox9的胰腺癌细胞(PANC-1,CapaN-1)显示出比具有低表达Sox9的胰腺癌细胞(BxPC-3,MIA PaCa-2)更强的对吉西他滨的耐药性,且沉默Sox9可恢复PANC-1的耐药性,抑制裸鼠体内肿瘤的生长。本研究通过检测胰腺癌细胞中Sox5 mRNA和Sox5蛋白的表达,分别对沉默Sox5和过表达Sox5的胰腺癌细胞进行迁移侵袭和EMT相关因子的检测发现,Sox5可促进胰腺癌细胞迁移侵袭和EMT。
癌症发生转移和侵袭是一个复杂的生物学过程。其包括癌细胞的局部侵袭、进入脉管系统,逃逸出血管到周围靶组织进行种植,形成原发癌细胞的克隆株[23]。在此期间,癌细胞之间的黏附能力减弱、运动能力增强是侵袭转移的基础。而EMT为上皮癌细胞提供了侵袭转移的条件[24]。Theys等[25]在研究人类肿瘤细胞中发现,肿瘤细胞上皮间质转化的发生和上调是肿瘤原发性浸润和继发性转移中的关键因素。Gou等[26]在肝癌细胞中的研究中发现,Runx3通过miR-186/E-cadherin/EMT通路抑制肝癌细胞迁移侵袭,沉默miR-186可抑制肝癌细胞的迁移侵袭。Zhang等[27]研究报道,在胰腺癌中miR-135b-5p可通过靶向NR3C2促进胰腺癌细胞的迁移、侵袭和EMT。本研究通过检测胰腺癌细胞中EMT相关因子E-cadherin、N-cadherin、Vimetin、Snail和Twist1的mRNA水平和蛋白表达,揭示Sox5对EMT的促进作用。
总之,Sox5可促进胰腺癌细胞的迁移侵袭和EMT,这些发现将为胰腺癌的靶向治疗提供新靶标。

