肥胖合并急性坏死性胰腺炎大鼠肺组织损伤及肺表面活性蛋白A和炎性指标变化
鄂 恒 梅方超,2 余 佳,2 李 满,2 项明伟,2 刘志勇,2 王卫星,*
急性坏死性胰腺炎(Acute Necrotizing Pancreatitis, ANP)是不同病因导致的胰腺组织水肿、出血及自身消化,起病急、进展快、严重危害患者生命健康。有研究观察到ANP在发病早期可出现全身炎症和多器官功能障碍,肺损伤即为常见并发症之一[1],而且认为肥胖可以加重急性肺损伤(Acute Lung Injury,ALI),导致呼吸功能衰竭[2, 3]。肺表面活性蛋白A(Surfactant Protein-A, SP-A)是肺表面活性物质中含量最多的大分子蛋白,具有维持肺泡内环境稳态、调节免疫功能等作用,可能对ALI有益,但肥胖则下调SP-A在肺泡上皮的表达,降低SP-A肺保护作用。有研究证实,肥胖合并哮喘小鼠肺组织SP-A含量较非肥胖小鼠明显减少,从而加重哮喘病情[4]。但SP-A在肥胖合并ANP肺损伤时的组织水平变化及合并炎症反应所见报道较少。本研究通过建立肥胖合并ANP大鼠模型,观察其肺组织学改变、SP-A和炎症相关介质水平变化。
1 材料与方法
1.1 主要试剂和仪器
高脂饲料(HFD,D12492)购自北京华阜康公司,普通饲料(本院动物室提供);牛磺胆酸钠(STC)结晶购于美国Sigma公司(T4009),使用前用无菌生理盐水溶解、配制成5%溶液;髓过氧化物酶(MPO,GB11224),核因子-κB (NF-κB)p65 (GB11142)和白细胞介素-1β(IL-1β,GB11113)抗体购自武汉谷歌公司;天冬氨酸特异性半胱氨酸蛋白酶(Caspase-3,ab4051)和SP-A(ab115791)抗体购自美国Abcam公司;即用型免疫组化试剂盒(A液,B液,KIT-9921)购自福州迈新公司;全自动荧光显微镜(BX63)购自日本奥林巴斯公司。
1.2 实验分组和ANP模型制备
SPF级SD大鼠24只,按随机数字表法分为两组:高脂饲料组(H组,n=12)和普通饲料组(N组,n=12);H组每天添加足量HFD,N组每天添加足量普通饲料;连续喂养8周。8周之后从H组及N组中随机取出6只大鼠,参考mei等[5]的方法制备普通饲料大鼠ANP模型(N-ANP组)和HFD大鼠ANP模型(H-ANP组),即用异氟烷(诱导浓度4—5%,维持浓度2%-3%,氧流量1.5L/min)麻醉后开腹,4.5号头皮针穿过十二指肠系膜缘,经乳头逆行插入主胰管,以0.1ml/min一次性恒速注射5%STC溶液(1ml/kg),夹闭主胰管5min,见两组大鼠胰腺出现水肿、出血,查血淀粉酶(AMY)、脂肪酶(LIP)水平均明显升高即表明ANP模型制备成功。术后,4组大鼠均皮下注射无菌生理盐水补液(2ml/100g)。
1.3 肺组织病理学检查
成模后12h,麻醉方法处死4组大鼠,开胸摘取每只大鼠右肺组织,于4%甲醛溶液中固定,常规方法石蜡包埋,切片若干张,其中部分切片行常规HE染色,其余切片用作免疫荧光和免疫组化分析。根据程石等[6]的方法将HE染色切片于光镜下观察组织学变化并行病理学评分。肺泡壁水肿程度:无水肿(0分),轻度水肿(1分),中度水肿(2分),重度水肿(3分);间质和肺泡腔出血范围:无出血(0分),少量出血(1分),出血范围25%-50% (2分),出血范围50%-70%(3分);间质和肺泡单核细胞和中性粒细胞浸润程度:无浸润(0分),少量浸润(1分),较多浸润(2分),大量浸润(3分)。
1.4 免疫荧光法检测肺组织SP-A、MPO及IL-1β表达
取肺组织石蜡切片脱蜡,EDTA缓冲液中微波抗原修复,10%驴血清室温下孵育45min,加入一抗SP-A(1∶250)、MPO(1∶300)及IL-1β (1∶300),湿盒中4℃孵育过夜。室温下复温1h,PBS冲洗,加入二抗(1∶200)室温下孵育45min,PBS冲洗,4’,6-二脒基-2-苯基吲哚(DAPI)染核。荧光显微镜下观察拍照,细胞质绿色或红色为阳性。采用美国Media Cybernetics 公司Image pro-Plus图像处理软件分析各组阳性细胞百分率。
1.5 免疫组化法检测肺组织NF-κB 及Caspase-3表达
取肺组织石蜡切片脱蜡,柠檬酸钠缓冲液中高压抗原修复,3%双氧水室温孵育10min,加入一抗(1∶300),湿盒中4℃孵育过夜。室温下复温1h,PBS冲洗,加入试剂A液(35μl ,福州迈新公司)室温下孵育15min,PBS冲洗,加入试剂B液(35 μl 福州迈新公司)室温下孵育15min,PBS冲洗,DAB显色,苏木素复染,中性树胶封片。光镜下观察拍照,肺组织细胞呈棕黄色或胞质中有棕黄色颗粒均为阳性,用Image pro-Plus图像处理软件分析阳性细胞百分率。
1.6 统计学处理

2 结果
2.1 各组肺组织病理学改变和评分比较
N组和H组肺组织结构清晰,肺泡壁完整,肺间质无渗出;N-ANP组肺间隔增宽,炎性细胞浸润明显,肺泡腔内可见渗出物,肺泡腔塌陷,局灶性实变;H-ANP组病理变化较N-ANP组进一步加重。4组病理评分差异具有统计学意义(F=116.260,P<0.01)。其中H组与N组差异无统计学意义(t=-0.542,P>0.05),N-ANP组高于N组和H组(tn=11.314、10.862,P均<0.01);H-ANP组明显高于N-ANP组(7.50±1.04 vs 5.60±1.03,t=3.051,P<0.01)。见图1、图7。

注:与H组比较,*P<0.05,与N-ANP组比较,#P<0.01
图1各组大鼠肺组织病理评分
2.2 各组肺组织SP-A表达水平比较
4组SP-A阳性细胞从N组到H-ANP组逐渐减少,4组间表达水平差异具有统计学意义(F=191.00,P<0.01)。其中H组较N组表达减少(28.00±1.41 vs 32.10±1.72,t=4.58,P<0.01),N-ANP组较H组明显减少(19.80±1.47 vs 28.00±1.41,t=13.34,P<0.01),H-ANP组较N-ANP组减少更多(13.00±1.41 vs 19.80±1.47,t=-8.20,P<0.01)。见图2、图8。
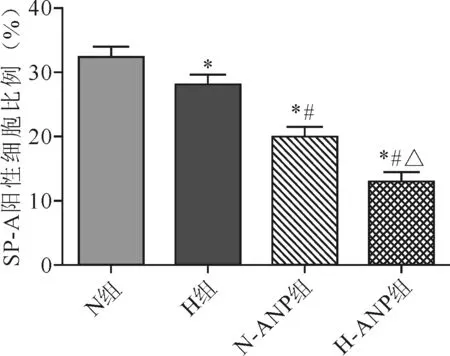
注:与N组比较,*P<0.01; 与 H组比较,#P<0.01; 与 N-ANP组比较,△P<0.01
图2各组大鼠肺组织SP-A表达
2.3 各组肺组织相关炎性介质表达水平比较
2.3.1 MPO:4组大鼠MPO水平差异有统计学意义(F=632.30,P<0.01)。两两比较,H组与N组MPO水平无明显差异(t=-1.0,P>0.05);N-ANP较N组明显增加(t=-44.737),H-ANP组又较N-ANP组明显增加(t=14.279),差异均有统计学意义(P<0.01)。见图3、图9。
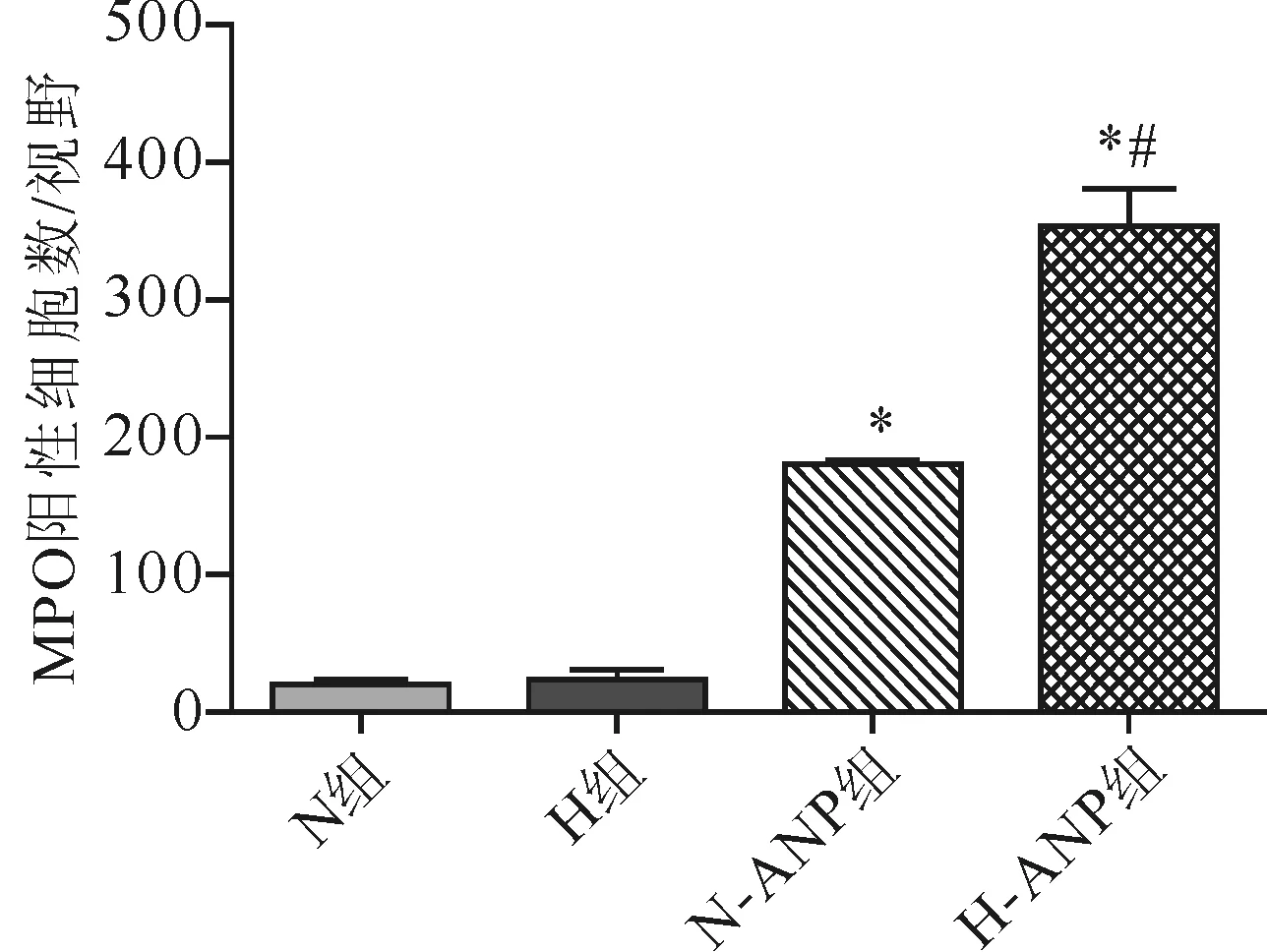
注:与H组比较,*P<0.01;与N-ANP组比较,#P<0.01
图3各组大鼠肺组织MPO表达
2.3.2 NF-κB:4组大鼠NF-κB 水平差异有统计学意义(F=232.10,P<0.01)。两两比较,H组与N组NF-κB水平无明显差异(t=-0.786,P>0.05);N-ANP组较H组明显增加(t=-20.228),H-ANP组又较N-ANP组明显增加(t=4.518),差异均具有统计学意义(P<0.01)。见图4、图10。
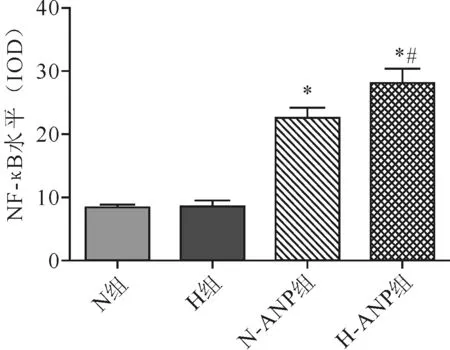
注:与H组比较,*P<0.01;与N-ANP组比较,#P<0.01
图4各组大鼠肺组织NF-κB水平表达
2.3.3 IL-1β:4组大鼠IL-1β水平差异有统计学意义(F=566.40,P<0.01)。两两比较,H组与N组IL-1β水平无明显差异(t=-1.472,P>0.05);N-ANP组较H组明显增加(t=-25.636),H-ANP组又较N-ANP组明显增加(t=7.656),差异均有统计学意义(P<0.01)。见图5、图11。

注:与H组比较,*P<0.01;与N-ANP组比较,#P<0.01
图5各组大鼠肺组织IL-β水平比较
2.3.4 Caspase-3:4组大鼠Caspase-3水平差异具有统计学意义(F=466.60,P<0.01)。两两比较,H组与N组Caspase-3水平无明显差异(t=-0.987,P>0.05);N-ANP组较H组明显增加(t=-26.382),H-ANP组又较N-ANP组明显增加(18.10±0.95 vs 16.00 ±0.80,t=4.125),差异均有统计学意义(P<0.01)。见图6、图12。

注:与H组比较,*P<0.01;与N-ANP组比较,#P<0.01
图6 各组大鼠肺组织Caspase-3水平比较
3 讨论
AP主要由胆源性疾病、过度饮酒、高脂血症等原因引起,可分为轻症急性胰腺炎(Mild Acute Pancreatitis, MAP)、中重症急性胰腺炎(Moderately Severe acute Pancreatitis, MSAP)及重症急性胰腺炎(Severe Acute Pancreatitis, SAP)[7]。近年研究发现肥胖者胰周大量脂肪为皂化反应提供原料,使肥胖机体代谢发生改变,增加AP发病率;肥胖者机体脂肪因子(如瘦素、脂联素、抵抗素)水平改变,可加重AP病情,影响AP患者预后[8, 9]。病情严重的AP患者可发展为全身多器官功能障碍(Multiple Organ Dyfunction,MOD),肺即为常见受累器官之一。已有报道,肥胖特别是腹型肥胖患者,其膈肌及胸壁的顺应性下降、运动受限,气道阻力增加,通气功能损伤,可增加AP患者ALI和急性呼吸衰竭的风险[10]。本次实验也证实,ANP肥胖大鼠肺组织病理损伤程度较非肥胖大鼠更加严重。提示肥胖可加重ANP时ALI程度。但目前有关ANP时ALI的具体机制尚不完全明确,本文对SP-A活性及炎症反应对其作用进行了观测分析。

图7 各组大鼠肺组织病理变化(HE,×200)
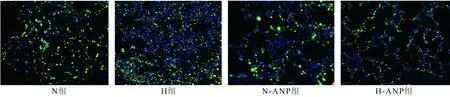
图8 各组大鼠肺组织SP-A表达(免疫荧光法,胞质绿色为阳性细胞,×200)

图9 各组大鼠肺组织MPO表达(免疫荧光法,胞质绿色为阳性细胞,×200)

图10 各组大鼠肺组织NF-κB表达(免疫组化,棕黄色为阳性细胞,×200)

图11 各组大鼠肺组织IL-β表达(免疫荧光法,胞质红色为阳性细胞,×200)

图12 各组大鼠肺组织Caspase-3表达(免疫组化,棕黄色为阳性细胞,×200)
SP-A是肺表面活性蛋白之一,可调节磷脂的分泌、摄取,并有免疫防御功能;肺泡损伤时肺组织SP-A表达减少[4]。有研究认为,SP-A减少可使肺泡表面活性物质(Pulmonary Surfactant,PS)活性降低、代谢障碍,使PS对脂质过氧化物、氧自由基的抵抗能力明显减弱[11]。SP-A还可以抑制细胞因子、炎性介质的合成及释放,起到调控局部炎症反应的作用[12]。本文结果显示,ANP(包括N-ANP和H-ANP)大鼠SP-A表达均较N组、H组大鼠减少,H-ANP组较N-ANP组减少更明显。表明ANP,尤其肥胖ANP可显著下调肺表面SP-A表达,从而加重肺泡细胞的损伤。但外源性补充SP-A后,可以减轻肺组织的炎症反应,保护肺组织[13]。因此认为,肥胖所致肺组织SP-A相对不足可加重ANP;而肺组织损伤会使SP-A的合成与分泌更少,导致肥胖合并ANP患者肺损伤更加严重。
NF-κB具有多向性转录调节作用,参与机体炎性介质的表达调控,广泛存在于真核细胞核内,参与多种生理病理过程。AP时,NF-κB的异常激活可促进促炎因子如IL-1β、IL-6等的释放,触发炎性介质的“瀑布样级联反应”,加重AP病情[7]。Xia等[14]研究发现,抑制NF-κB活性后,AP肺组织NF-κB活化水平降低,且肺组织MPO、IL-1β表达的水平明显下降,肺损伤程度明显减轻。而本研究结果显示,N-ANP组大鼠肺组织NF-κB、 MPO、IL-1β和Caspase-3表达水平较N组和H组明显升高,提示炎症反应对ANP时ALI起到一定的作用;而H-ANP组上述指标表达水平较N-ANP组升高更显著,表明肥胖可加重ANP时肺组织的炎性反应,进而加重肺损伤。此等作用可能是肥胖作为一种低程度的全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),当机体受到更强烈的炎症刺激时,更有利于免疫系统更快、更强烈的激活,进而导致组织器官损伤[15]。还有研究认为,肥胖可增加氧化应激及活化氧产物的形成,导致肺组织损伤及炎性细胞的浸润,加重肺损伤[16]。
综上所述,肥胖大鼠ANP肺损伤程度较非肥胖大鼠更加严重,可能与肥胖大鼠肺组织SP-A表达下调促进肺组织炎症反应有关。但肥胖导致肺组织SP-A减少的具体机制尚需进一步研究。

