HSP27在热打击致F98细胞氧化应激损伤及细胞凋亡中的作用
李红波,苏磊,林新峰,温敏勇,赵锋利,吴思慧,王林
热射病属重症中暑分型,以高热、抽搐、昏迷等为主要临床表现,致残、致死率高,临床回顾性分析显示,30%的存活者出院后仍遗留有神经损伤,症状包括意向性震颤、运动失调、遗忘、偏瘫等[1-2]。本课题组前期研究已证实,重症中暑神经损伤与氧化应激反应及丝裂原活化蛋白激酶(mitogenactivated protein kinases,MAPKs)家族共同参与调控的神经细胞凋亡有关[3],并明确热打击可通过p38 MAPK/MAPK激活蛋白激酶2(MAPK-activated protein kinase 2,MK2)途径上调活性氧(reactive oxygen species,ROS)水平而促进细胞凋亡[4]。热休克蛋白27(heat shock protein,HSP27)作为应激性小热休克蛋白已被广泛研究[5],但在热打击致神经细胞损伤中的作用及调控位点尚未见文献报道。本研究以前期建立的F98细胞(大鼠神经胶质瘤细胞株)热打击模型为基础,探讨HSP27与热打击神经细胞氧化应激反应及细胞凋亡的调控关系,以期为深入研究中暑神经损伤的机制提供线索。
1 材料与方法
1.1 细胞、试剂与仪器 大鼠神经胶质瘤细胞株F98购自上海细胞生物研究所。细胞活力检测试剂盒(cell counting kit-8,CCK-8)购自武汉博士德生物工程有限公司;AnnexinV-异硫氰酸荧光素/碘化丙啶(fluorescein isothiocyanate/propidium iodide,FITC/PI)凋亡检测试剂盒购自上海联科生物;ROS检测试剂盒[分子探针7'-二氯二乙酸酯(2',7'-dichlo rodihydrofluorescein diacetate,DCFH-DA)]购自美国Thermo Fisher Scientific公司;caspase-3活性检测试剂盒、p38抗体、磷酸化(phosphorylation,p)-p38抗体、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)抗体、p-JNK抗体、细胞外信号调节蛋白激酶(extracellular signal-regulated protein kinase,ERK)抗体、p-ERK抗体、p38调节/激活蛋白激酶(p38 regulated/activated protein kinase,PRAK)抗体、p-PRAK抗体、p38特异性抑制剂SB203580、JNK特异性抑制剂SP600125、ERK特异性抑制剂PD98059、无活性抑制剂SB202474、MK2特异性抑制剂2'-氟-N-(4-羟基苯基)-[1,1'-联苯]-4-丁酰胺(CMPD-1)购自美国Cell Signaling Technology公司;MK2抗体、p-MK2抗体购自英国Abcam公司;HSP27抗体、p-HSP27抗体、pSer15-HSP27抗体、pSer78-HSP27抗体、pSer82-HSP27抗体购自美国Santa Cruz公司;腺病毒(adenovirus,Ad)-MK2、Ad-PRAK、AdSer15-HSP27、AdSer78-HSP27、AdSer82-HSP27购自美国ViGene Biosciences公司。Image J图像工作站购自美国Kodak公司;酶标仪购自美国Infinite M1000公司。
1.2 热打击细胞模型的建立及分组 取常规培养的对数生长期F98细胞进行热打击细胞模型构建[6]。实验前1d按1.0×105/ml密度将细胞铺于培养皿中,而后置于43℃循环水浴箱中培养60min再转入37℃培养,是为模型细胞。每个实验分组如下,每组3个样本。
1.2.1 热打击后F98细胞内HSP27总蛋白水平变化实验分为5组,即对照组及R0、R3、R6、R12组,后4组分别于0、3、6、12h复温时间点收集细胞,对照组始终留置于37℃环境内。
1.2.2 热打击后F98细胞HSP27丝氨酸位点磷酸化水平变化 实验分为6组,即对照组及R0、R3、R6、R9、R12组,采用相同条件热打击F98细胞,在0、3、6、9、12h复温时间点收集细胞,分别使用pSer15-HSP27抗体、pSer78-HSP27抗体、pSer82-HSP27抗体检测HSP27各个位点的磷酸化水平;并以磷酸化水平峰值之对应时间点确定后续研究的观测点。
1.2.3 HSP27与p38MAPK的调控关系 实验分为5组,即对照组,HS+SB202474(20μmol/L)组,HS+SB203580(20μmol/L)组,HS+PD98059(10μmol/L)组,HS+SP600125组(10μmol/L)。使用MAPKs家族抑制剂SB203580、SP600125、PD98059分别预处理F98细胞30min,以SB202474为对照,给予相同条件热打击,于复温一定时间检测HSP27的Ser15、Ser78、Ser82磷酸化水平。
1.2.4 HSP27与MK2、PRAK的调控关系实验分为5组,即对照组,热打击组(HS),HS+ADPRAK(A)组,HS+ADMK2(A)组,HS+CMPD-1(MK2抑制剂)组。分别应用MK2特异性抑制剂CMPD-1、转染Ad-MK2(A)、转染Ad-PRAK(A)(无活性p38调节/激活蛋白激酶)预处理F98细胞,给予相同条件热打击,于复温一定时间检测HSP27的Ser15、Ser78、Ser82磷酸化水平。
1.2.5 HSP27磷酸化在热打击致F98细胞凋亡中的作用 实验分为5组,即对照组,HS组,HS+ADSer15-HSP27(A)组,HS+ ADSer78-HSP27(A)组,HS+ ADSer82-HSP27(A)组。将F98细胞分别转染HSP27磷酸化位点的抑制性突变腺病毒,即AdSer15-HSP27(A)、AdSer78-HSP27(A)、AdSer82-HSP27(A),给予相同条件热打击,于复温一定时间检测其细胞活力、ROS、Caspase-3活性及细胞凋亡水平。
1.3 Western blotting检测蛋白表达水平 收集各组F98细胞,常规进行Western blotting检测,以Image J图像工作站分析HSP27及其位点Ser15、Ser78、Ser82的磷酸化水平。
1.4 流式细胞术检测细胞凋亡率 使用Annexin V-FITC/PI凋亡检测试剂盒,将各组F98细胞制备成单细胞悬液后加入5μl Annexin V-FITC及10μl PI溶液,混匀置于流式管中,温室避光染色30min后流式细胞术检测并计算细胞凋亡率。
1.5 细胞ROS检测 使用活性氧检测试剂盒(DCFH-DA荧光探针)检测细胞中活性氧含量,于荧光显微镜下随机抽取5个视野摄片,使用软件计算荧光强度的平均值。
1.6 统计学处理 采用Graphpad Prism 5软件进行统计分析。多组间比较采用单因素方差分析,两组间进行Fisher最小显著性差异检验。P<0.05为差异有统计学意义。
2 结 果
2.1 热打击后F98细胞HSP27蛋白水平变化 细胞在受到60min热打击后即刻HSP27表达水平轻度升高,但与对照组比较差异无统计学意义(P>0.05),而后随作用时间延长HSP27表达水平逐步增高,至12h时明显升高,与对照组比较差异有统计学意义(图1A,P<0.05),表明热打击可诱导F98细胞HSP27表达增强。
2.2 热打击后F98细胞HSP27磷酸化水平变化HSP27的3个丝氨酸位点(Ser15、Ser78、Ser82)在热打击早期即已发生磷酸化;Ser78位点磷酸化水平于热打击后0h时明显升高,3~6h达高峰,12h时仍高于对照组水平(P<0.05);Ser82位点的磷酸化水平于热打击后3h达峰值,随后逐步下降,12h时与对照组比较差异无统计学意义;Ser15位点的磷酸化水平在6~9h时达高峰,12h时磷酸化水平有所下降,但仍高于对照组(图1B,P<0.05)。提示热打击使HSP27的3个丝氨酸位点磷酸化水平升高,以Ser78位点最为显著。后续研究选择复温3h作为观测点。
2.3 热打击F98细胞中HSP27调控的信号途径HS+SB202474组中HSP27的位点Ser15、Ser78、Ser82位点均发生磷酸化,以Ser78磷酸化水平最高(P<0.05);HS+SB203580组中HSP27的3个位点亦发生磷酸化,但明显低于HS+SB202474组,以Ser78位点磷酸化水平下降最为显著(P<0.05);而HS+PD98059组及HS+SP600125组F98细胞HSP27丝氨酸位点的磷酸化水平与HS+SB202474组比较均无明显差异(图1C,P>0.05)。可见在p38MAPK、ERK、JNK通路中,只有p38 MAPK的抑制剂可抑制HSP27的磷酸化,而ERK、JNK的抑制剂对HSP27的磷酸化无明显影响,表明p38 MAPK通路对热打击细胞HSP27磷酸化具有调节作用。
2.4 热打击F98细胞中p38 MAPK通路与HSP27的调控关系 HS+CMPD-1组及HS+ADMK2(A)组F98细胞HSP27丝氨酸位点的磷酸化水平明显低于HS组,差异有统计学意义(P<0.05);而HS+ADPRAK(A)组的F98细胞HSP27的3个位点磷酸化水平与热打击组比较未见明显差异(图1D,P>0.05)。表明MK2对热打击细胞HSP27活化具有调控作用。
2.5 HSP27磷酸化在热打击致F98细胞氧化应激损伤中的作用 用重组腺病毒分别抑制HSP27不同位点的磷酸化,结果显示,与HS组比较,HS+ADSer78-HSP27(A)组F98细胞活力明显升高,ROS水平、caspase-3活性及细胞凋亡率明显下降,差异有统计学意义(图2,P<0.05);而HS+ADSer15-HSP27(A)组、HS+ADSer82-HSP27(A)组的F98细胞活力、ROS水平、caspase-3活性及细胞凋亡率与HS组比较,差异无统计学意义(图2,P>0.05)。提示p38MAPK/MK2路径通过调控HSP27 Ser78位点的磷酸化实现对热打击F98细胞ROS水平乃至凋亡的调节。
3 讨 论
重症中暑(heatstroke)可导致全身血容量不足,进而发生脑缺血、缺氧,引起神经细胞凋亡,导致中枢神经系统损伤甚至衰竭[7]。本课题组前期研究已证实,热打击可引起中枢神经细胞氧化应激损伤,并通过p38MAPK/MK2途径上调ROS导致神经细胞凋亡。小热休克蛋白HSP27是一种凋亡调控因子,可经蛋白激酶催化发生多位点磷酸化,MK2对HSP27磷酸化的主要区域为Ser15、Ser78、Ser82[8]。在静息状态,几个HSP27分子结合在一起,形成大分子伴侣的多聚体,当细胞受到Toll样受体(Toll-like receptors,TLRs)激动剂、白介素-1β(interleukin -1β,IL-1β)或肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等的激活时,MK2即被活化,磷酸化并解聚HSP27以实现复杂信号的转导,从而促进肌动蛋白聚合,增加细胞迁移[9]。
本研究结果显示,热打击可诱导F98细胞HSP27蛋白水平轻度升高,并引起HSP27丝氨酸位点磷酸化水平明显升高,以Ser78位点磷酸化为主(图1B);分别给予MAPKs家族抑制剂(SB203580、PD98059及SP600125)预处理后,p38特异性抑制剂SB203580可使HSP27磷酸化水平显著降低,表明HSP27是p38MAPK活化的下游靶点,JNK、ERK通路对热打击F98细胞HSP27磷酸化的影响不大。分别用CMPD-1或转染Ad-MK2(A)、Ad-PRAK(A)来预处理F98细胞后,HS+CMPD-1组及HS+ADMK2(A)
组F98细胞HSP27的丝氨酸磷酸化水平较HS组明显下降(图1D,P<0.05),说明HSP27是MK2的下游分子。将F98细胞分别转染HSP27的3个位点抑制性腺病毒,结果显示转染ADSer78-HSP27的F98细胞ROS水平、caspase-3活性和细胞凋亡率明显低于HS组(图2A-D,P<0.05)。可见,p38MAPK/MK2途径主要通过磷酸化HSP27的Ser78位点上调ROS来介导F98细胞凋亡。

图1 热打击对F98细胞HSP27蛋白表达及活化的影响(Western blotting)Fig.1 Effect of heat stress on the expression and activation of HSP27 protein in F98 cells (Western blotting)
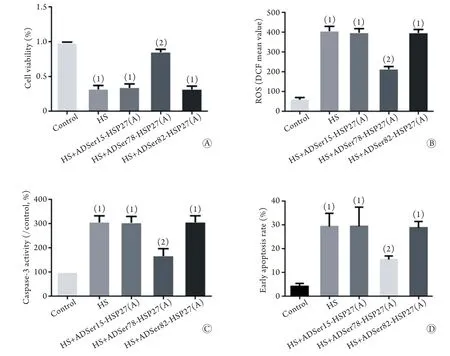
图2 HSP27磷酸化在热打击致F98细胞氧化应激损伤中的作用Fig.2 Effects of HSP27 phosphorylation on heat stress-induced oxidative stress injury in F98 cells
大量文献研究证实HSP27为凋亡抑制因子。HSP27能与高温、缺氧、缺血、寒冷等各类应激产生的错误折叠蛋白结合,发挥着细胞保护功能。如Leak等[10]证实HSP27过表达可维持血脑屏障的完整性,降低脑内中性粒细胞计数并抑制多种细胞因子的分泌,改善血源性分子、水分渗出和炎症细胞进入脑实质。HSP27以非磷酸化形式存在,作为分子伴侣,对心肌缺血/再灌注状态下的细胞保护作用也至关重要[11]。HSP27的过表达也往往与肿瘤相关,本研究选择大鼠脑神经胶质瘤细胞,其HSP27表达量比正常神经元明显增高[12]。
HSP27作为支架蛋白可促进MK2和蛋白激酶B(protein kinase B,PKB,即Akt) 之间的相互作用,并增强MK2介导的Akt Ser473磷酸化作用。MK2被认为是Akt活化的非典型丙酮酸脱氢酶激酶2(pyruvate dehydrogenase kinase 2,PDK2)的候选分子,不断地为人类中性粒细胞提供生存信号。因为Akt2可以特异性诱导p47phox(NADPH氧化酶的胞质亚基)磷酸化和膜转位,MK2可能通过激活Akt2基因介导信号通路调节NADPH氧化酶的激活;p38 MAPK参与p47phox磷酸化,MK2也可能通过p38 MAPK活化反馈调控NADPH氧化酶的活化[13-14]。因此,MK2可直接和间接参与调控NADPH氧化酶的活化,即促进大量ROS生成,从而发生氧化应激损伤。
HSP27在热打击条件下对神经胶质细胞氧化应激损伤的调控作用少有报道。研究表明,HSP27的功能与翻译后修饰密切相关,HSP27丝氨酸位点磷酸化可诱导大低聚物解聚为四个小单位[15],其不同的细胞效应取决于特定的丝氨酸残基的磷酸化。Stetler[16]、Yuan[17]等发现,在体外和体内神经元缺血状态下,野生型HSP27(HSP27-WT)和HSP27天冬氨酸突变体(HSP27-D,磷酸化模拟)过表达能够有效减少局灶性脑缺血后梗死体积,对缺血性神经元损伤具有保护作用,并改善神经功能,该作用通过抑制下游凋亡信号调节激酶1(apoptosis signalregulating kinase 1,ASK1)通路而实现;HSP27丙氨酸突变体(HSP27-A,非磷酸化)过表达则无法被磷酸化,可能与其高分子量的低聚物持续存在相关。该研究表明,HSP27需要蛋白激酶D(protein kinase D,PKD)介导磷酸化来抑制ASK1细胞死亡信号通路,从而发挥缺血性神经损伤的保护作用。
本实验证实,热打击通过p38MAPK/MK2途径磷酸化HSP27的Ser78位点调节ROS来介导F98细胞凋亡。但在同为肿瘤细胞的乳腺癌细胞中,HSP27高度磷酸化则促进肿瘤增殖和转移,似乎有矛盾之处。有研究发现,芹菜素可诱导白血病细胞HSP27的Ser78和Ser82位点的双峰磷酸化,HSP27晚期的磷酸化依赖于p38活性及蛋白激酶Cδ(protein kinase Cδ,PKCδ)的调控,p38弱或不表达可降低HSP27丝氨酸位点的磷酸化水平,PKCδ弱表达或不表达可使Ser15和Ser82磷酸化水平下降,而不影响Ser78的磷酸化水平;Ser15、Ser78和Ser82位点突变后,HSP27-WT或HSP27-A表达明显降低了芹菜素诱导处理9h的caspase-3活性,HSP27-D过表达的白血病细胞凋亡明显增加[18],提示芹菜素通过p38 MAPK调节HSP27磷酸化而诱导白血病细胞凋亡,支持本研究结果。因此,HSP27磷酸化位点的不同与氧化应激损伤及细胞凋亡之间的关系除受到不同细胞种系、刺激因素、药物环境等影响外,也可能受到其他细胞信号网络相互调节而发挥不同的作用,仍需要拓展实验进一步研究。
综上所述,本研究基于F98细胞热打击模型,证实了热打击可使HSP27的3个位点均发生明显磷酸化,以Ser78位点磷酸化为主,明确了HSP27为p38MAPK/MK2的下游分子,主要通过磷酸化HSP27的Ser78位点调节ROS来促进F98细胞凋亡。上述对热打击神经胶质细胞氧化应激机制的深入研究为重症中暑神经系统损伤的临床救治提供了分子靶点。

