鲜蛹虫草与干蛹虫草抗氧化活性和活性物质差异研究*
刘晓红,宋 洁,栾宏伟,刘兴宝,李 娟,朱双杰,张 昕,贾成发,王淑君,王 鹏
(1.辽东学院农学院,辽宁 丹东 118003;2.丹东中科北和科技有限公司,辽宁 丹东 118003;3.滁州学院生物与食品工程学院,安徽 滁州 239012)
抗氧化剂在预防活性氧(reactive oxygen species,ROS) 引起的疾病中发挥着重要作用[1-2]。研究表明,ROS可引发机体退化或病理性事件,如癌症、哮喘和衰老的发生[3-5]。ROS过量是由于体内自由基产生和抗氧化防御体系之间的不平衡造成的,抗氧化剂在改善免疫功能、减少氧化应激方面发挥重要作用。虽然生物体内存在多种内源抗氧化剂,主要有酶和非酶的形式,但仍然需要不断地从饮食或补充剂中提取一定数量的外源抗氧化剂,以维持活性氧代谢的平衡,特别是在活性氧过度产生的情况下。研究表明,天然食材中获得的抗氧化剂可以降低机体退化或病理性事件发生的风险。
蛹虫草[Cordyceps militaris(L.ex Fr.)Link]为子囊菌门 (Ascomycota) 肉座目 (Hypocreales) 麦角菌科 (Clavicipitaceae) 虫草属 (Cordyceps) 的模式种[6]。近年来,由于蛹虫草具有多种药用价值,受到研究者越来越多的关注[7]。在中国和东南亚市场蛹虫草已作为药物原料和保健食品销售[8-9]。蛹虫草的药理功效包括免疫应答消炎、抗菌素、抗心律失常等[10-11]。现代药物化学研究表明,蛹虫草含有腺苷、虫草素、虫草酸、蛋白质、多糖、超氧化物歧化酶等活性成分[12-15],这些活性成分具有较强的抗氧化活性[16-19]。然而,以上研究均针对干蛹虫草,关于新鲜蛹虫草抗氧化性的研究甚少。
研究表明,热处理可以改变新鲜药材的化学组成、含量和活性物的结构[20-21],导致鲜中药材和干中药材从化学成分到药效都有很大的不同[22-23]。大量研究表明,鲜药材具有许多独特的临床疗效,在临床疾病、急危重症和创伤治疗方面具有明显优势[24-25]。迄今,鲜见有关鲜蛹虫草的研究,也未见关于鲜蛹虫草和干蛹虫草抗氧化活性差异的报道。因此,本研究拟对鲜蛹虫草和干蛹虫草的抗氧化活性进行评价,为蛹虫草资源的精深加工提供参考。
1 材料和方法
1.1 材料
样品:鲜蛹虫草(No.JS-003) 由辽东生物产业研究所提供;干蛹虫草:鲜蛹虫草放置于50℃烘干箱内烘干48 h,然后称重,7.5 g鲜品蛹虫草可以获得1.0 g干品蛹虫草。
样品处理:鲜蛹虫草37.5 g磨碎加入37 mL蒸馏水,干蛹虫草5.0 g加入50 mL蒸馏水混合,分别用高速匀浆器4 000 r·min-1匀浆10 min,匀浆液定容至100 mL,30℃超声提取30 min,4层纱布过滤,滤液经冷冻干燥,获得鲜蛹虫草和干蛹虫草样品,备用。
1.2 方法
1.2.1 DPPH自由基清除活力测定
利用Ozen.T等方法[26],测定DPPH自由基清除活力。鲜蛹虫草和干蛹虫草样品分别与DPPH甲醇溶液混合,室温、放置于暗室30 min,用分光光度计于517 nm处测定反应混合物的吸光度值。
1.2.2 铜离子还原能力的测定
采用Apak.R等方法[27],鲜蛹虫草和干蛹虫草样品分别与硫酸铜、新亚铜试剂和蒸馏水混合,室温放置30 min,用分光光度计于450 nm处测定混合物的吸光度值。
1.2.3 羟基自由基清除活力测定
根据Sroka.Z和Cisowski.W方法[28],略加修改,0.02 mol·L-1硫酸亚铁 100 μL,0.15%双氧水 45 μL,8 mmol·L-1水杨酸1 mL和蒸馏水4 mL按顺序依次混合,将1 mL鲜蛹虫草和干蛹虫草样品分别添加到上述混合液中,37℃放置30 min,用分光光度计于593 nm处测定有色产物的吸光度值。
1.2.4 总酚提取与含量测定
总酚提取:利用Brenes.M和Savarese.M等的方法[29-30],略加修改,鲜蛹虫草样品与甲醇/水(80∶20) 的溶液混合,室温放置30 min,用Whatman过滤器将混合液过滤,除去不溶性颗粒,重复提取3次,收集合并滤液,40℃下真空蒸发,除去滤液中的甲醇,加入正已烷洗涤滤液3次,去除油脂类物质,再加入乙酸乙酯萃取出酚类物质,40℃下真空蒸发,干燥后的残余物溶解在2 mL甲醇中,于4℃贮藏备用。
总酚测定:采用Folin-Ciocalteu法,略加改进,测定样品的总酚含量。分别取鲜蛹虫草和干蛹虫草样品0.1 mL与2.5 mL蒸馏水混合,加入0.25 mL Folin-Ciocalteu试剂,再加入2%Na2CO3溶液2.5 mL,暗环境下,室温放置120 min。用分光光度计于765 nm处测定反应混合物的吸光度值。
1.2.5 总黄酮提取和含量测定
总黄酮提取:利用Sun L.J.等的方法[31],略加修改。鲜蛹虫草样品浸泡在70%乙醇溶液中2.5 h,其中液料比 (w·v-)1为1∶10,55℃超声提取45 min,提取样品经0.45 μm微孔滤膜过滤。收集滤液,重复提取2次。石油醚和乙酸乙酯脱脂,旋转蒸发,真空浓缩干燥,获得样品粗提取物。
总黄酮含量测定:采用分光光度法测定黄酮类物质的含量。鲜蛹虫草和干蛹虫草样品各1 mL(4 mg·mL-1),分别加入100 μL浓度为1%的2-氨基乙基联苯基硼酸酯溶液混合,室温放置20 min。用分光光度计于404 nm处测定反应样品的吸光度值。
1.2.6 多糖提取和含量测定
鲜蛹虫草和干蛹虫草样品各25 g,250 mL乙醚索氏提取脱脂,加入250 mL80%乙醇混合24 h。过滤,收集滤液,用500 mL蒸馏水超声重提残留物2 h。然后合并滤液,蒸发浓缩至体积为100 mL,浓缩后的滤液与100 mL氯仿/异戊醇(4∶1) 混合进行脱蛋白处理。再过滤,滤液与4倍体积无水乙醇混合24 h,沉淀出的物质即为多糖化合物。离心收集沉淀,丙酮洗涤。最终鲜蛹虫草样品得到多糖1.44 g,干蛹虫草样品得到多糖1.06 g。
1.2.7 虫草素和腺苷含量的测定
采用高效液相色谱法[32],测定鲜蛹虫草和干蛹虫草样品中虫草素和腺苷含量。C18柱(Pinnaclell 5 μm,250 mm×4.6 mm),流动相中磷酸氢二钠缓冲液(pH6.0):甲醇为 85∶15,流速 1 mL·min-1,检测波长260 nm,加样量20 μL,用Waters Empower软件进行数据分析。
1.2.8 超氧化物歧化酶纯化和活性测定
超氧化物歧化酶纯化:参照Wang Z.S.等的方法[33],分别取50 g鲜蛹虫草和干蛹虫草冻干粉,加入 250 mL 20 mmol·L-1Tris-HCl缓冲液 (pH8.8)中,其中含有1 mmol·L-1苯甲基磺酰氟,均质离心(15 000 r·min-1)15 min。均质粗提液加硫酸铵饱和溶液中搅拌1.5 h,15 000 r·min-1离心15 min。取上清液,加到90%硫酸铵溶液中搅拌、离心,上清液溶入20 mmol·L-1Tris-HCL缓冲液 (pH8.8) 中,再用 20 mmol·L-1Tris-HCL缓冲液 (pH8.8) 透析 2次,过夜。透析所得蛋白在DEAE-FF阴离子交换层析柱(3 cm×12 cm) 上进行纯化,平衡液为 20 mmol·L-1Tris-HCL缓冲液(pH8.8),采用冷冻干燥法浓缩具有高超氧化物歧化酶活性的层析液。
超氧化物歧化酶活性测定:采用对邻苯三酚氧化法测定超氧化物歧化酶活性[34]。以牛血清白蛋白为标准蛋白,采用Braford法测定蛋白质[35]。
1.2.9 总抗氧化活性测定
采用Trolox等效抗氧化活性(trolox equivalent and oxidant capacity,TEAC) 方法[36],测定样品总抗氧化活性,2,2’-联氮-二 (3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)(100 μmol·L-1),双氧水(50 μmol·L-1)和过氧化物酶(4.4 U·mL-1)混合产生ABTS·+,1 mL ABTS·+分别加入到鲜蛹虫草和干蛹虫草样品和奎诺二甲基丙烯酸酯(Trolox) 标准品中,室温放置10 min,分光光度计于734 nm处测定吸光度值,根据标准曲线,估算TEAC值。
2 结果分析
2.1 鲜蛹虫草和干蛹虫草对DPPH自由基清除能力
以生育酚作为对照,研究鲜蛹虫草和干蛹虫草样品对DPPH自由基清除能力的影响,结果见图1。

图1 鲜蛹虫草和干蛹虫草对DPPH自由基的清除能力Fig.1 Scavenging activity of fresh Cordyceps militaris and dry Cordyceps militaris on DPPH radical
由图1可知,鲜蛹虫草和干蛹虫草样品浓度在0~4.0 mg·mL-1时,随着浓度的升高,对DPPH自由基清除能力不断增强,当样品浓度为4.0 mg·mL-1时,鲜蛹虫草样品DPPH自由基的清除能力增强到86.63%,干蛹虫草样品达到61.36%。显然鲜蛹虫草样品对DPPH自由基清除能力明显强于干蛹虫草样品。样品浓度在 4.0 mg·mL-1~8.0 mg·mL-1时,鲜蛹虫草样品清除能力超过85%,高于相同浓度下生育酚对照样品的清除能力。
2.2 鲜蛹虫草和干蛹虫草对铜离子还原的抑制作用
以生育酚作为对照,研究鲜蛹虫草和干蛹虫草样品对铜离子还原的抑制作用,结果见图2。

图2 鲜蛹虫草和干蛹虫草对铜离子还原的抑制作用Fig.2 Inhibition effect of fresh Cordyceps militaris and dryCordyceps militaris on copper ion reduction
由图2可以看出,鲜蛹虫草和干蛹虫草样品浓度在0~4.0 mg·mL-1时,对铜离子还原的抑制作用具有浓度依赖性。在 1.0 mg·mL-1~8.0 mg·mL-1浓度范围内,鲜蛹虫草对铜离子还原的抑制作用明显强于干蛹虫草。浓度在 0.01 mg·mL-1~1.0 mg·mL-1时,鲜蛹虫草样品对铜离子还原的抑制作用弱于对照生育酚。鲜蛹虫草浓度处于 2.0 mg·mL-1~8.0 mg·mL-1高浓度时,对铜离子还原的抑制作用强于对照生育酚。
2.3 鲜蛹虫草和干蛹虫草对羟基自由基的清除能力
以生育酚作为对照,研究鲜蛹虫草和干蛹虫草样品对羟基自由基的清除能力,结果见图3。

图3 鲜蛹虫草和干蛹虫草对羟基自由基的清除能力Fig.3 Scavenging activity of fresh Cordyceps militaris and dry Cordyceps militaris on hydroxyl radical.
由图3可知,鲜蛹虫草和干蛹虫草样品对羟基自由基均具有较强的清除能力,样品浓度在0~8.0 mg·mL-1范围内,两者对羟基自由基清除能力具有浓度依赖性,但鲜蛹虫草样品对羟基自由基清除能力显著高于干蛹虫草样品(P<0.05)。当样品浓度为2 mg·mL-1时,只有鲜蛹虫草清除能力高于对照生育酚,在 4.0 mg·mL-1~8.0 mg·mL-1时,鲜蛹虫草和干蛹虫草样品清除能力均明显强于对照生育酚。综上所述,鲜蛹虫草清除能力强于干蛹虫草。
2.4 鲜蛹虫草和干蛹虫草主要活性成分含量和抗氧化活性比较
鲜蛹虫草和干蛹虫草主要活性成分含量见表1。
由表1可知,鲜蛹虫草和干蛹虫草样品在多糖、总酚、总黄酮含量方面均存在显著性差异(P<0.01),这三种活性成分在鲜蛹虫草样品中的含量均高于干蛹虫草样品,并且鲜蛹虫草和干蛹虫草样品中活性成分含量排序为,总黄酮含量>总酚含量>多糖含量,腺苷和虫草素含量无明显差异。

表1 鲜蛹虫草和干蛹虫草主要活性成分含量及其抗氧化活性比较Tab.1 Compare of the main active components content and antioxidant activity of fresh Cordyceps militaris and dry Cordyceps militaris
由表1还可以看出,干蛹虫草样品抗氧化活性显著低于鲜蛹虫草样品(P<0.01)。超氧化物歧化酶纯化过程有3个阶段,获得的3种提取液分别为粗提液、硫酸铵沉淀物和阴离子交换层析液,检测3种提取液中总蛋白含量和超氧化物歧化酶的活性结果,见表2。

表2 鲜蛹虫草和干蛹虫草中超氧化物歧化酶含量及活性比较Tab.2 Compare of the superoxide dismutase content and activity of fresh Cordyceps militaris and dry Cordyceps militaris
由表2可以看出,鲜蛹虫草中超氧化物歧化酶的含量与总活力均高于干蛹虫草,且超氧化物歧化酶纯化提取物中,鲜蛹虫草所得粗提液和硫酸铵沉淀物比活度是干蛹虫草的1.3倍(P<0.01),鲜蛹虫草中阴离子交换层析液比活度是干蛹虫草的1.8倍。
2.5 鲜蛹虫草中主要活性成分抗氧化活性
鲜蛹虫草中超氧化物歧化酶、多糖、总酚和总黄酮的抗氧化活性,见图4。

图4 鲜蛹虫草中超氧化物歧化酶、多糖、总酚和总黄酮的抗氧化活性Fig.4 Total antioxidant activity of the superoxide dismutase,polysaccharide,polyphenol and total flavonoids of fresh Cordyceps militaris
由图4可知,样品浓度在0~8.0 mg·mL-1之间,蛹虫草的超氧化物歧化酶、多糖、总酚和总黄酮的抗氧化活性随着浓度的升高而增大,这说明鲜蛹虫草中的超氧化物歧化酶、多糖、总酚和总黄铜具有较强的抗氧化活性。鲜蛹虫草中腺苷和虫草素总抗氧化性活性见表3。
由表3可以看出,根据不同浓度组合,分别测定鲜蛹虫草中多糖和腺苷组合、多糖和虫草素组合后的TEAC值,所得结果与鲜蛹虫草多糖抗氧化活性TEAC值相比无显著差异。鲜蛹虫草样品中多糖和腺苷组合、多糖和虫草素组合的清除能力与鲜蛹虫草样品多糖几乎一样,表明腺苷和虫草素这两种生物活性成分不能促进蛹虫草的抗氧化活性。
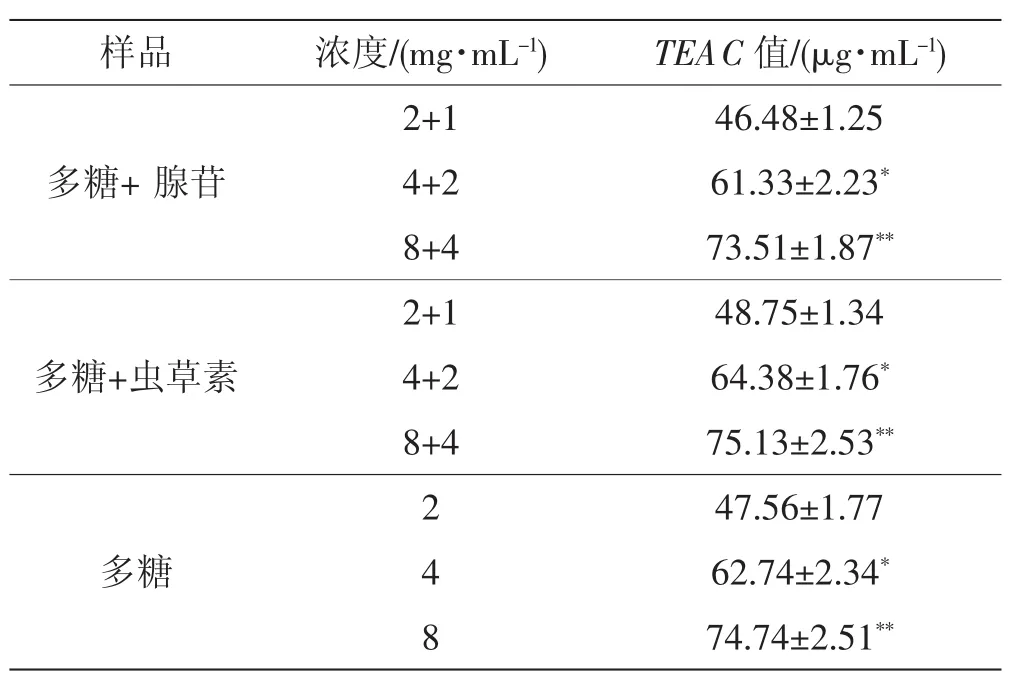
表3 鲜蛹虫草中腺苷和虫草素总抗氧化性活性Tab.3 Total antioxidant activity of adenosine,cordycepin of fresh Cordyceps militaris
3 讨论
生物系统中抗氧化系统很复杂[37],采用不同方法分析抗氧化活性可得不同的反应特性和机理,在实际研究中,至少使用2种互补的方法来评价体外抗氧化能力[38]。DPPH自由基是稳定的自由基,DPPH自由基清除能力检测法是1种评价抗氧化活性的快速方法[39]。铜离子对机体内的硫醇类抗氧化剂如谷胱甘肽具有反应性[40],由于体内广泛存在羟基自由基[38,41],故羟基自由基清除能力的检测被广泛用于抗氧化活性的测定。此外,在测定特定物质的抗氧化能力时,Trolox等效抗氧化活性检测也被常用于评价活性物质的抗氧化能力。因此我们选择了这四种方法来评价鲜蛹虫草和干蛹虫草的抗氧化能力。结果表明,4种方法均能较准确地反映鲜蛹虫草和干蛹虫草抗氧化活性。
目前,在中国、韩国和东南亚地区,蛹虫草被作为医药材料和保健食品出售[9]。研究表明,蛹虫草具有显著的治疗效果,如免疫刺激[17]。已有研究表明,蛹虫草提取物能提高小鼠血清中超氧化物歧化酶、谷胱甘肽过氧化物酶、过氧化氢酶的酶活性,降低H22型小鼠肝脏中超氧化物歧化酶和谷胱甘肽过氧化物酶的含量。近年来,大量试验数据表明,蛹虫草子实体水提取物对寄主具有抗氧化活性[42]。蛹虫草子实体水提液显示了对DPPH、羟基自由基明显的清除能力和对亚铁离子的螯合作用,对亚油酸脂质过氧化和还原能力也有抑制作用[16]。本研究显示,干蛹虫草具有较强的DPPH自由基清除能力、铜离子还原能力和羟基自由基清除能力,且均呈剂量依赖性,但其抗氧化活性显著低于鲜蛹虫草,且鲜蛹虫草浓度在 4.0 mg·mL-1~8.0 mg·mL-1时,抗氧化活性明显高于生育酚。所以鲜蛹虫草是1种天然的抗氧化剂资源。
抗氧化能力与活性成分的含量有关。蛹虫草的主要成分为超氧化物歧化酶、虫草素、腺苷和虫草多糖[13]。这些主要成分中,除了蛹虫草多糖外,其他活性成分的抗氧化活性仅有少量报道[18]。另外,已有报道表明总酚和总黄酮具有良好的抗氧化能力。为进一步探讨活性成分在鲜蛹虫草和干蛹虫草抗氧化活性中的作用,本研究测定了鲜蛹虫草和干蛹虫草中主要活性成分,包括超氧化物歧化酶、多糖、腺苷、虫草素、总酚和总黄酮含量。本研究显示,除活性成分腺苷和虫草素外,鲜蛹虫草中其他活性成分均明显高于干蛹虫草,导致这种结果可能有2个因素,一是热处理使部分活性成分裂解,另一个是由于酶的作用使热敏成分分解[20]。
此外,为阐明蛹虫草主要活性成分对抗氧化活性的影响,本试验从蛹虫草中分别提取出多糖、超氧化物歧化酶、总酚和总黄酮,并采用了Trolox等效抗氧化活性检测法评价了其抗氧化活性。Trolox等效抗氧化活性综合分析方法优于多个测定分析的方法,能有效评价样品的抗氧化能力。由于虫草多糖已被证明具有显著的抗氧化活性,本研究以蛹虫草多糖为对照。数据统计分析显示,腺苷和虫草素不能促进蛹虫草抗氧化活性。此结果与Yu和Yang[17]结论相一致。关于鲜蛹虫草和干蛹虫草超氧化物歧化酶抗氧化活性鲜有报道,本研究结果显示,鲜蛹虫草超氧化物歧化酶抗氧化活性显著高于干蛹虫草。此外,鲜蛹虫草提取物中总酚和总黄酮含量分别为(87.56±0.04) mg·g-1和 (182.24±0.07) mg·g-1,干蛹虫草为 (58.34±0.03) mg·g-1和(125.86±0.03)mg·g-1,均表现出明显的抗氧化活性,这与已报道结论不一致,先前有研究显示蛹虫草中总酚和总黄酮的含量分别为 0.598 μg·mL-1和 60.2 μg·mL-1,这种相对含量较低的活性物质对蛹虫草的抗氧化活性贡献率是很低的[17]。
综上所述,本研究表明,鲜蛹虫草和干蛹虫草均具有抗氧化活性,而且鲜蛹虫草的抗氧化活性优于干蛹虫草。此外,鲜蛹虫草中多糖、超氧化物歧化酶、总酚和总黄酮等活性成分的含量均高于其在干蛹虫草中的含量。鲜蛹虫草所含的多糖、超氧化物歧化酶、总酚和总黄酮等成分具有显著的抗氧化活性。这些结果表明,鲜蛹虫草是良好的抗氧化剂资源,有待进一步开发利用。

