CS-5100全自动血凝仪检测抗凝血酶Ⅲ、蛋白C、蛋白S活性的性能验证
李 雯,何爱丽, 张 雯,周 挺
(西安交通大学第二附属医院检验科,陕西 西安 710004)
抗凝血酶Ⅲ(antithrombin Ⅲ,ATⅢ)是人体内主要的生理性血浆抗凝物质,主要由肝脏合成。血液中抗凝血酶与凝血酶结合形成凝血酶—抗凝血酶复合物[1],从而灭活凝血酶,起到控制血液凝固的作用。蛋白C(protein C,Pc)系统在凝血酶产生的同时被激活,灭活FVa和FⅧa,阻断凝血过程;蛋白S(protein S,Ps)是一种维生素K依赖性酶原,可协同活化Pc,抑制血液凝固。因此,检测ATⅢ、Pc和Ps活性状态对血栓性疾病、心肌梗死、脑血管疾病、弥散性血管内凝血、肝脏疾病、肾病综合征、外科手术以及抗凝药物的检测都具有重要意义。本研究根据美国临床实验室标准化协会(the Clinical and Laboratory Standards Institute,CLSI)系列指南文件对CS-5100全自动血凝仪(简称CS-5100)及配套试剂检测ATⅢ、Pc和Ps活性进行性能验证。
1 材料和方法
1.1 研究对象
随机选取在西安市交通大学第二附属医院就诊的患者及体检健康者,参照 CLSI H21-A5文件[2]的要求,用0.109 mmol /L 柠檬酸钠抗凝管采集患者静脉血2 mL,1 500×g离心10 min,分离出乏血小板血浆,要求标本无溶血、凝固、乳糜现象,血细胞比容<55%。
1.2 仪器与试剂
CS-5100(日本Sysmex公司)及配套试剂。正常水平定值质控品批号为507722,异常水平定值质控品批号为509986,ATⅢ试剂批号为 45762,Pc试剂批号为 45888,Ps试剂批号为45769。
1.3 性能验证方法
1.3.1 不精密度[以变异系数(coefficient of variation,CV)表示]验证 (1)批内不精密度:参照CLSI EP15-A2文件要求[3],取2个水平的混合血浆,按照常规方法连续测定20次ATⅢ、Pc和Ps,计算各项目的x 、s和CV。(2)日间不精密度:取2个水平的混合血浆,各分装成5份标本,保存于-70 ℃,每天测定4次,分2批测定,每批间隔时间2 h,连续测定5 d,记录每次 ATⅢ、Pc和Ps的测定结果,计算CV。按照厂家标准,要求ATⅢ活性批内不精密度 <1.3%,日间不精密度<2.7%,Pc活性批内不精密度 <0.4%,日间不精密度<1.9%,Ps活性批内不精密度<1.9%,日间不精密度<4.1%。
1.3.2 准确度验证 参照厂家提供的定值质控品使用说明书,使用1.0 mL的注射用水将正常和异常2个水平的定值质控品进行复溶,混匀,室温(25±2)℃稳定20~30 min后进行检测。同时参照CLSI EP15-A2文件要求[3],重复测定ATⅢ、Pc和Ps2个水平的定值质控品各3次,将测定值与靶值进行比较,计算相对偏移,相对偏移=(靶值-测定值)/靶值×100%。查阅Westgard生物学CV要求,ATⅢ活性偏移±4%,Pc活性偏移±13.9%,Ps活性偏移±15.9%。
1.3.3 线性验证 参照CLSI EP6-A文件[4],选取高、低2个水平的混合血浆,将低水平和高水平标本分别按4∶0、3∶1、2∶2、1∶3、0∶4的比例混合,得到5份线性试验标本,每个稀释度重复测定3次,计算x。 将5对实测值与理论值作直线回归,得到回归方程Y=aX+b和r2值。回归方程斜率在(1±0.05)范围内、r2≥0.95判定为合格。
1.3.4 参考区间验证 厂家试剂说明书提供的参考区间分别为ATⅢ79.4%~112.0%、Pc 70.0%~140%、Ps 60.0%~130.0%。参照CLSI C28-A2文件[5],收集20名体检健康者血浆,排除伴有血液系统疾病、心脑血管疾病、肝脏疾病、肺栓塞、服用抗凝药物者,测定标本并计算R值(R=结果落在参考区间内的样本数/总样本数),以R≥0.9为验证通过。
1.3.5 携带污染验证 参照CLSI H57-A文件[6],高值标本污染:将低值标本(N)置于1和3 位置,高值标本(A)置于2位置,每个标本测3次,记录结果,分别标注为N1、N2、N3、A1、A2、A3 、N4、N5、N6。携带污染率=[N4-x(N1,N2,N3)] /x (N1,N2 ,N3)。尚未查到对3种抗凝蛋白活性检测携带污染率有要求的指南性文件,仅有相关血凝仪性能验证文献[7-8]报道各项目CV<10%。因此以携带污染率<10%为符合要求。
1.4 统计学方法
采用 Excel 2003软件进行数据统计分析。
2 结果
2.1 精密度验证
ATⅢ、Pc和Ps批内不精密度和日间不精密度验证结果均符合试剂说明书要求。见表1。
2.2 准确度验证
ATⅢ、Pc和Ps各项目检测结果均落在质控品标示的允许范围内,偏移符合Westgard生物学CV要求。见表2。
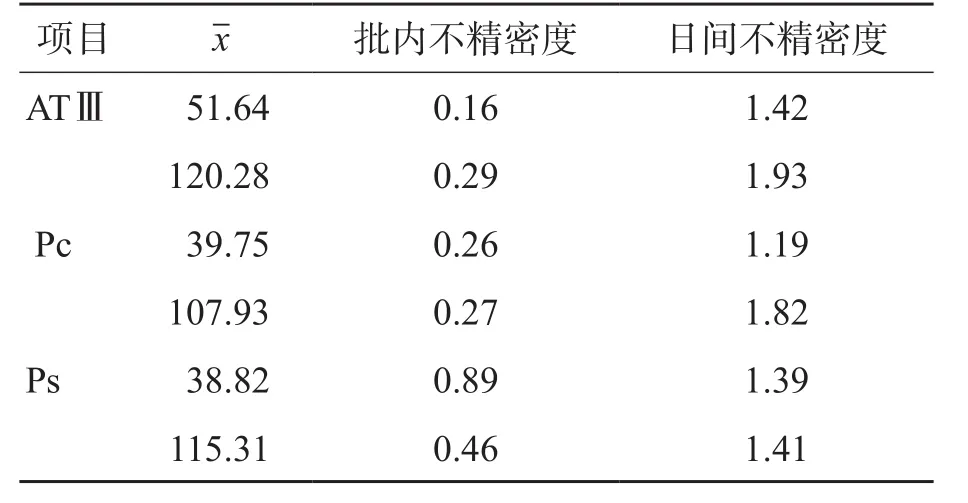
表1 批内及日间不精密度验证 (%)
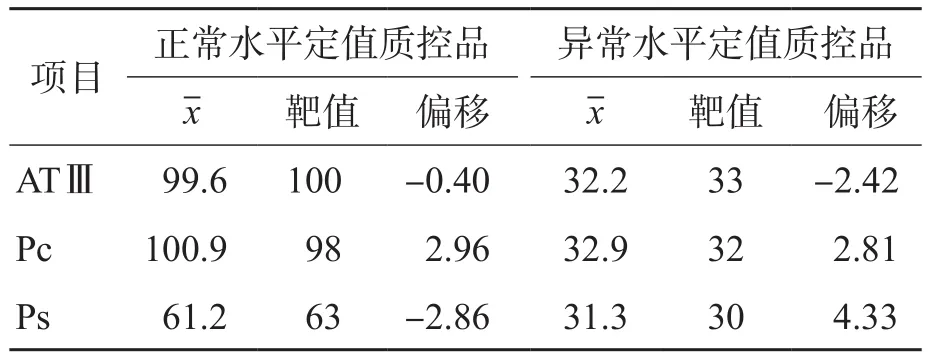
表2 准确度验证 (%)
2.3 线性验证
ATⅢ线性验证试验理论值和实测值的回归方程为Y=0.980 1X-0.259,r2=0.999 7。Pc线性验证试验理论值和实测值的回归方程为Y=0.970 4X+0.986,r2=0.996 7。Ps线性验证试验理论值和实测值的回归方程为Y=0.982 2X+2.789 4,r2=0.994 5。均符合线性回归方程的斜率在(1±0.05)范围内以及r2≥0.95的要求。见图1~图3。
2.4 参考区间验证
20名体检健康者ATⅢ、Pc、Ps的检测结果均在厂家试剂说明书提供的参考区间内,验证通过。见表3。
2.5 携带污染试验
ATⅢ高值对低值的污染所引起的相对偏差为0.71%,Pc高值对低值的污染所引起的相对偏差为-0.63%,Ps高值对低值的污染所引起的相对偏差为1.11%,携带污染率可接受。见表4。

图1 ATⅢ的线性验证
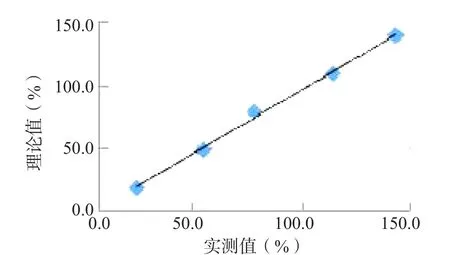
图2 PcⅢ的线性验证

图3 Ps的线性验证
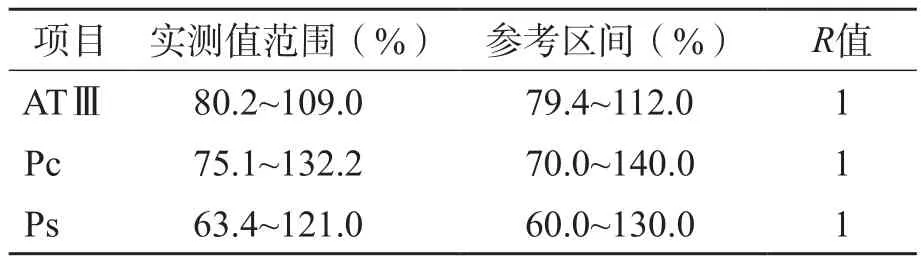
表3 参考区间验证 (%)

表4 高值样本对低值样本的携带污染率 (%)
3 讨论
血栓形成是导致心、脑和外周血管事件的最后关键环节,是致死或致残的直接原因。血栓性疾病几乎涵盖所有临床科室,其发病率高居各种疾病之首。在血栓性疾病中,静脉血栓的发生率比动脉血栓高4倍,但只有11%~15%的患者在生前被明确诊断。大多数静脉血栓没有症状,易被漏诊、误诊。 ATⅢ、Pc和Ps活性检测的开展对于血栓性疾病,尤其对于易栓症的临床筛查具有重要意义。易栓症并不一定指疾病,可以是生理或病理状态,是指存在抗凝蛋白、凝血因子、纤溶蛋白等遗传性或获得性缺陷,或者存在获得性危险因素而具有高血栓栓塞倾向[9]。易栓症的血栓栓塞类型主要为静脉血栓栓塞症(venous thromboembolism,VTE)。在我国,最常见的易栓症类型是遗传性易栓症。有研究对672例VTE患者的相关危险因素进行了分析,其中有94例VTE患者检测了抗凝蛋白,Pc缺乏占13.85%、Ps缺乏占5.3%、AT缺乏占5.3%,合计占24.4%[10]。因此,ATⅢ、Pc和Ps的活性检测对易栓症筛查具有重要意义。而国内大多数医院对易栓症的筛查还停留在常规凝血4项和空腹同型半胱氨酸以及抗磷脂抗体的检测上,仅有部分医院开展ATⅢ、Pc和Ps的活性以及凝血因子的检测。
本研究参考CLSI系列指南文件对CS-5100及配套试剂检测ATⅢ、Pc和Ps活性的性能进行了验证。结果显示ATⅢ、Pc和Ps的批内不精密度和日间不精密度均符合厂家要求,检测重复性良好。准确度为一种定性的概念,有报道[11]指出准确度验证的定值参考物来源主要有以下4种:(1)可溯源至美国病理学家协会及美国国家标准和技术研究院的定值新鲜冰冻人血清;(2)实验室室间质评物;(3)从能力比对实验中获得的参考物;(4)厂家提供的正确度确认物或质控物。本研究采用第4种,重复测定3次,计算偏移。在线性评价验证中,本研究参照CLSI EP6-A指南[4],采用多项式回归作为分析线性的评价方法,结果表明ATⅢ、Pc和Ps实测值和理论值之间具有良好的线性关系。参考区间验证结果显示,20名体检健康者的ATⅢ、Pc和Ps的检测结果均在厂家说明书提供的参考区间内,参考区间验证通过。但应注意的是,接受实验室的操作必须和原始参考值研究的分析前和分析中各因素尽量保持一致,否则参考区间转移毫无意义。携带污染率是指样本检测间以及试剂间引起携带污染的概率,本研究仅验证了主要样本间的携带污染率。结果显示ATⅢ、Pc和Ps的携带污染率分别为0.71%、-0.63%和1.11%。
CS5100性能验证报道很多,但对ATⅢ、Pc和Ps性能验证较少。目前尚未查到国内外在ATⅢ、Pc和Ps活性检测性能验证和质量控制方面的指南性文件。因此,期望相关指南文件不断完善,使各级实验室抗凝蛋白活性性能验证能规范化开展,为临床提供可靠的检测结果。

