CYP2C19基因多态性对冠心病患者药物治疗的临床意义
张少红, 沈雪彬
(1.福建医科大学附属南平市第一医院检验科,福建 南平 353000;2.福建医科大学附属南平市第一医院心内科,福建 南平 353000)
流行病学研究显示,冠心病(coronary heart disease,CHD)是目前人类死亡和病残的主要疾病之一[1-2],其发病率呈上升趋势。经皮冠状动脉介入术(percutaneous coronary intervention,PCI)是治疗CHD尤其是急性冠状动脉综合征,改善患者症状和预后的重要方法。支架植入后为预防支架内血栓形成及再狭窄,相关指南推荐使用双联(阿司匹林和氯吡格雷或替格瑞洛)抗血小板(platelet,PLT)聚集药物1年。通过基因型检测结果进一步选择抗PLT药物类型及剂量可以有效降低患者不良心血管事件(major adverse cardiovascular event,MACE)的发生率[3]。氯吡格雷是一种前体药物,其本身无抗PLT聚集活性,需经细胞色素P450(cytochrome P450,CYP450)酶系统尤其是CYP2C12酶代谢后的中间产物发挥抗PLT聚集活性,进一步起到预防血栓的作用[4]。
CYP2C19是CYP450家族中的重要药物代谢酶,氯吡格雷主要通过其代谢产生活性。有研究显示人群中CYP2C19酶系统对药物代谢能力可分为快代谢型、中间代谢型以及慢代谢型,而影响药物慢代谢主要是由CYP2C19*2和CYP2C19*3 2个位点基因缺陷所致。对白色人种的研究显示,氯吡格雷的代谢通路等位基因的功能缺陷与氯吡格雷抵抗及不良临床预后相关[5]。而我国不同民族人群CHD患者服用抗PLT聚集药物后对PLT聚集功能的影响及其临床预后相关性尚不明确。本研究拟通过检测CHD患者CYP2C19*2和CYP2C19*3位点的突变频率,同时根据基因型检测结果选择不同抗PLT聚集药物或剂量,观察其对临床预后尤其是PCI术后MACE的影响,为CHD患者抗PLT聚集药物的个体化选择提供理论支持。
1 材料和方法
1.1 研究对象
选取2014年1 月—2016年1月在福建医科大学附属南平市第一医院心内科诊断为CHD并行冠状动脉造影明确CHD、行PCI并同意配合跟踪随访的患者526例,其中男348例、女178例,有6例患者失访,最终纳入本研究的对象共520例。均行CYP2C19基因型检测,依据第636号及第681号碱基对等位基因功能缺失(loss-offunction,LOF)的不同,分为快代谢基因型(野生型):*1/*1(681GG/636GG);中间代谢基因型(突变杂合型):*1/*2(636GG/681GA)、*1/*3(636GA/681GG);慢代谢基因型(突变纯合型):*2/*2(636GG/681AA)、*2/*3(636GA/681GA)、*3/*3(636AA/681GG)。所有患者按病变情况需要置入药物洗脱支架(drugeluting stent,DES),且术后根据基因型结合患者冠状动脉病变情况分为快代谢型、中间代谢型及慢代谢型3个组。快代谢型组服用标准剂量,即口服阿司匹林(100 mg)及氯吡格雷(75 mg)1年;中间代谢型组服用氯吡格雷双倍剂量,根据患者基因型结合患者病变情况选择口服阿司匹林(100 mg,1次/d)和氯吡格雷(150 mg,1次/d);慢代谢型组患者口服阿司匹林(100 mg,1次/d)和替格瑞洛(90 mg,2次/d)。对各组基因型的分布进行比较,并于术后1、6和12个月随访,记录3个组间MACE的发生情况。
1.2 仪器与试剂
基因组提取试剂盒和CYP2C19 基因检测试剂盒、全自动杂交仪和生物芯片阅读仪均购自上海百傲科技有限公司。 PCR 扩增仪购自杭州博日公司。
1.3 方法
选择确诊为CHD并行PCI,且术后能够配合随访及规范药物治疗的患者。
排除以下患者:对阿司匹林或氯吡格雷过敏或不能耐受;具有抗PLT治疗禁忌证;半年内有脑卒中或内脏出血性疾病史;严重肝脏疾患和(或)凝血功能异常;近期拟行外科手术;患有心脏瓣膜病、心肌病、心肌炎、先天性心脏病、周围血管病、感染性心内膜炎;晚期肾功能不全、肿瘤及慢性心力衰竭等严重影响近期预后的疾病。全部研究对象在试验前均签署知情同意书。
在介入途径静脉采血5 mL,以常规酚氯仿法抽提白细胞基因组DNA后,在-20℃冰箱储存备用。采用CYP2C19基因芯片检测系统检测目的基因和位点突变情况,检测流程包括:全血 DNA 提取、目的基因聚合酶链反应(polymerase chain reaction,PCR)扩增、基因芯片杂交显色、基因芯片扫描与数据分析。质量控制:PCR扩增时设置阳性对照和阴性对照,反应后可将扩增产物用琼脂糖凝胶电泳检测,阴性对照应检测不出DNA,阳性对照及样本应检测出较明显的DNA条带,而且在以后的杂交实验中检测该阳性对照为CYP2C19*1/*3基因型,以上所有步骤严格按照仪器和试剂盒标准操作规程,并且使用荧光原位杂交法和PCR芯片法进行对比验证,确保实验结果的准确性。根据不同基因型编码的酶对氯吡格雷的不同药物代谢动力学特征将野生基因型归为快代谢型,将突变杂合基因型归为中间代谢型,将突变纯合基因型归为慢代谢型。
术后通过再入院记录、门诊及电话随访,了解术后1年MACE的发生情况。MACE包括心绞痛复发、紧急血运重建术、急性心肌梗死、支架内血栓形成、心原性死亡和包括上述事件的联合终点事件。紧急血运重建术指随访期间患者再次发病,从发病到进行经皮冠状动脉腔内成形术或支架置入术,并恢复前向心肌梗死溶栓试验3级血流的时间在12 h之内。
1.4 统计学方法
2 结果
2.1 CYP2C19的基因型、基因频率和代谢表型
CYP2C19基因型分布中,快代谢型224例(43.08%);中间代谢型227例(43.65%),其中*1/*2 41例、*1/*3 186例;慢代谢型共69例(13.27%),其中双突变基因16例,占3.08%。CYP2C19*1型332例(63.84%),CYP2C19*2型161例(30.96%),CYP2C19*3型27例(5.20%)。见表1。

表1 CYP2C19基因型分布比例
2.2 3个组患者随访1年的MACE发生率
3个组随访1年,中间代谢型组、慢代谢型组总MACE发生率均低于快代谢型组(P<0.05)。进一步分析单一MACE,3个组仅不稳定型心绞痛发生率差异有统计学意义(P=0.04),其他单一MACE的发生率差异均无统计学意义(P>0.05)。见表2。
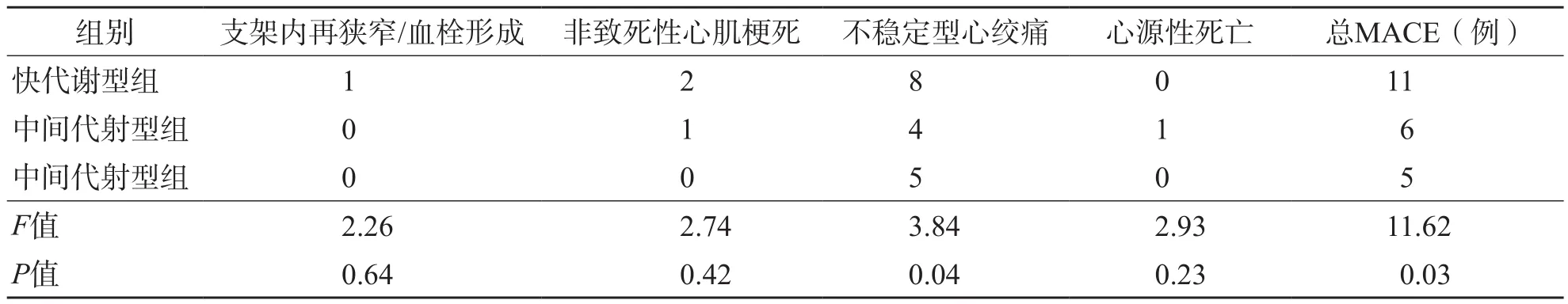
表2 单一MACE的发生情况
3 讨论
近年来,我国行PCI术的CHD患者数量呈直线上升趋势,术后各种MACE越来越受到关注,尤其是术后急性支架内血栓形成,往往会造成致命性的后果。部分支架内血栓形成可能与氯吡格雷在不同个体间反应变异性有关,而氯吡格雷个体差异与其基因多态性相关。故本研究统计了闽北地区近2年行PCI术并检测CYP2C19基因的CHD患者,结果显示CYP2C19纯合子快代谢型组共224例,占43.08%;中间代谢型组共227例,占43.65%,其中以第681号碱基功能位点突变为主,占中间代谢型组的82%;慢代谢型组共69例,占13.27%;明显高于亚洲总体人群[CYP2C109的功能缺失(loss of function,LOF)性等位基因频率约为30%][6],但与徐韫健等[7]的研究结果基本相符,其研究结果为汉族人群快代谢型占42.3%,中间代谢型占45.1%,慢代谢型占12.3%。
CHD尤其是急性冠状动脉综合征严重威胁人类的健康,通过PCI解除冠状动脉严重狭窄,进一步重建心肌血运,恢复心肌的有效灌注,可以明显改善患者的症状及远期预后,是目前治疗急性冠状动脉综合征,尤其是严重冠状动脉病变的主要方法[8]。合理应用抗PLT药物的种类和剂量能够降低围术期及术后MACE的发生率,从而改善患者的远期预后。2017年欧洲心脏病学会(European Socity of Cardiology,ESC)指南建议:因急性冠状动脉综合征植入冠状动脉支架,或因非急性冠状动脉综合征植入药物涂层支架的患者,应当在长期服用阿司匹林的基础上,联合使用氯吡格雷至少12个月甚至更长时间。然而尽管规范使用双联抗PLT聚集药物治疗,仍有一部分患者出现急性、亚急性血栓事件及支架内再狭窄。有研究结果显示,规范双联抗PLT药物治疗半年内支架内血栓形成的发生率仍有2.49%,且一旦发生其死亡率可高达25%[9]。目前已证实携带CYP2C19基因或功能丧失性等位基因的患者与氯吡格雷疗效减弱及更高的缺血性事件发生率有关[10]。故本研究对闽北地区PCI术后的CHD患者行CYP2C19基因检测,并根据其基因型不同调整抗PLT聚集药物的种类和剂量。
有荟萃分析显示,CYP2C19功能缺失基因患者发生支架内血栓的风险明显增加,采用同样的氢氯吡格雷治疗,此类患者支架内血栓形成概率增高2~3倍,其MACE也明显增加[11]。目前已有研究结果显示,在PCI术后用氯吡格雷治疗的患者中,携带CYP2C19*2功能缺失等位基因的患者发生MACE是非携带者的3倍[12],特别是支架内血栓形成的风险增加;而携带功能缺失等位基因的患者比非携带者发生MACE的概率高53%[13]。基于此研究结论,本研究对于CYP2C19中间代谢型患者术后根据患者意愿增加氯吡格雷的剂量或改用替格瑞洛,而对于慢代谢型患者术后直接改用替格瑞洛治疗,其MACE的发生率明显低于上述研究中的发生率。故对接受PCI的患者行CYP2C19基因型检测,并根据基因型检测结果调整抗PLT聚集药物治疗可以明显提高疗效。

