不同酿酒酵母PDEs缺失突变株对磨盘柿果酒抗氧化及挥发性物质的影响
马 琳,姚 婷,任向峰,谈太聪,张亮然,王友升,*
(1.北京食品营养与人类健康高精尖创新中心,北京工商大学,北京 100048;2.山东大学 微生物技术国家重点实验室,山东 青岛 266237)
柿(Diospyros kaki)属柿树科落叶乔木,适应性强,是我国各地广泛栽培的一种果树,也是我国原产著名浆果,华北为主要产区[1]。研究表明,柿子不仅营养丰富,而且具有抗动脉硬化、预防心血管疾病、抗肿瘤、抗老化等作用[2]。但目前柿子加工利用率低,加工种类少,柿果在储藏以及运输过程中极易软化[3],又因存在褐变这一难题,造成柿子价值无法真正被利用[4]。柿子果酒的加工不仅解决了柿子储藏的问题,而且具有很高的保健价值和营养价值[5]。而酿酒酵母是影响果酒品质的关键因素,也是影响果酒口感和风味的重要因素,筛选适合酿造柿子果酒的优良菌株尤为重要。曹卫华[6]研究了固定化酵母发酵柿子果酒的营养成分,结果显示柿子果酒中含有大量的氨基酸、维生素、矿物质等。但对于酿酒酵母特性影响柿子果酒品质鲜见报道。
影响酿酒酵母发酵能力的生物学特性包括对糖的利用能力以及对酸、渗透压、SO2和乙醇的耐受力[7]。这些特性的调控机制主要通过环磷酸腺苷(cyclic adenosine monophosphate,cAMP)和环磷酸鸟苷(cyclic guanosine monophosphate,cGMP)信号通路产生影响[8],cAMP和cGMP是具有在细胞内进行信息传递作用的第2信使,能够将胞外信号传导至细胞核。环核苷酸磷酸二酯酶(cyclic nucleotide phosphodiesterase,PDEs)是cAMP和cGMP信号通路的关键酶,具有水解细胞内第2信使cAMP或cGMP的功能,从而终止第2信使所传导的生化作用[9]。PDEs超家族可分I型和II型两大类[10],酵母中含有两种PDE(PDE1和PDE2),这两种PDE在细胞内的定位及功能有显著差别[11-12]。PDE1属于II型超家族,在对cAMP/cGMP信号通路调控酿酒酵母生活力的研究中,PDE1具有cAMP和cGMP的双底物催化活性且对两种底物的催化活性差别不大。PDE2属于I型超家族,PDE2基因的过量表达可提高酵母对氧化胁迫和乙醇的耐受性[13-14]。PDE1和PDE2都可水解cAMP,PDE2对cAMP的亲和力(Km=0.17~1 μmol/L)[15-16]远高于PDE1(Km=100~150 μmol/L)[17-18]。胡芸[12]研究了酿酒酵母高亲和力cAMP磷酸二酯酶PDE2蛋白的胞内定位及表达调节,结果表明蛋白激酶A(protein kinase A,PKA)对PDE2的定位和蛋白水平有重要的调节作用;Ma Pingsheng等[19]研究发现PDE1在控制葡萄糖和细胞内酸化诱导的cAMP信号传导中有特定作用,通过将丝氨酸252诱变为丙氨酸消除推定的PKA磷酸化位点导致PDE1(Ala252)等位基因显然具有降低的体内活性。但国内外鲜见有关PDEs基因缺失菌株对柿子果酒发酵产生影响的报道。
本研究利用野生型酿酒酵母以及PDEs基因缺失菌株对磨盘柿进行发酵酿酒,通过比较发酵期间磨盘柿果酒的理化指标、抗氧化能力、活性物质及挥发性物质的变化,比较PDE1和PDE2基因缺失菌株与野生型酿酒酵母发酵特性的差异,比较不同突变体之间发酵特性的差异,从而判定PDE1和PDE2基因对磨盘柿果酒发酵的影响,为筛选优良发酵菌种奠定基础,为进一步构建新的用于果酒发酵的PDE1和PDE2基因缺失酿酒酵母提供参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
磨盘柿(Diospyros kaki ‘Mopan’)采于北京市房山区磨盘柿产区。
野生型酿酒酵母(Saccharomyces cerevisiae)为本实验室保存菌株。PDE1基因单拷贝敲除菌株PDE1/Δpde1,PDE2基因单拷贝敲除菌株PDE2/Δpde2,PDE1基因双拷贝敲除菌株Δpde1/Δpde1,PDE2基因双拷贝敲除菌株Δpde2/Δpde2。突变菌株构建:结合同源重组原理[20]和醋酸锂酵母高效转化实验[21]进行基因敲除。
1.1.2 培养基与试剂
YPD培养基:酵母浸粉10 g,蛋白胨20 g,葡萄糖20 g,琼脂18 g,加水补足1 L,121 ℃灭菌15 min。YPD液体培养基:酵母浸粉10 g,蛋白胨20 g,葡萄糖20 g,加水补足1 L,121 ℃灭菌15 min。
DNA分子质量标准2×Taq PCR MasterMix、Marker VII、6×Loading Buffer(溴酚蓝) 天根生化试剂公司;潮霉素B、G418 SULFATE、Triton-x100、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、三羟甲基氨基甲烷(Tris methyl aminomethane,Tris)、乙二胺四乙酸钠(sodium ethylene diamine tetracetate,EDTA)美国Amersco公司;脱氧核糖核酸钠盐、乙酸锂、聚乙二醇 美国Sigma-Alorich公司;三氯甲烷、乙醇、盐酸(均为分析纯) 北京化工厂;引物由Invitrogen公司负责合成。
1.2 仪器与设备
HQ45恒温摇床 武汉中科科仪技术发展有限公司;5810R高速离心机、微量移液器 美国Effendorf公司;生物安全柜 美国Thermo公司;4 ℃预冷离心机 美国Sigma公司;聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司;DYY-6C型电泳仪 北京六一仪器厂;Imager 2200凝胶成像系统美国ALpha公司;QP2010 GC-MS气相色谱-质谱联用仪日本岛津公司;手动固相微萃取进样器 美国Supelco公司;PC-420D固相微萃取工作台、75 μm CAR/PDMS萃取头 美国Corning公司;PHS-3D pH计 上海三信仪表厂;PR-201数字式糖度计 上海右一仪器有限公司;Molecular Devices SpectraMax 190酶标仪 上海艾研生物科技有限公司;T6-新世纪分光光度计 北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 酿造工艺
工艺流程:原料筛选→脱涩处理→破碎→成分调节→接种→初发酵→过滤→陈酿→再过滤→成品。
工艺要点:采摘的新鲜磨盘柿进行脱涩处理并除梗后充分破碎;搅拌混匀后分装,每3 kg置于5 L玻璃罐中,25 ℃发酵,并进行3 次重复实验。发酵前期(玻璃瓶底部出现少量气泡上升)、中期(磨盘柿皮渣形成“冒”盖在玻璃瓶顶部)、后期(液面无明显气泡上升,皮渣下沉至底部)搅拌均匀后取样,取样时间点设为0、3、9、12 d。
1.3.2 发酵特性测定
1.3.2.1 理化指标
可溶性固形物(soluble solids content,SSC):采用数字式糖度仪测定其SSC。总糖:利用苯酚-硫酸法[22]测定。乙醇体积分数:采用酒精计测定。pH值:采用酸度计测定。以上测定各重复3 次。
1.3.2.2 活性物质
总酚:参考Singleton等[23]方法。以没食子酸作标准曲线,醪液中总酚含量换算为每克样品中没食子酸的含量。总黄酮:总黄酮含量的测定参照Jia Zhishen等[24]的方法进行并加以改进。以芦丁作标准曲线,醪液中总酚含量换算为每克样品中芦丁的含量。
1.3.2.3 抗氧化能力测定
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力测定参考Blois等[25]的方法进行;2’-联氨-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) radical,ABTS)自由基清除能力测定参照Mariken等[26]的方法进行;总还原力测定参考Liyana-Pathirana等[27]的方法。以上指标均以标准品Trolox当量表示。
1.3.2.4 挥发性物质
称取3.0 g样品置于15 mL固相微萃取专用样品瓶中,隔膜封口,将75 μm CAR/PDMS萃取头插入气相色谱-质谱仪250 ℃的进样口老化1 h后,迅速拔出插入样品瓶(避免接触底部样品),随后置于60 ℃磁力搅拌器加热平衡20 min后进行气味吸附30 min,最后取出萃取头迅速插入进样口,250 ℃解吸6 min进行风味检测。
气相色谱条件:SPB-50柱(30 m×0.25 mm,0.25 μm);手动无分流进样,进样口温度250 ℃;程序升温:起始温度50 ℃,保持2 min,以3 ℃/min速率升温至150 ℃,再以15 ℃/min升温至250 ℃保持5 min;检测器温度250 ℃,载气为氦气,恒流流速1 mL/min,溶剂切除时间1 min。
质谱条件:电子电离源,电子能量70 eV,接口温度250 ℃,离子源温度220 ℃,质量扫描范围50~600 u。
2 结果与分析
2.1 理化指标结果

图1 接种野生型和突变菌株磨盘柿发酵醪液的品质变化Fig. 1 Changes in quality attributes during Mopan persimmon wine fermentated by wild-type and mutant strains
从图1可以看出,野生型酿酒酵母以及PDEs基因缺失菌株在发酵过程中SSC、总糖、pH值、乙醇体积分数的变化趋势大体一致。接种前,磨盘柿醪液的SSC为22.5 °Brix,总糖质量分数为44%,pH 6.0。PDEs基因缺失菌株均能加快对糖的利用速率,其中Δpde2/Δpde2菌株酿造的磨盘柿酒中SSC以及总糖含量下降速率最快,在发酵结束后SSC为8.8 °Brix,总糖质量分数为0.86%,分别为野生型的66%和21%;Δpde1/Δpde1菌株利用糖的效率最低,发酵结束后总糖质量分数为1.72%,为野生型的43%;PDE1/Δpde1菌株、PDE2/Δpde2菌株发酵结束后总糖含量分别是野生型的35%和38%。Δpde2/Δpde2菌株在发酵前9 d乙醇体积分数增加速率最快,Δpde1/Δpde1菌株增加速率最慢,与利用糖的效率呈正相关。
以上结果表明,PDEs基因缺失菌株均会提高磨盘柿果酒发酵速率,其中Δpde2/Δpde2菌株发酵速率最快,而Δpde1/Δpde1菌株发酵速率最慢。cAMP和cGMP是细胞内信号传递的第2信使,而PDEs具有水解第2信使的功能,有研究表明,酿酒酵母中主要由PDE2调控胞内cAMP水平[28],而且Wilson等[29]研究得出PDE2编码磷酸二酯酶的作用可能是帮助将内部cAMP与外部环境隔离,因此敲除PDEs基因后会加速信号传递,从而提高酿酒酵母对糖的利用速率。Ma Pingsheng[19]和Wilson[30]等均提出,PDE1对控制葡萄糖和细胞内酸化反应起着重要的生理作用,由此推断,敲除PDE2基因可能会增强酿酒酵母中PDE1基因对葡萄糖的控制,从而提高酿酒酵母对糖的利用效率。所以用Δpde2/Δpde2菌株发酵的磨盘柿果酒发酵速率最快。
2.2 活性物质分析结果
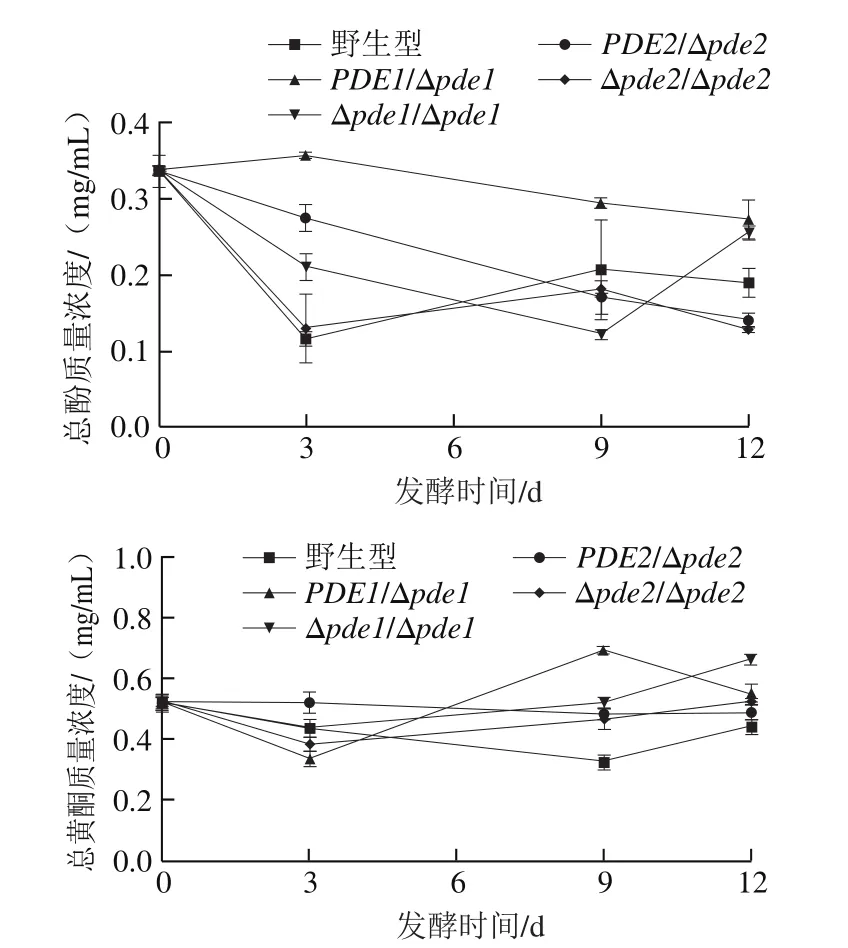
图2 接种野生型和突变菌株磨盘柿发酵醪液活性物质含量Fig. 2 Changes in total phenol and total fl avonoid contents during persimmon wine fermentation by wild-type and mutant strains
从图2可以看出,PDEs基因缺失菌株发酵的磨盘柿果酒总酚与总黄酮含量与野生型相比差异较大。接种前,磨盘柿醪液的总酚质量浓度为0.33 mg/mL,总黄酮质量浓度为0.52 mg/mL。PDE1/Δpde1和PDE2/Δpde2菌株随发酵时间延长总酚含量降低;野生型在前3 d下降最快,在3~9 d有所上升然后趋于平缓;Δpde1/Δpde1菌株在发酵前9 d总酚含量一直降低,9~12 d明显上升;Δpde2/Δpde2菌株先降低后上升再降低。到达发酵终点时,野生型发酵的磨盘柿果酒的总酚质量浓度为0.19 mg/mL,PDE1/Δpde1和Δpde1/Δpde1菌株的总酚含量均高于野生型,分别为野生型的1.4 倍和1.3 倍,而PDE2/Δpde2和Δpde2/Δpde2菌株的总酚含量分别为野生型的73%和68%。
PDEs基因缺失菌株与野生型在发酵0~3 d时总黄酮含量都下降,野生型菌株持续下降到第9天后又缓慢上升;PDE1/Δpde1菌株在3~9 d上升而9~12 d下降;Δpde1/Δpde1和Δpde2/Δpde2菌株在3~12 d缓慢上升;PDE2/Δpde2菌株平缓下降。到达发酵终点时,野生型发酵的磨盘柿果酒总黄酮质量浓度为0.44 mg/mL,4 株突变体的总黄酮含量均高于野生型,依次分别是野生型的1.22、1.5、1.1 倍和1.2 倍。
以上结果表明,接种野生型与突变株酿酒酵母的磨盘柿醪液发酵过程中酚类物质含量总体呈下降趋势,与郭敏等[31]结果一致。与野生型酿酒酵母相比,PDE1/Δpde1和Δpde1/Δpde1菌株会提高磨盘柿果酒的总酚含量,而PDE2/Δpde2和Δpde2/Δpde2菌株会降低磨盘柿果酒的总酚含量;酿酒酵母PDEs基因缺失会提高磨盘柿果酒中总黄酮含量,且Δpde1/Δpde1菌株酿造的磨盘柿果酒中总黄酮含量最高。有研究显示,在酿酒酵母中2 种磷酸二酯酶在酸性条件下调节细胞活力中发挥不同作用,PDE1基因是酸性条件下细胞活力的负调节剂,PDE2基因是酸性条件下细胞活力的正调节剂[32],由此推断,当敲除PDE1基因后,酿酒酵母的细胞活力增强,从而合成总酚总黄酮的能力相对较强,因此Δpde1/Δpde1菌株酿造的磨盘柿果酒中总酚总黄酮含量较高,且PDE1双敲比单敲合成总酚总黄酮的能力强。
2.3 抗氧化能力分析结果


图3 接种不同酿酒酵母磨盘柿发酵醪液抗氧化能力指标Fig. 3 Changes in antioxidant properties during persimmon wine fermentation by wild-type and mutant strains
由图3可知,接种前,磨盘柿醪液的ABTS自由基清除能力为42 μg/g,DPPH自由基清除能力为97 μg/g,总还原力为90 μg/g。野生型发酵醪液中ABTS自由基清除能力随发酵时间延长而缓慢减小,到达9 d后趋于平缓;4 株突变体的清除能力在0~9 d缓慢增强,到达9 d减小并趋于平缓。发酵结束后,野生型菌株酿造的磨盘柿果酒对于ABTS自由基清除能力为35.83 μg/g,PDE1/Δpde1、Δpde1/Δpde1、PDE2/Δpde2和Δpde2/Δpde2菌株的清除能力均比野生型强,分别是野生型的1.37、1.21、1.64 倍和1.5 倍。
所有菌株对于DPPH自由基清除能力总体均随发酵时间延长而上升最后趋于平缓,到达发酵终点时,野生型菌株DPPH自由基清除能力为155.74 μg/g,PDE1/Δpde1、Δpde1/Δpde1、PDE2/Δpde2和Δpde2/Δpde2菌株的清除能力均比野生型强,分别是野生型的1.14、1.08、1.25 倍和1.65 倍。
不同菌株酿造的磨盘柿果酒总还原力随发酵时间延长的趋势不同,发酵终点时,野生型菌株酿造的磨盘柿果酒总还原力为130.41 μg/g,Δpde2/Δpde2菌株的总还原力最强,为野生型的1.06 倍,PDE1/Δpde1和Δpde1/Δpde1菌株的还原力均低于野生型,分别为野生型的92%和70%,PDE2/Δpde2菌株的总还原力为129.81 μg/g,与野生型接近。
以上结果表明,与野生型酿酒酵母相比,PDEs基因缺失菌株会提高磨盘柿果酒对ABTS自由基以及DPPH自由基的清除能力,Δpde2/Δpde2菌株会提高磨盘柿果酒的总还原力。综合比较,PDE2基因缺失菌株比PDE1基因缺失菌株抗氧化能力强,且Δpde2/Δpde2菌株的抗氧化能力最强。有研究指出,PDE2缺失会影响许多不同功能类别的基因[33],由此推测用PDE2基因缺失菌株酿造磨盘柿果酒表现出更高的抗氧化活性。
2.4 挥发性物质分析结果
磨盘柿破碎后的果汁与在发酵12 d时野生型与突变株酿酒酵母发酵的磨盘柿果酒经顶空固相微萃取-气相色谱-质谱联用分析后得挥发性成分相对含量对比结果见表1。经物质匹配度筛选共检测出31 种挥发性风味物质,主要为醇类6 种,酯类12 种,烷烃类8 种,酸类2 种,其他化合物共3 种。
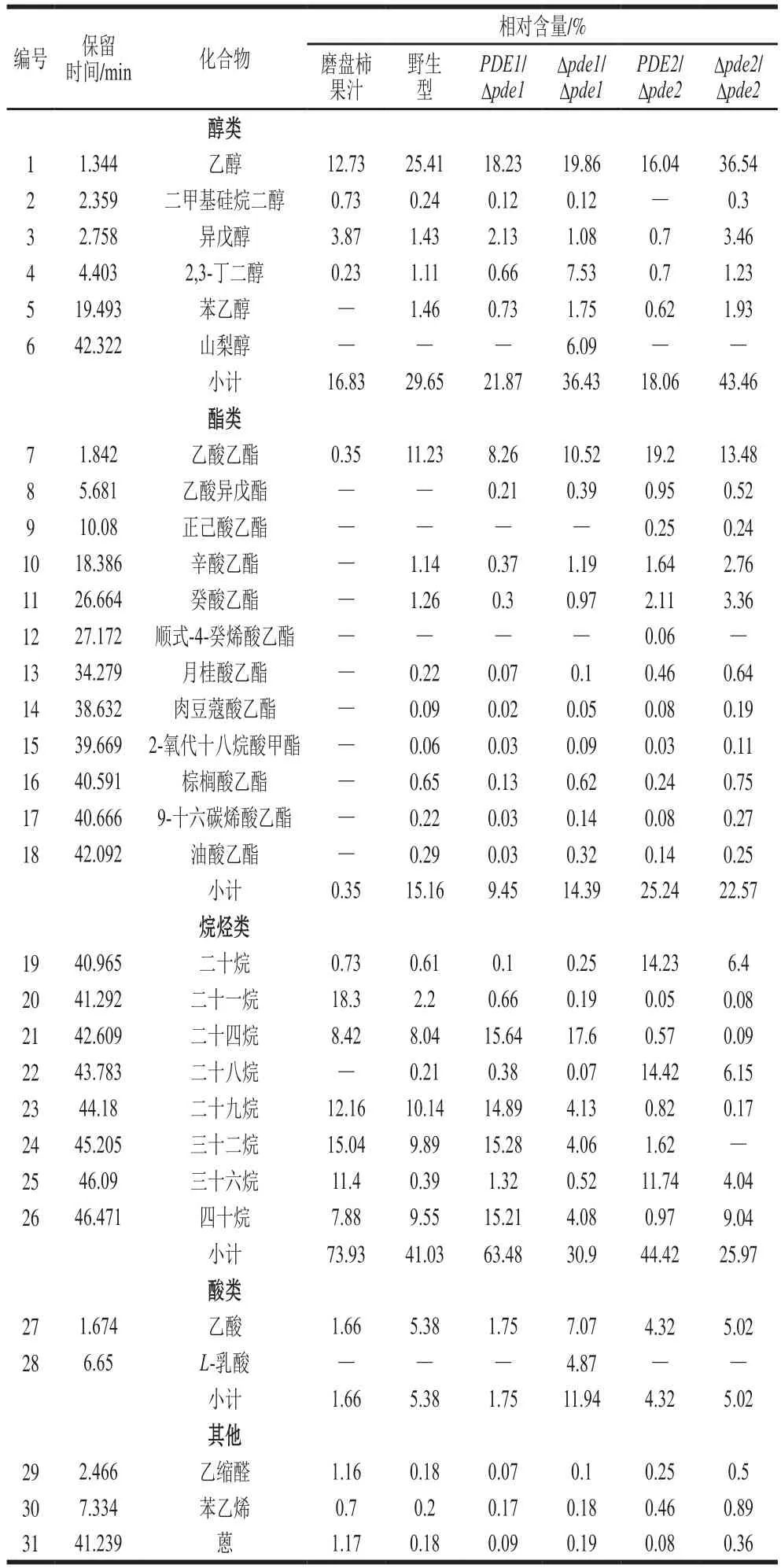
表1 接种野生型和突变菌株的磨盘柿果酒主要香气成分Table 1 Analysis of aroma components in Mopan persimmon wine fermented by wild-type and mutant strains
由表1可知,经野生型酿酒酵母发酵得到的磨盘柿果酒的主要挥发性成分有乙醇、二甲基硅烷二醇、异戊醇、2,3-丁二醇、苯乙醇、乙酸乙酯、辛酸乙酯、癸酸乙酯、月桂酸乙酯、肉豆蔻酸乙酯、2-氧代十八烷酸甲酯、棕榈酸乙酯、9-十六碳烯酸乙酯、油酸乙酯、二十烷、二十一烷、二十四烷、二十八烷、二十九烷、三十二烷、三十六烷、四十烷、乙缩醛、苯乙烯、蒽共25 种香气物质,其中乙醇、乙酸乙酯、二十九烷、三十二烷、四十烷的含量在果酒中含量较高。
PDEs基因缺失菌株与野生型酿酒酵母酿造的磨盘柿果酒中的风味物质种类差异不大,但含量差异较为明显。PDE1/Δpde1菌株的挥发性物质只比野生型多乙酸异戊酯;Δpde1/Δpde1菌株比野生型多山梨醇、乙酸异戊酯、L-乳酸这3 种物质;PDE2/Δpde2菌株酿造的磨盘柿果酒中,未检测出二甲基硅烷二醇,但检测出了正己酸乙酯、顺式-4-癸烯酸乙酯;Δpde2/Δpde2菌株酿造的果酒中未检测出三十二烷,检测出了正己酸乙酯。刘晓艳等[34]对磨盘柿果酒中的香气成分进行了气相色谱-质谱分析,发现异戊醇和苯乙醇等是磨盘柿酒的主要香气成分。且苯乙醇具有玫瑰香味和蜜香,香味独特,是构成磨盘柿酒主要特征香气的组分,乙酸乙酯被认为是对果酒总体香气贡献最强的化合物[35],辛酸乙酯具有玫瑰花香和橙子果香[36]。本研究发现,Δpde2/Δpde2菌株酿造的磨盘柿果酒中醇类相对含量为43.46%,其中异戊醇相对含量为3.46%,苯乙醇为1.93%,均比野生型高,且PDE2/Δpde2型的酯类相对含量为25.24%,是野生型的1.66 倍,可以推断出其风味最佳。但挥发性物质的代谢过程非常复杂,对于上述风味及底物是否转变成有益物质及其机理和安全性,尤其果实本身风味的转化还是酿酒酵母内的代谢过程,还需要进一步探讨。
3 结 论
本实验结合同源重组原理和基因敲除技术,得到PDE1和PDE2基因单敲和双敲菌株的酿酒酵母突变菌株,并在相同条件下比较4 株突变体与野生型酿酒酵母对磨盘柿果酒发酵的影响。结果表明,PDEs基因缺失菌株发酵特性优于野生型菌株,4 株突变体菌株均会提高磨盘柿果酒发酵速率,其中Δpde2/Δpde2菌株在发酵过程中糖的消耗速率以及乙醇体积分数的上升速率最快;接种PDEs基因缺失菌株以及野生型菌株的磨盘柿果酒总酚、总黄酮含量在发酵过程中呈现下降趋势;抗氧化能力在发酵前期上升明显,后期趋于平稳,其中接种Δpde2/Δpde2菌株的磨盘柿果酒活性物质与抗氧化能力相对较高。PDEs基因缺失菌株与野生型酿酒酵母酿造的磨盘柿果酒中的风味物质种类差异不大,PDE2/Δpde2菌株酿造的磨盘柿果酒中酯类相对含量较高,产香能力较强,风味最佳。

