不同蜡制玉米淀粉对肌原纤维蛋白凝胶特性的影响
刘静雪,李凤林,张传军
(吉林农业科技学院食品工程学院,吉林 吉林 132101)
玉米淀粉由于产量大且经济实用被广泛的应用于食品、生物制药和化工制造等行业,目前世界上玉米淀粉使用率远高于其他淀粉。其中,约含有100%支链淀粉的蜡质玉米淀粉,由于其具有高度的膨胀性,较高的透明度,较强黏滞性和成膜性,较好的糊液稳定性且不易老化等优点[1-2],在食品领域中应用较多。虽然蜡质玉米淀粉相对于其他淀粉性质优越,但仍存在淀粉固有的脱水易老化、溶解性低、耐机械性差等缺点[3],为扩大其应用范围,通过酯化和交联对天然淀粉进行改性,对蜡质玉米淀粉的性能特性进行改良,使其具有更强的应用价值。酯化可以通过引入乙酰基将羟基取代赋予淀粉产品较好的亲水性能,交联处理能增加淀粉颗粒分子内部和分子间的联系,从而增加淀粉结构中交联的密度,同时,交联也能很好地限制水分吸收[4]。
在肉类工业中,尤其是肉罐制品、肠类制品、肉糜类制品等的加工过程中,常需要添加变性淀粉改善产品的保水性、组织状态、切片性和适口性,赋予产品极佳的风味,使肉制品的感官品质增加的同时还能显著提高产品产量以降低生产成本[5-6]。近年来,研究玉米变性淀粉与肌肉蛋白的作用机制及其在肉制品中的应用较多[7-9],而优点更多的蜡质玉米变性淀粉的研究却较少[10]。本实验通过将蜡质玉米淀粉与变性淀粉(包括酯化玉米淀粉、交联酯化玉米淀粉)添加到肌原纤维蛋白复合体系中,研究在肌原纤维蛋白加热过程中淀粉与蛋白的相互作用机制,以及对复合凝胶持水性、质构特性、白度、弹性模量和微观结构的影响,为变性蜡质玉米淀粉进一步在肉制品中的应用提供依据。
1 材料与方法
1.1 材料与试剂
猪背部最长肌 市售;蜡制玉米淀粉、酯化玉米淀粉、交联酯化玉米淀粉 沈阳宝瑞祥食品有限公司;氯化钠、磷酸二氢钠、磷酸氢二钠、氯化镁、乙二醇双(2-氨基乙基醚)四乙酸(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
BL-A系列西特精密电子天平 上海亚津电子科技有限公司;GL-21M高速冷冻离心机 湖南迈克尔实验仪器有限公司;T6系列紫外-可见分光光度计 南京菲勒仪器有限公司;JJ-2B玻璃杯高速组织捣碎机 温州标诺仪器有限公司;TA-XT plus型质构分析仪 英国Stable Micro System公司;NR10QC通用色差计 北京京海正通科技有限公司;HH-8数显恒温水浴锅 镇江瑞祥仪器有限公司;溴酚蓝 赫澎(上海)生物科技有公司;Discovery DHR-1流变仪 美国TA仪器公司;S-3400N扫描电子显微镜 日本日立公司。
1.3 方法
1.3.1 肌原纤维蛋白的提取
鲜猪肉洗净,除结缔组织,剔肌膜,具体操作参考Xiong Youling等[11]的方法进行,需在4 ℃条件下进行提取,提取后的肌原纤维蛋白放置在4 ℃的冰箱备用。
肌原纤维蛋白溶于磷酸缓冲液(0.6 mol/L NaCl,50 mmol/L Na2HPO4/NaH2PO4,pH 6.5),在40 mg/mL肌原纤维蛋白蛋白中,分别加入2%、4%、6%、8%和10%的蜡制玉米淀粉(简称原淀粉)、酯化蜡制玉米淀粉(简称酯化淀粉)和交联酯化蜡制玉米淀粉(简称交酯淀粉)。充分混合后取5 g混合物放入25 mm×40 mm密封的玻璃瓶中后,将其放入80 ℃的水浴锅中加热20 min,取出凝胶置于室温(24~26 ℃)下冷却,之后4 ℃冰箱贮藏备用,后续指标测定均需先将凝胶取出放置在室温下平衡30 min。
1.3.3 指标的测定
1.3.3.1 复合凝胶持水性的测定
按照Kocher等[12]的方法和Han Minyi等[13]的参数进行设定。复合蛋白凝胶称质量平衡后,于10 000 r/min离心10 min,每个实验重复3 次。根据公式(1)计算凝胶持水性:
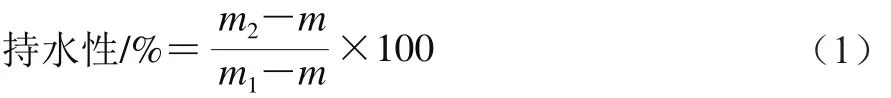
式中:m为离心管质量;m1为离心前凝胶和离心管总质量;m2为离心后凝胶和离心管总质量。
1.3.3.2 复合蛋白凝胶质构的测定
陶瓷的理化特性见表1。复合NCTD后生物陶瓷孔隙率由72.12%变为74.13%,钙磷比由1.51变为1.49,力学强度由3.28变为3.20,复合NCTD后生物陶瓷与未复合陶瓷在生物力学及钙磷比上差异均无统计学意义(P>0.05)。
参考王博等[14]的方法并略作修改。将待测样品置于测定平台上,利用物性分析仪进行测量。参数设定如下:探头型号选择P/50,下压距离50%,触发力5 g,测试前速率5 mm/s,测试速率2 mm/s,测试后速率5 mm/s。每个样品进行3 次重复实验。
1.3.3.3 复合凝胶白度值的测定
测定凝胶的色差,即L*值、a*值、b*值。实验过程中每个样品均进行3 次平行实验,实验结果取平均值,并根据Park[15]的方法按式(2)计算白度值W:
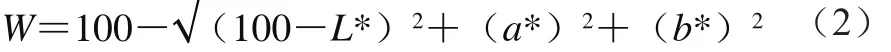
1.3.3.4 复合蛋白表面疏水性的测定
根据Chelh等[16]的方法测定复合蛋白的表面疏水性。将1 mL的3 mg/mL蛋白溶液加入200 μL 1 mg/mL的溴酚蓝,室温条件下搅拌10 min后,7 000 r/min离心15 min,取上清液稀释10 倍后在595 nm波长处测定吸光度。其中,溴酚蓝空白样是用1 mL的pH 6.0 20 mmol/L的磷酸盐缓冲液加200 μL溴酚蓝配制而成。表面疏水性以溴酚蓝结合量表示,按式(3)计算:
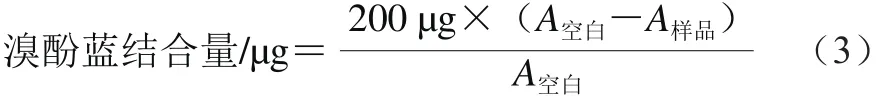
式中:A空白为空白样品的吸光度;A样品为所测样品的吸光度。
1.3.3.5 动态流变学性质测定
取出约5 g的复合蛋白样品均匀涂布在测试平台,采用50 mm平行板,测试参数为:上下板夹缝0.5 mm,频率0.1,应变2%,以1 ℃/min从20 ℃升温到80 ℃。平行板外蛋白与空气接触处用石蜡油封,每个样品重复3 次。
1.3.3.6 复合蛋白凝胶微观结构的测定
取凝胶样品切成约2 mm×5 mm的小条,选用2.5%、pH 6.8的戊二醛溶液浸泡过夜固定,再用0.1 mol pH 6.8磷酸缓冲液洗涤3 次,每次10 min。然后分别用50%、70%、80%、90%乙醇溶液进行脱水,每次10 min;再用100%乙醇脱水3 次,每次10 min,最后用氯仿脱脂1 h后,依次用100%乙醇-叔丁醇(1∶1,V/V)和叔丁醇各置换1 次,每次15 min。用HITACHI ES-2030型冷冻干燥仪对样品进行干燥。扫描操作:样品观察面向上黏贴在扫描电子显微镜样品台上,用E-1010(Giko)型离子溅射镀膜仪进行离子溅射喷金,观察。
1.4 数据统计与分析
本实验采用Statistix 8.1 软件包GeneralLinear Models程序进行数据分析,用SigmPlot 12.0软件进行作图,每个样品进行3 次重复实验。
2 结果与分析
2.1 淀粉对复合凝胶持水性的影响
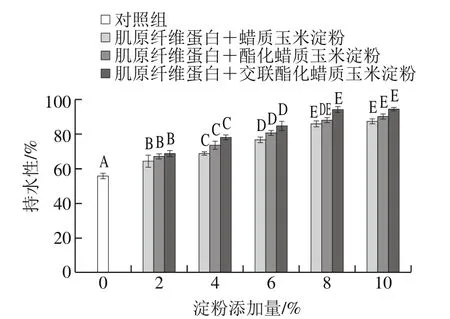
图1 淀粉类型和添加量对肌原纤维蛋白凝胶持水性的影响Fig. 1 Effects of starch type and concentration on water holding capacity of myofibrillar protein gels
由图1可知,随着淀粉添加量的增加,复合蛋白凝胶的持水性均呈显著增加趋势(P<0.05),当原淀粉、酯化淀粉、交酯淀粉添加量为2%时,持水性与肌原纤维蛋白相比差异显著(P<0.05),分别比肌原纤维蛋白提高了12.99%、15.80%和17.67%,说明添加淀粉后凝胶的持水性增强,并且随着添加量增加,3 种淀粉的复合凝胶持水性显著增加(P<0.05),淀粉添加量大于8%时,凝胶的持水性仍增加但其差异不显著(P>0.05)。在相同添加量条件下,由图1可知,从复合凝胶的持水性来看,持水性最好的是交酯淀粉,其次是酯化淀粉,最差是原淀粉,但三者间差异不显著(P>0.05)。
在肌原纤维蛋白中添加淀粉,淀粉颗粒吸水膨胀,能有效减少水分散失,从而提高整个复合凝胶体系的持水性。而酯化淀粉提高持水性机制可能是淀粉颗粒充分吸水胀润,吸收复合体系内的游离水并转化为结合水,将其填充在蛋白三维空间网络结构中,从而减少蛋白热诱导凝胶形成过程中的水分损失[17]。并且,酯化处理使羟基被乙酰基取代,引入乙酰基削弱了分子间氢键的缔合作用,使淀粉在水中分散度好,增强了其亲水性能[18];交酯淀粉是原淀粉经乙酰化和交联化复合处理得到的,交联作用能较大幅度地增大淀粉糊黏度,使凝胶网络孔隙充满不易流动水和胀润的淀粉颗粒[18],从而提高凝胶持水性能,这也与张钟等[5]将交联蜡质淀粉添加到午餐肉中的研究结果相一致。
2.2 淀粉对复合凝胶质构特性的影响
由图2可知,淀粉添加组均显著高于未加淀粉组(P<0.05),并且随着淀粉添加量的增加,除交酯淀粉在添加量10%时出现下降外,其他复合凝胶的硬度均显著增加(P<0.05),而淀粉复合凝胶的弹性均呈先增加后下降的趋势。在相同添加量时,酯化淀粉和交酯淀粉复合凝胶硬度和弹性数值上均高于原淀粉,但无显著性差异(P>0.05)。
在添加量为8%时,酯化淀粉和交酯淀粉复合凝胶的硬度和弹性均为最大值,酯化淀粉和交酯淀粉的凝胶硬度比肌原纤维蛋白分别提高了105%和112%,比原淀粉分别提高了13.73%和18.04%,酯化淀粉和交酯淀粉凝胶的弹性比肌原纤维蛋白分别提高了17.81%和18.75%,比原淀粉分别提高了6.33%和7.18%。这是由于酯化淀粉经变性处理后,破坏淀粉原有的线性结构和分支链段,分子间的相互作用减弱,游离的多糖链段在热诱导凝胶形成过程中与肌原纤维蛋白相互交联,增强原凝胶网络结构的强度;同时,引入的乙酰基团空间位阻较大,空间位阻效应减弱了淀粉分子间作用,进而促进游离水通过化学作用力渗入复合凝胶网络结构中转化为结合水,填充原有蛋白网络结构[19],因此,能显著提高凝胶弹性。另一方面,淀粉经交联处理后,淀粉颗粒间的随机结合增加,同时加强分子内部和分子间的联系[20],分子交联水平的增加一定程度上对凝胶的硬度和弹性的提高起促进作用。但淀粉添加量过多时,多余的淀粉颗粒分子会削弱肌原纤维蛋白分子内及与淀粉分子间的相互作用,并且淀粉颗粒吸水膨胀,大量游离水分子涌入会破坏原有空间网络结构,从而对凝胶的硬度和弹性有着不利的影响。
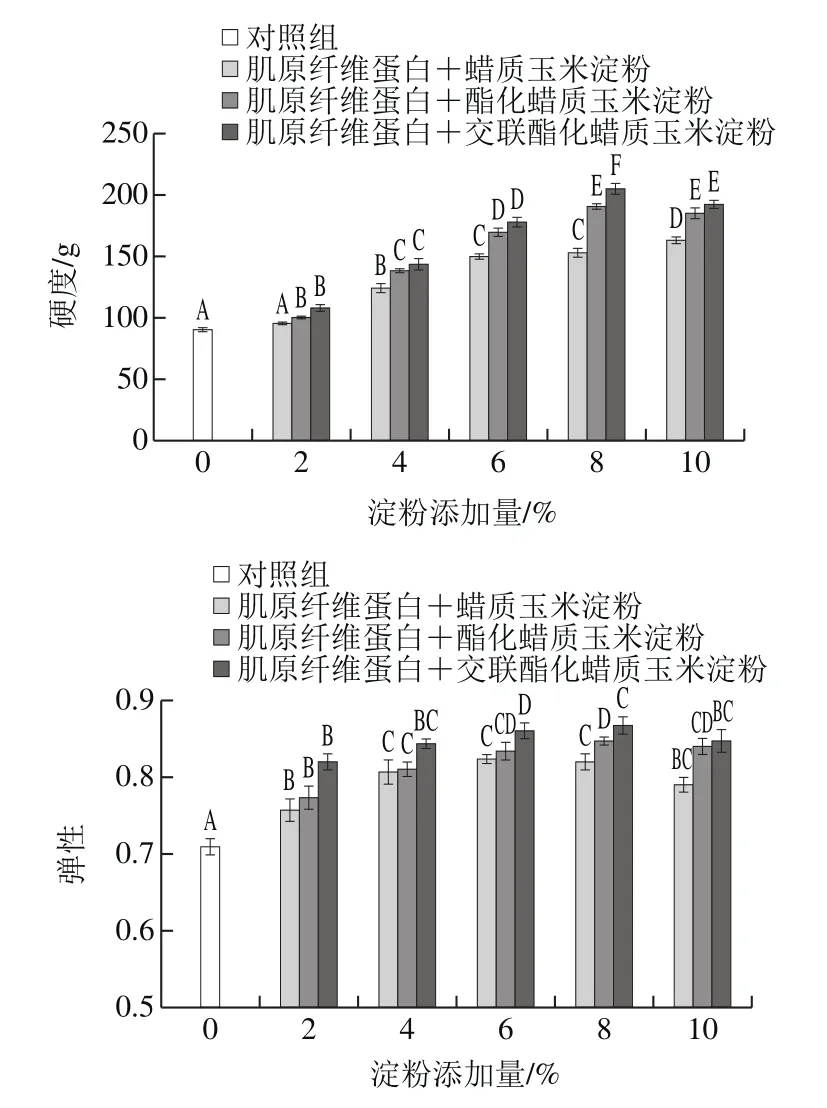
图2 淀粉类型和添加量对肌原纤维蛋白凝胶质构特性的影响Fig. 2 Effects of starch type and concentration on textural properties of myofibrillar protein gels
2.3 淀粉对复合凝胶白度的影响
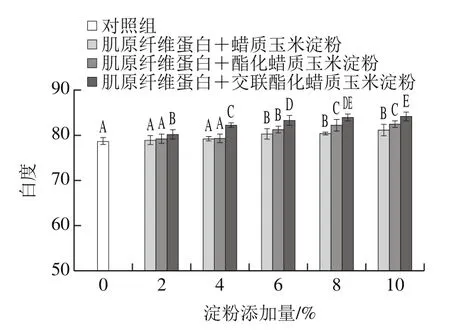
图3 淀粉类型和添加量对肌原纤维蛋白凝胶白度值的影响Fig. 3 Effect of starch type and concentration on whiteness value of myofibrillar protein gels
从图3可以看出,复合凝胶的白度值均高于对照组,并且随着淀粉添加量的增加,复合凝胶的白度值呈升高的趋势。其中,交酯淀粉变化最为显著(P<0.05)。可能由于蜡质玉米淀粉本身呈现白色,向肌原纤维蛋白凝胶中添加自然会使得其白度值升高,并且随着添加量的增加,白度值升高越明显,同时,Hong等[21]研究表明,凝胶内部水分含量与L*值呈正相关,水分的增加会使光的反射随之增强,从而L*值增加,根据白度值计算公式可知,其对白度值的影响较大。由于前面持水性结果表明,复合凝胶中交酯淀粉的持水能力最好,酯化淀粉次之,原淀粉最差,持水能力越强凝胶白度越大,但当交酯淀粉和酯化淀粉的添加量大于8%时,由于淀粉与肌原纤维蛋白束缚自由水分的能力有限,继续添加淀粉凝胶白度值不发生显著变化(P>0.05)。同时,通过上述结果分析可以发现,由于交酯淀粉持水性较强,其添加量为2%时的白度值与原淀粉和酯化淀粉添加量6%时相似,添加较少的交酯淀粉即可以取得和原淀粉及酯化淀粉相同的色度,之前研究表明,白度值越大,所呈现的色泽越差,由本研究可知,交酯淀粉的添加对凝胶白度值影响较大(P<0.05),导致凝胶的颜色过白,色泽较差。因此,在生产加工应用时,综合考虑持水性、质构特性、流变性能等指标,采取适量添加交酯淀粉,防止过多的添加影响产品色泽。
2.4 淀粉对复合蛋白表面疏水性的影响
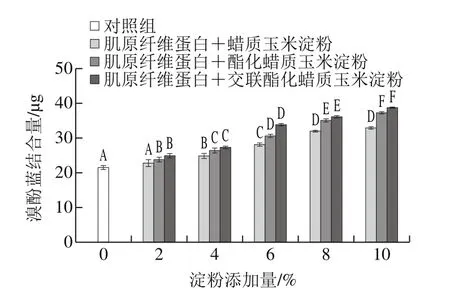
图4 淀粉类型和添加量对肌原纤维蛋白表面疏水性的影响Fig. 4 Effects of starch type and concentration on surface hydrophobicity of myofibrillar protein gels
表面疏水性可以直观地反映蛋白中疏水性基团的相对含量,从而间接推断蛋白分子的变性程度[22]。不同比例的原淀粉、变性淀粉与肌原纤维蛋白形成复合蛋白表面疏水性的变化如图4所示,复合蛋白的表面疏水性均高于肌原纤维蛋白,并随着淀粉添加量的增加显著增加(P<0.05)。在相同添加量时,添加交酯淀粉复合蛋白的表面疏水性在数值上高于酯化淀粉和原淀粉复合蛋白,但差异不显著(P>0.05)。未添加淀粉的肌原纤维蛋白表面疏水性(溴酚蓝结合量)为21.47 μg,而添加10%的淀粉时,原淀粉、酯化淀粉、交酯淀粉的复合蛋白表面疏水性分别为33.03、37.32、38.87 μg,比对照组分别提高53.84%、73.82%、81.04%,并且酯化淀粉、交酯淀粉分别比原淀粉提高19.98%和27.2%。可能由于在蛋白加热形成凝胶过程中,淀粉分子受热,结构越来越紊乱,淀粉聚合物尤其是支链淀粉,将更多的基团暴露在水里[23]。而原淀粉经过酯化改性后,引入乙酰基团,由于极性较强,空间位阻较大会使分子间相互作用减弱,导致分子结构展开使埋藏在内部的更多疏水基团暴露出来,同时也可以与蛋白反应产生疏水性氨基酸残基,而交联化也会增强分子间的疏水相互作用,从而使复合蛋白体系的表面疏水性增加。
2.5 淀粉对复合蛋白流变特性的影响
流变学性能可以反映出肌原纤维蛋白在受热过程中蛋白热聚集变性的过程,本实验对肌原纤维蛋白与蜡质淀粉、酯化淀粉和交酯淀粉的复合物在热凝胶过程中动态流变行为进行检测,从图5可知,各组在20~46 ℃时,肌原纤维蛋白受热其凝胶弹性发生显著变化,样品的弹性模量(G’)呈逐渐升高的趋势,至46 ℃时达到最大,之后急剧下降,至56 ℃时最低,在随后的加热过程中G’又迅速上升。在20~46 ℃阶段,G’的增加主要由于肌球蛋白头部的结合,凝胶初步形成;而随着温度的进一步升高,肌球蛋白尾部逐渐展开,导致肌球蛋白的头部结合趋于松散瓦解,导致G’持续下降;在温度超过56 ℃后,随着蛋白的变性,G’急剧增加,凝胶网络稳步形成[24]。
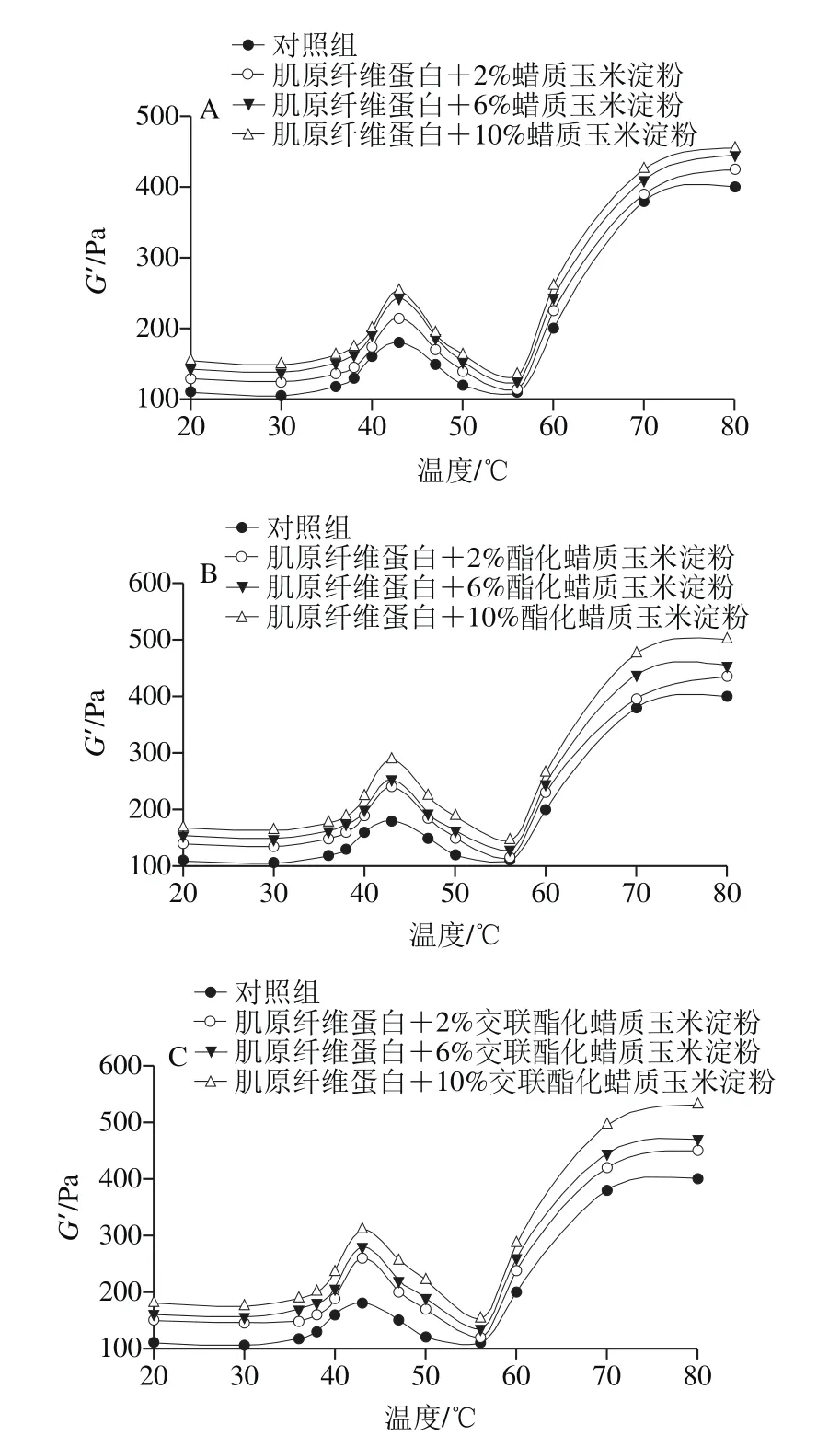
图5 淀粉类型和添加量对肌原纤维蛋白凝胶弹性模量G’的影响Fig. 5 Effects of starch type and concentration on storage modulus (G’) of myofibrillar protein gels
从图5可以看出,肌原纤维蛋白对应的G’max为400.23 Pa,在添加量为2%、6%、10%时,添加原淀粉的各处理组对应的G’max分别为424.86、445.10、454.79 Pa。添加酯化淀粉分别为435.11、453.98、510.12 Pa,而添加交酯淀粉则为452.09、474.96、534.33 Pa,在添加量为10%时,酯化淀粉和交酯淀粉组比对照组分别提高了27.46%、33.51%,比原淀粉组分别提高了12.17%、17.50%,虽然原淀粉组也能提高凝胶弹性模量,但明显看出添加变性淀粉组比原淀粉组更能显著提高肌原纤维蛋白的弹性模量(P<0.05),且随着添加量与弹性模量呈正相关。吴满刚等[25]研究发现,玉米淀粉提高复合凝胶弹性模量的促进效应与淀粉糊化温度呈正相关,在玉米淀粉糊化前蛋白凝胶网络已经形成,淀粉颗粒在糊化前主要通过吸水膨胀增强凝胶强度,在糊化过程的膨胀是通过充填作用支撑肌原纤维蛋白已形成的凝胶网络体系[26]。淀粉经乙酰化作用,分子上引入的亲水基团,促进淀粉颗粒的溶解和膨胀,使淀粉容易糊化;并且分子作用力和空间位阻作用使淀粉体系稳定,提高体系的黏度;而引入的交联化学键使淀粉分子间和分子内的作用力增强,交酯复合改性淀粉包含交联淀粉和乙酰化淀粉的优点,具有较低的糊化温度和较高的峰值黏度,因此有利于复合凝胶弹性模量的提高[27-28]。
2.6 淀粉对复合凝胶微观结构的影响

图6 淀粉类型和添加量对肌原纤维蛋白凝胶微观结构的影响Fig. 6 Effects of starch type and concentration on microstructure of myofibrillar protein gels
从图6可以看出,肌原纤维蛋白凝胶网络结构趋于松散,形成较大的网格,有明显的孔洞,蛋白间的交联较稀疏。而添加淀粉组,网格结构致密均匀,孔洞较细小,蛋白交联较紧密,且随着淀粉添加量的增大,复合凝胶所形成的网络结构越来越致密,蛋白充分交联。在添加量为2%时,添加淀粉的复合凝胶结构与对照组凝胶相差不大,网络结构也松散无序,存在较多空洞。在添加量6%时,添加淀粉的复合凝胶结构较2%时有显著改善,尤其添加交酯淀粉和酯化淀粉微观结构变化最为显著(P<0.05),当添加量为10%时,微观结构更趋于致密均匀,略有孔洞,截面平整。在相同添加量时,添加交酯淀粉的复合凝胶网络结构与添加酯化淀粉的相近,要好于添加原淀粉所形成的凝胶。微观结构的变化主要因为蛋白凝胶基质具有较完整的三维网络结构,淀粉颗粒通过吸水膨胀填充进蛋白基质中[29],或者经高温糊化后与肌原纤维蛋白分子通过分子作用力相结合,将更多的游离水分束缚进凝胶结构[30],使蛋白网络孔洞减少,形成较致密的网络结构。而酯化和交联处理淀粉会将游离水分子固定在网格结构中并增强交联,填充孔洞赋予产品以细腻的组织结构[3],凝胶微观结构也与前面凝胶的质构特性及持水性结果相一致,淀粉添加量越大,更多的水分子通过毛细管作用被束缚或聚集在凝胶网络内,凝胶结构更加致密均匀。
3 结 论
在肌原纤维蛋白体系中添加原淀粉、酯化淀粉和交酯淀粉,通过对混合蛋白凝胶持水性、质构特性、表面疏水性、白度值、流变特性及微观结构的测定,可得出添加淀粉均可显著提高肌肉蛋白的持水性、硬度、弹性、表面疏水性和弹性模量,且除硬度和弹性在添加量为10%有所降低外,持水性、表面疏水性和弹性模量均随着添加量的增加显著增加(P<0.05),其中交酯淀粉对肌原纤维蛋白的影响最大,其次是酯化淀粉,影响最小的是原淀粉。微观结构显示,在淀粉添加量为2%时,淀粉对蛋白凝胶结构影响不大,当添加量为6%时,凝胶结构显著改善,而添加量到达10%时,凝胶致密均匀,这也与持水性和质构特性的结果相一致。上述研究表明交酯淀粉对提高肌原纤维蛋白凝胶的效果更好,且该实验条件下的最佳添加量为8%。通过本研究得出,变性淀粉的添加对肌原纤维蛋白凝胶形成有明显改善作用,为变性淀粉在肉制品中的充分利用提供一定的参考依据。

