γ-CGTase突变体制备及其产γ-CD条件优化
王金鹏 , 王 萍 , 苑 征 , 李林林 , 范浩然 , 金征宇
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2.江南大学 食品学院,江苏 无锡 214122;3.食品安全与营养协同创新中心,江南大学,江苏 无锡214122)
环糊精(cyclodextrin,简称CD)是由环糊精葡萄糖基转移酶 (cyclodextrin glycosyltransferase,简称CGTase)酶解淀粉或者淀粉类似物产生的由D-吡喃型葡萄糖单元通过α-1,4-糖苷键连接而成的一类环状低聚化合物[1-3]。与α-CD、β-CD相比,γ-CD具有独特的性质:首先,γ-CD具有较大的空腔和较高的溶解度,能够包埋较大的客体分子从而增加其溶解度,进而改变它们的理化性质;其次,γ-CD安全性高,可以被人体内的唾液淀粉酶和胰异淀粉酶迅速消化[4-5],因此,γ-CD在人体小肠内可以迅速的降解和吸收[6-7],但α-CD、β-CD则不能。并且γ-CD的高生物利用度使得其在食品和医药领域有着特殊的应用。
影响γ-CD产率及产物专一性的因素有很多,主要包括CGTase的来源及其酶学特性,反应条件如反应时间、反应温度、底物浓度、底物种类、有机溶剂种类及含量等的影响。曹新志等[8]以质量分数5%的马铃薯、玉米、木薯、甘薯、焦藕淀粉为底物,加入质量分数2%的甘草酸和适量的CGTase酶液,于60℃反应12 h,结果表明以木薯淀粉和焦藕淀粉为底物时γ-CD转化率最高;Rendleman等人[9]利用Bacillus sp.AL6生产γ-CD时,当底物质量分数由2.5%增加到6%时,γ-CD的转化率却由35%降到了21%。Kyoko等人[10]研究发现改变反应的pH,也会使环糊精种类所占比例发生改变。还有研究表明,在低温及有机溶剂存在的条件下,更有利于提高环糊精的转化率,因为低温条件下环糊精-有机溶剂复合物更加稳定,易于将环糊精从反应体系中沉淀出来,使酶反应向着正方向进行[11-12]。
作者所用γ-CGTase来自于Bacillussp.G-825-6,据报道该酶催化淀粉不产生α-CD,仅产生β-CD和γ-CD。作者依据参考文献,对该酶位于-7亚位点附近的211位氨基酸(酪氨酸)进行了定点突变,研究了突变体Y211L催化淀粉产γ-CD的条件,对于降低γ-CD的生产成本和推动γ-CD的工业化生产具有一定意义。
1 材料与方法
1.1 实验材料
质粒 pET-20b (+)/γ-cgt: 德国莱比锡大学Zimmermann教授提供;克隆宿主E.coliDH5α和E.coliBL21(DE3):购于南京百斯凯科技有限公司。
可溶性淀粉、玉米淀粉、马铃薯淀粉、木薯淀粉、酵母粉、胰蛋白胨、氯化钠、异丙基-β-D-硫代半乳糖苷、氨苄、三羟甲基氨基甲烷等:购自国药集团。
高速冷冻离心机(BIOFUGE PRIMOR):美国Thermo Scientific有限公司产品;双光束紫外可见分光光度计(TU-1900):北京普析通用仪器有限责任公司产品;高效液相色谱仪(LC-20AT230V)、示差折光检测器 (RID-10A)、AKTA purifier900蛋白纯化系统:岛津公司产品;Hypersil NH2色谱柱(4.6 mm ×250 mm,5 mAPS-2Hypersil 微 粒 ): 美 国Thermo公司产品;纯泰Ni-NTA亲和层析柱:GE Healthcare life sciences公司产品;ShodexOHpak SB-804 HQ和OHpak SB-802.5 HQ色谱柱:日本昭和公司产品。
1.2 实验方法
1.2.1 突变体的构建 以质粒 pET-20b(+)/cgt为模板,设计一对互补引物,采用一步PCR法突变CGTase基因中的相应位点,设计引物如下:
正向引物:5’-ATC GAAATCTTCTTGATTTAG CTAGT-3’,
反 向 引 物 :5’ -GACTAGCTAAATCAAGAA GAT TTC GAT-3’,
PCR反应体系为:DNA模板10~100 ng,正向突变引物(10 μmol/L)1 μL,反向突变引物(10 μmol/L)1 μL,5×Reaction Buffer10 μL,Fast Alteration DNA Polymerase(2.5 U/μL)1.5 μL,用灭菌的双蒸水补充至 50 μL。
质粒DNA的提取按照Thermo Scientific公司的质粒小提试剂盒说明书提取。
PCR扩增条件为:预变性(95℃)3 min;变性(95 ℃)30 s,退火(55 ℃)30 s,延伸(72 ℃)3 min,共30个循环;延伸(72℃)5 min,冷却至 4℃。
取PCR产物50 μL加入20 U/μL的限制性内切酶DpnI 1 μL,充分混匀后将该酶切体系于37℃条件下消化1 h。
将酶切后的产物转化至宿主菌中,具体步骤如下:从-80℃冰箱中取出感受态细胞E.coli DH-5α置于冰上解冻;取45 μL刚刚解冻好的感受态细胞和5 μL DpnI消化产物放于提前预冷好的2 mL无菌离心管中,用枪头轻柔吹打混匀,继续冰浴30 min;将试管放到42℃水浴锅中,准确热激60 s,立即置于冰上5 min;加入500 μL预热的无菌的LB培养基(不含Amp),混匀后置于37℃摇床以200 r/min振荡培养1.5 h,使菌体复苏;培养结束后,5 000 r/min离心5 min,去掉上清液400 μL。将余下的感受态细胞涂布在含有Amp的LB固体琼脂培养基上,将平板置于室温直至液体被吸收,倒置平板,37℃培养12~16 h。
挑取LB平板上的单菌落接种至含有100 μg/mL Amp的LB液体培养基中,置于37℃恒温摇床中以200 r/min振荡培养10 h,然后提取质粒、酶切,DNA琼脂糖凝胶电泳验证,将验证正确的质粒送至上海生物工程公司测序鉴定。将测序正确的质粒转化至E.coli BL21(DE3),挑取单菌落接种至含有 100 μg/mL氨苄青霉素钠的LB液体培养基中,置于37℃恒温摇床中以200 r/min振荡培养过夜,保藏菌种即得到含有突变质粒的基因工程菌,将该基因工程菌置于-80℃冰箱中保藏。
1.2.2 Y211L/γ-CGTase 的制备、纯化
1)溶液配制方法 LB培养基配制:取胰蛋白胨10 g、NaCl 10 g、酵母提取物5 g,加入去离子水1 L,搅拌均匀后分装,于高压灭菌锅内121℃灭菌15 min;IPTG溶液制备:准确称取1.19 g异丙基-β-D-硫代半乳糖苷置于10 mL烧杯中,加入少量无菌水溶解后,转移至灭菌的5 mL容量瓶中定容,分装后于-18℃下保存;氨苄溶液配制:准确称取1 g氨苄置于10 mL烧杯中,加入少量无菌水溶解后,转移至灭菌的10 mL容量瓶中定容,分装后于-18℃下保存;Tris-HCl溶液配制:取6.05 g三羟甲基氨基甲烷置于1 L的烧杯中,加入1 L去离子水溶解,滴加盐酸用pH计调pH至0.85,后置于4℃冰箱保存。
2)环糊精糖基转移酶的制备方法 从冰箱中取出甘油管保藏菌接种至含有50 mL LB培养基的250 mL的锥形瓶中,在37℃、200 r/min条件下振荡培养10 h。
按体积分数4%的接种量接种至含有100 mL培养基的500 mL的锥形瓶中培养,在600 nm下测定吸光度,待A600nm=0.6~0.8时加入IPTG使其终浓度为0.05 mmol/L,后在18℃、200 r/min下诱导培养16 h。培养结束后,菌液在5 000 r/min离心30 min,弃掉上清液,收集菌体。将菌体悬浮于pH 8.5的Tris-HCl中进行超声破碎,离心后所得上清液即粗酶液。
3)环糊精糖基转移酶的纯化方法 粗酶液纯化采用淀粉吸附法。向粗酶液中按质量分数5%加入玉米淀粉,然后加入硫酸铵使其终浓度为1 mol/L,在4℃下缓慢搅拌1 h,使酶充分被淀粉吸附;反应结束后将混合物5 000 r/min离心15 min,沉淀用预冷的1 mol/L的硫酸铵洗涤除去未被吸附的蛋白质,离心后取沉淀;将沉淀用含有1 mmol/L γ-CD的50 mmol/L、pH 8.5的Tris-HCl在37℃下振荡混合30 min离心后得到洗脱液1,将剩余沉淀再用同样的含有γ-CD的缓冲液洗脱,得到洗脱液2;将两次洗脱液合并,用50 mmol/L、pH 8.5的Tris-HCl缓冲溶液在4℃透析24 h,每隔8 h换一次缓冲溶液。
1.2.3 γ-CD标准曲线测定方法 称取0.4 g γ-CD,用少量超纯水溶解后定容至100 mL,配制成4 mg/mL的标准溶液。取标准溶液分别稀释至0.5、1.0、1.5、2.0、2.5、3.0、3.5 mg/mL,取适量稀释液过膜用高效液相色谱法测定绘制标准曲线,测定条件为流动相体积分数70%乙腈,流量1 mL/min,温度40℃,进样量 20 μL。
1.2.4 酶活测定 配制质量分数2%的可溶性淀粉为底物,取900 μL底物于2 mL离心管中加入100 μL酶液,置于酶反应器上反应50℃,800 r/min反应半小时后取500 μL沸水浴中灭活10 min,测定。剩余的500 μL继续反应半小时后煮沸灭活,测定。
测定方法:以γ-CD的转化率为指标采用高效液相色谱法进行分析。取反应液500 μL加入500 μL乙腈10 000 r/min离心10 min取上清液过膜,进行测定分析,分析条件为流动相体积分数70%乙腈,流量 1 mL/min,温度 40 ℃,进样量 20 μL。
酶活定义:上述方法,每30 min生成1 mmol的γ-CD需要的酶量为一个酶活单位。
1.2.5 催化条件优化方法
1)单因素实验 以γ-CD的转化率为指标分别考察底物种类、底物浓度、加酶量、反应时间对CGTase催化淀粉分解的影响。
分别取玉米淀粉、马铃薯淀粉、木薯淀粉做为底物,加入去离子水加热糊化,制成质量分数为1%的溶液,冷却到室温,取1 mL底物加入适量CGTase,置于恒温震荡混匀器上反应24 h,结束后沸水浴灭酶10 min。取500 μL反应液加入500 μL乙腈10 000 r/min离心10 min后过膜,采用HPLC对γ-CD含量进行测定。测定方法与2.3.2中相同。
取最适底物,分别配制质量分数为1%、3%、5%、7%的溶液,加热糊化后冷却到室温,取1 mL底物加入适量CGTase,置于恒温震荡混匀器上反应24 h,结束后沸水浴灭酶10 min,取500 μL反应液加入 500 μL乙腈 10 000 r/min离心 10 min后过膜,采用HPLC对γ-CD含量进行测定。测定方法与2.3.3中相同。
选取最佳底物配制成最佳质量分数的溶液,加热糊化后冷却到室温,取1 mL底物分别加入2、4、6、8、10 U/g的CGTase,置于恒温震荡混匀器上反应24 h,结束后沸水浴灭酶10 min,取500 μL反应液加入 500 μL乙腈 10 000 r/min离心 10 min后过膜,采用HPLC对γ-CD含量进行测定,测定方法与2.3.3中相同。
2)正交设计实验 在单因素实验的基础上选取底物质量分数、加酶量、反应时间3个因素,进行正交实验,选用正交表L9(33)对CGTase的催化淀粉分解条件进行优化,实验结果采用Minitab16软件进行分析。
2 结果与讨论
2.1 突变体的验证
用DNAman对目的基因碱基序列和突变后的碱基序列进行比对,发现目的基因中的酪氨酸Y(TAT)成功突变成了亮氨酸 L(CTT),结果见图 1。
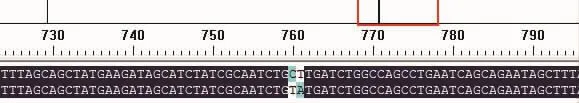
图1 突变前后基因的碱基序列比对图Fig.1 Base sequence alignment for the gene before and after mutation
2.2 γ-CGTase(Y211L)催化淀粉条件探索
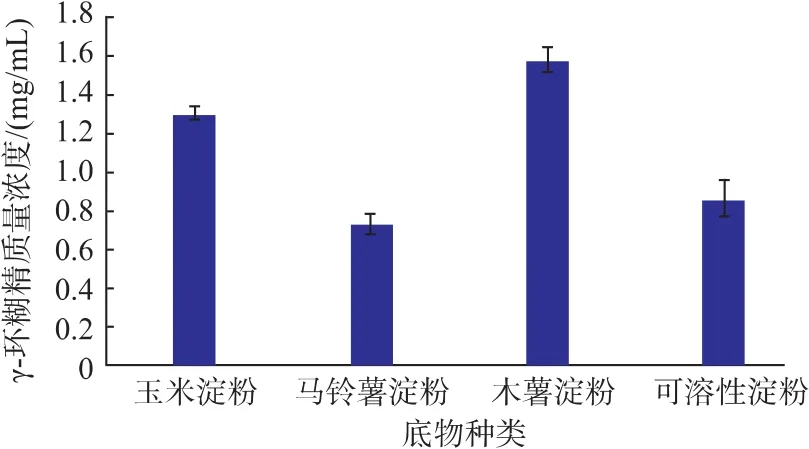
2.2.1 底物种类对催化反应的影响 由图2可知,γ-CGTase(Y211L)催化淀粉的反应中,不同的反应底物对γ-CD的得率影响较大。其中木薯淀粉为底物时γ-CD的得率最高,马铃薯淀粉和可溶性淀粉为底物时γ-CD的得率较小。推测其原因是,不同来源的淀粉其直链淀粉/支链淀粉的比例不同,且分子量大小存在很大差异,这将影响γ-CGTase(Y211L)催化作用,进而造成不同的环糊精产率。
2.2.2 底物质量分数对催化反应的影响 由图3可知,随着底物质量分数的增加,γ-CGTase(Y211L)催化淀粉产生γ-CD的质量浓度先增加后减少,质量分数为5%时γ-CD的质量浓度达到最大,推测原因可能是由于低浓度时,酶催化反应较彻底,体系中小分子浓度较高,加剧了CGTase的偶合和环化作用,造成了较低的环糊精含量,随着底物质量分数的升高,反应向环化方向偏移,但底物质量分数过高时,造成两个或两个以上的底物分子占据酶蛋白的活性位点,这可能会形成无活性的中间产物,使酶活性受到抑制。而且,底物质量分数过高,体系黏度较大,底物流动性减小,使酶无法与底物充分接触,减弱 γ-CGTase(Y211L)的环化作用。
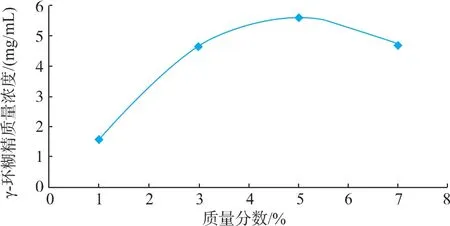
图3 底物质量分数对催化反应的影响Fig.3 Effect of substrate concentration on catalysis
2.2.3 加酶量对催化反应的影响 如图4可知,CGTase催化淀粉反应随加酶量的增加γ-CD的产量先增加后减少,在4 U/g时γ-CD的产量最大,因此加酶量选取4 U/g。
γ-CD产量随加酶量先增加后减少,可能是由于加酶量过少时,反应缓慢;加酶量过高时,酶催化反应较彻底,环糊精降解,体系中小分子浓度较高。
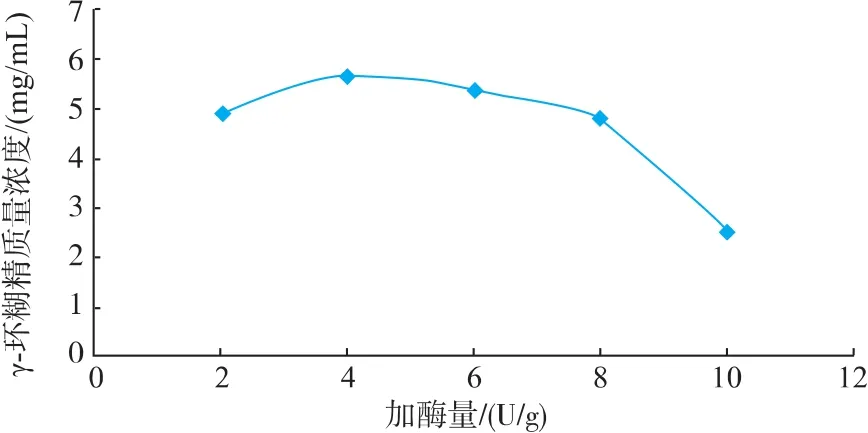
图4 加酶量对催化反应的影响Fig.4 Effect of enzyme concentration on catalysis
2.2.4 反应时间对催化反应的影响 如图5可知,γ-CGTase(Y211L)催化淀粉反应随反应时间的增加γ-CD的产量不断增加,在24 h之前增加较快,24 h之后增加缓慢。出现这种现象可能是由于,在反应开始阶段,体系中长链底物较多,利于环化反应进行,因此γ-CD的产量增加较快。但随着反应时间的延长,体系中产物不断增加,竞争性产物抑制作用加强,环化反应活性降低;同时,可能由于小分子浓度的增加,促进了CGTase的偶合和歧化作用,因而导致反应速率下降。
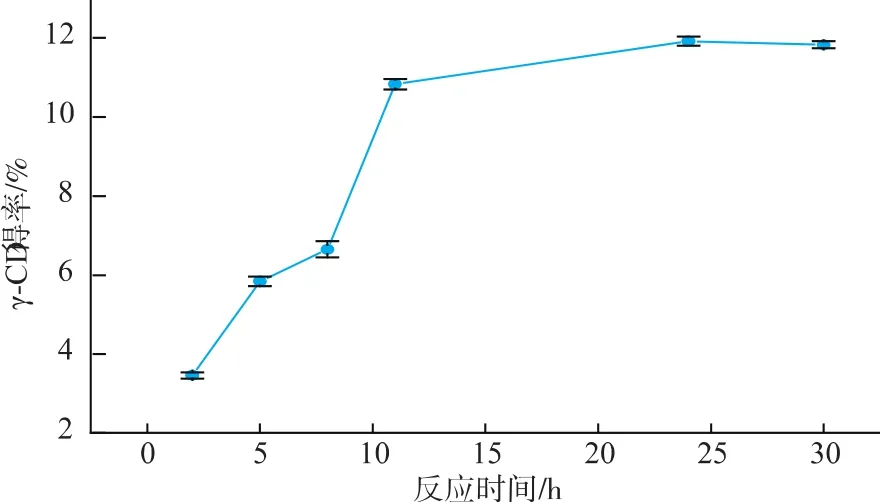
图5 反应时间对催化反应的影响Fig.5 Effect of time on catalysis
2.3 γ-CGTase(Y211L)催化淀粉条件优化
以单因素探索的底物质量分数、加酶量、反应时间这3个因素对γ-CD产率的影响为依据,进行3因素、3水平的正交实验设计,因素水平表如表1所示,正交实验结果如表2所示。
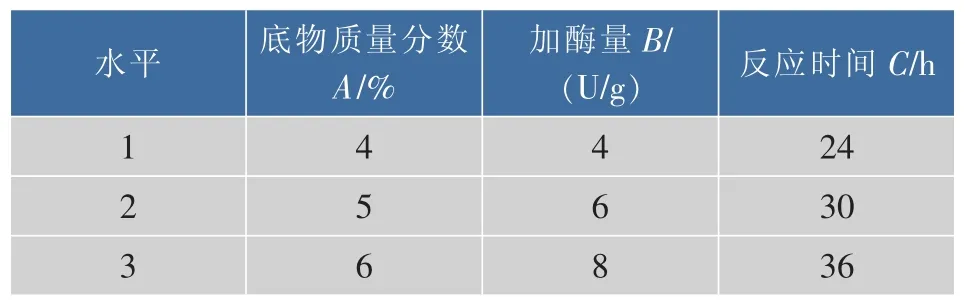
表1 因素水平表Table 1 Factor level table
由表2可知,CGTase催化淀粉分解的最佳参数为A3B1C1,因素对试验结果的影响顺序为A>B>C,所以CGTase催化淀粉分解的最佳条件为:反应底物木薯淀粉,质量分数6%,加酶量4 U/g,反应时间24 h,反应温度50℃。
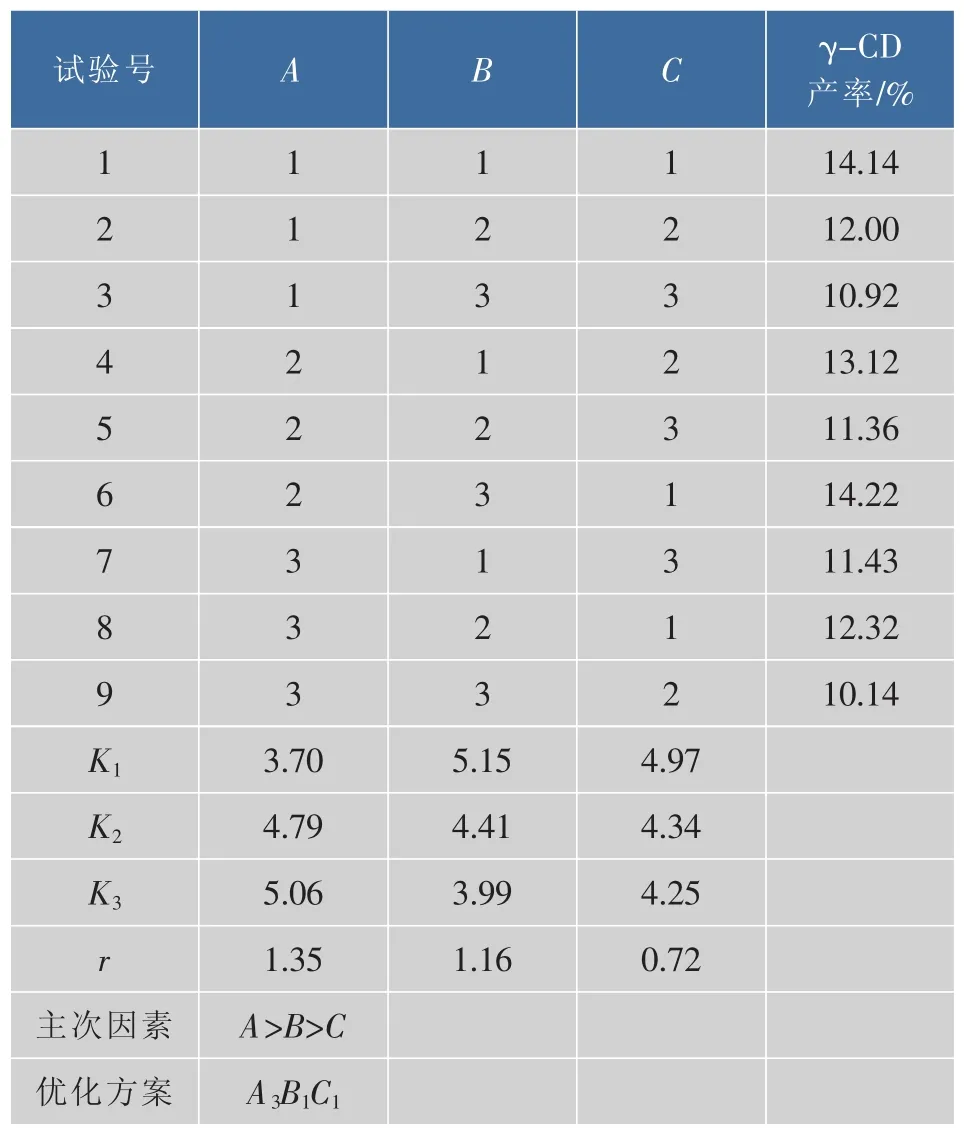
表2 正交结果和分析Table 2 Results and analysis of orthogonal
2.4 γ-CGTase(Y211L)催化淀粉产物的分析
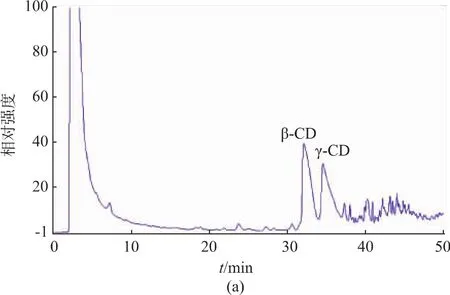
在同样的催化条件下,原始的γ-CGTase催化淀粉后产物的HPAEC测定图如图6(a)所示,突变体Y211L的催化产物图如图6(b)所示,由图可以看出,突变体Y211L催化生成的环糊精中γ-CD明显提高,表明突变体具有良好的催化专一性,该研究能为γ-CD的工业化生产提供参考。
3 结 语
γ-CGTase(Y211L)是一种多功能酶,它能够通过环化反应催化淀粉转化为环糊精。目前对于CGTase催化淀粉产物的研究主要集中于产α-CD、β-CD,对γ-CD的研究较少。但是γ-CD具有较高的溶解性,同时其空腔也较大,具有较好的应用前景。作者构建了γ-CGTase突变体Y211L,从单因素实验、正交实验进行了制备γ-CD的条件优化,在适当的反应条件下提高了γ-CD的产量,对以后γ-CD产量的提高及其应用具有一定参考价值。

