以甘油为底物发酵生产新型黄原胶
王子朝, 朱 莉, 吴剑荣, 郑志永, 高敏杰, 詹晓北*
(1.江南大学 生物工程学院,江苏 无锡 214122;2.无锡格莱克斯生物科技有限公司,江苏 无锡214125)
黄原胶的安全性已得到FDA和WHO认可。同时,黄原胶良好的稳定性、乳化性、悬浮性、增稠性和假塑性使其在食品、医药、日用化工、纺织和石油开采等领域得到广泛应用[1-6]。黄原胶生产一般采用价格低廉的玉米淀粉作碳源,实验室规模生产和研究也可用蔗糖和葡萄糖。随着粮食价格不断攀升和全球人口不断增加,国内外许多学者都在研究采用一些工农业产品副产物来代替玉米淀粉实现黄原胶工业生产,如木糖、甘蔗糖浆、甜菜糖浆、乳清和脂肪酸等[7]。如果微生物可以利用甘油实现黄原胶工业生产,不仅可以缓解生物柴油副产物过剩和全球粮食短缺双重危机,还可以降低黄原胶生产成本。作者采用驯化得到了一株可以利用甘油发酵生产黄原胶的野油菜黄单胞菌突变株,其生产的黄原胶与商品黄原胶相比,具有粘度低、透明性高、水化速率快和反复冻融处理后粘度增大的特点。
1 材料与方法
1.1 菌株和培养基组成
X.campestris NRRL B-1459:购于中国工业微生物菌种保藏管理中心。X.campestris WXLB-006经驯化得到并保藏于本研究室。
X.campestris NRRL B-1459种子培养基组成(g/L):蔗糖 20.0,鱼粉蛋白胨 5.0,牛肉浸膏 3.0,酵母浸膏 1.0,pH 7.0。
X.campestris WXLB-006种子培养基与X.campestris NRRL B-1459基本一致,用100 g/L甘油替代蔗糖。
驯化培养基:驯化培养基初始组成为X.campestris NRRL B-1459种子培养基。随着驯化过程进行,甘油质量浓度逐渐增加,蔗糖质量浓度逐渐降低,培养基中其它成分不变。
平板筛选培养基是在驯化培养基基础上添加20 g/L琼脂。
分批发酵培养基(g/L):蔗糖 40(或甘油 100),鱼粉蛋白胨 1.5, 酵母浸膏 1.0,NaNO31.0,NH4Cl 1.0,MgSO42.5,FeSO4·7H2O 0.01,K2HPO43.5,KH2PO42.0,pH 7.0。
补料发酵培养基(g/L):甘油 40,其余成分与分批发酵培养基相同。
1.2 培养条件
1.2.1 种子培养 500 mL三角瓶装液量50 mL,培养温度30℃,摇床转速200 r/min。
1.2.2 分批发酵 500 mL三角瓶装液量50 mL,培养温度30℃,接种体积分数10%,摇床转速200 r/min。
1.2.3 补料发酵 7 L发酵罐(LiFlus GM BioTRON公司产品)装液量3 L,接种体积分数10%,培养温度30℃,发酵过程中用3 mol/L KOH和3 mol/L HCl调节pH维持在7.0。发酵0~24 h,通气量0.5 vvm,搅拌转速 200 r/min;24~60 h,通气量 1.0 vvm,搅拌转速400 r/min。 甘油流加策略:24~34 h,3 g/L/h;34~44 h,2 g/L/h;44~54 h,1 g/L/h。
1.3 材料与试剂
商品黄原胶(食品级):购于山东淄博中轩生化有限公司;蔗糖、HCl、KOH、鱼粉蛋白胨和 NaNO3等试剂:购于国药集团化学试剂有限公司;Trizol RNA提取试剂盒和第一条链cDNA合成试剂盒等:购于生工生物工程(上海)有限公司。
1.4 驯化过程
将X.campestris NRRL B-1459培养在种子培养基中,当菌体生长进入对数期,按体积分数10%接种量接入含有15 g/L蔗糖和5 g/L甘油种子培养基中,然后按同样接种量在此培养基中连续传代10次后,取1 mL对数生长期种子液适当稀释后涂布到相应含有15 g/L蔗糖和5 g/L甘油平板筛选培养基上,30℃恒温培养箱中培养。待菌体长出来之后,挑取大、透明且凸起的单菌落接种到含有10 g/L蔗糖和10 g/L甘油种子培养基中进行下一轮驯化、筛选。在接下来连续驯化和筛选过程中,蔗糖质量浓度逐渐降为0 g/L,而甘油质量浓度则逐渐增加至100 g/L。
1.5 多糖样品的提取与纯化
发酵结束后,向发酵液中加入3倍体积去离子水进行稀释,然后20 000 g离心30 min除菌体。向离心得到的上清中加入3倍体积无水乙醇沉淀多糖,40℃、0.1 MPa下干燥48 h得到多糖样品。
1.6 分析方法
紫外可见分光光度计于600 nm下测量菌悬液吸光度并折算为菌体干质量;蔗糖和甘油浓度测定采用高效液相色谱法;多糖用2 mol/L三氟乙酸水解后采用Dionex离子色谱仪进行单糖组分测定;多糖样品与溴化钾充分研磨压片后,采用Nexus 470红外光谱仪在400~4000 cm-1内对多糖进行红外扫描;用Agilent 800 MHz核磁共振仪对多糖进行核磁分析,以D2O作内标物;采用高效体积排阻色谱测定多糖相对分子质量;采用安东帕Physica MCR301高级旋转流变仪测量1.0 g/dL多糖溶液流变学特性,测量温度25℃[8]。
1.7 RT-PCR分析
将生长进入指数后期的X.campestris NRRL B-1459和X.campestrisWXLB-006用去离子水洗涤并离心收集,然后采用Trizol RNA试剂盒提取总RNA,并用第一条链cDNA合成试剂盒合成第一条链的cDNA,按试剂盒操作方法进行提取和合成。以16s rRNA作为内参基因且每个样品的RT-PCR过程均重复3次,最终实验结果为3次结果平均值。PCR扩增采用40个循环,每个循环依次为:94℃30 s、51 ℃ 30 s、72 ℃ 30 s;40个循环之后 72 ℃处理10 min以终止反应并建立PCR产物溶解曲线。采用LightCycler(version 3.3)软件分析计算目的基因相对表达量。根据NCBI中X.campestris ATCC 33913基因序列,使用Premier 5.0软件设计目的基因上下游引物用于RT-PCR,引物序列见表1,并由生工生物工程(上海)有限公司合成引物。

表1 RT-PCR引物和引物序列Table 1 Primers and relevant sequences used for RT-PCR
1.8 黄原胶的水化速率测定
两种黄原胶样品分别加入去离子水、pH 5.5水溶液、质量分数1.0%NaCl溶液和1.0%蔗糖溶液中测量其在不同溶液中水化速率,黄原胶样品一次性加入并使其质量分数为1.0%。磁力搅拌上25℃、300 r/min搅拌溶解。溶解过程中固定时间间隔用Brookfield DV-II粘度计25℃、3号转子、6 r/min测量各溶液粘度。
1.9 反复冻融对胶溶液粘度的影响
质量分数1.0%新型黄原胶和商品黄原胶溶液在-20℃冰箱中保存24 h,然后于室温下放置24 h。重复此冻融过程5次,每次均用Brookfield DV-II粘度计25℃、3号转子、6 r/min测定各溶液粘度。
1.10 透射电子显微镜观察
将-20℃冻融处理前后的新型黄原胶溶液采用日立H-7650透射电子扫描显微镜进行观察。
2 结果与讨论
2.1 X.campestris NRRL B-1459和X.campestris WXLB-006发酵性能对比
通过基因改造可以提高目标产物产量,但转基因技术的潜在危害一直受到人们质疑,尤其在食品领域[9]。驯化是以达尔文进化论为基础的自然选择过程,其安全性相对较高[10]。驯化得到的突变株X.campestris WXLB-006,其菌体生长时间(24 h)、发酵周期 (60 h)、 生物量 (1.65 g/L) 和黄原胶产量(23.5 g/L)与原始菌株X.campestris NRRL B-1459基本一样(图 1(a)和(b))。 驯化效果可以从图 1(c)和(d)看出,X.campestris NRRL B-1459 不能在 100 g/L甘油培养基中生长;而X.campestris WXLB-006可以利用100 g/L甘油生长并合成黄原胶,且摇瓶中黄原胶产量达到17.8 g/L。
许多学者通过驯化得到了类似结果,Kalogiannis等[11]采用200 g/L甜菜糖蜜对X.campestris ATCC 1395驯化5轮后使黄原胶产量达到40.5 g/L。Wang et al.[12]在含有醋酸培养基上对Aureobasidium pullulans CCTCC M2012259连续驯化20轮之后,分离得到一株突变株A.pullulans ARH-1。与原始菌株相比,突变株利用稻壳水解液发酵生产普鲁兰多糖的产量由15.6 g/L增加到22.2 g/L,发酵周期由60 h缩短至48 h。
2.2 黄原胶性能对比
通过单糖组成分析发现,新型黄原胶中只含有葡萄糖、甘露糖和葡萄糖醛酸,且3种单糖摩尔比为葡萄糖:甘露糖:葡糖糖醛酸=2.0:1.63:1.0,这与商品黄原胶比较相近(2.0:1.85:1.0)。 此外,新型黄原胶的红外和核磁共振图谱与商品黄原胶相吻合(图未给出),进一步说明其是黄原胶。这也与Sutherland[13]报道一致,即野油菜黄单胞菌只能产生黄原胶唯一一种胞外多糖。
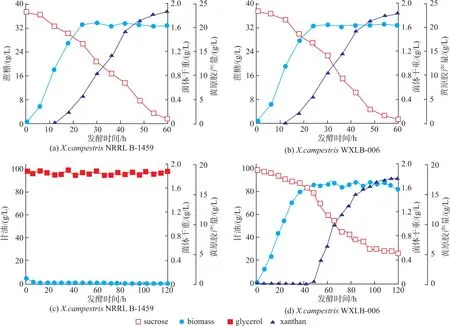
图1 X.campestris NRRL B-1459和X.campestris WXLB-006利用40 g/L蔗糖和100 g/L甘油摇瓶发酵结果Fig.1 Flask culture profiles of X.campestris NRRL B-1459 and X.campestris WXLB-006 with 40 g/L sucrose and 100 g/L glycerol as carbon sources
新型黄原胶相对分子质量(3.0×106)仅为商品黄原胶(5.8×106)一半左右,且其水溶液粘度低于商品黄原胶。低粘度黄原胶在食品和医药等领域比较受欢迎,虽然可以采用物理、化学或者酶等方法降低黄原胶粘度[14],但是通过发酵直接得到这一低粘度黄原胶,不仅可以省去黄原胶在处理过程中能耗,还可以提高产品安全性。
2.3 RT-PCR
通过RT-PCR对两株菌中甘油代谢相关基因相 对转录水平 分 析 发 现 (图 2),X.campestris WXLB-006中甘油通道蛋白、甘油激酶、甘油-3-磷酸脱氢酶和果糖-1,6-二磷酸醛缩酶基因的相对表达量均高于原始菌株,依次为:glpD (8.53)>glpF(7.64) > glpK (6.61) > fbp (5.79), 说 明 X.campestris WXLB-006可以利用甘油生长并合成黄原胶的原因与其体内甘油代谢相关基因的激活有关。图1(d)中甘油做碳源时黄原胶产量(17.8 g/L)、底物转化率(25%)和发酵周期(120 h)均不如以蔗糖做碳源时发酵结果(图 1(a)和(b))。 合成黄原胶的前体物质是六碳单元(UDP-葡萄糖,GDP-甘露糖和UDP-葡萄糖醛酸),蔗糖主要通过ED途径为黄原胶合成提供前体物质[5],而甘油在合成黄原胶前体物质时糖异生是必经途径[15],这可能是导致甘油做碳源时黄原胶产量和底物转化率均较低的原因。其他学者在以甘油为碳源进行不同产物发酵生产时遇到了同样发酵周期长和底物转化率低的问题[16-17]。
2.4 补料发酵
X.campestris WXLB-006可以利用甘油发酵生产一种新型黄原胶,但发酵周期长和底物转化率低限制了其工业应用。高搅拌转速引起的剪切力会对菌体造成机械损伤[18-19];同时,高底物质量浓度不仅抑制野油菜黄单胞菌生长[20],还会造成碳溢流[21]。所以,作者选择初始甘油质量浓度40 g/L,甘油流加策略为:24~34 h,3 g/L/h;34~44 h,2 g/L/h;44~54 h,1 g/L/h。在菌体生长阶段 (0~24 h)采用0.5 vvm和200 r/min,24~60 h 采用 1.0 vvm 和 400 r/min。
由图3可以看出,菌体生长阶段采用低通气量和低搅拌转速,X.campestris WXLB-006生物量由1.65 g/L增加到1.94 g/L,生物量的提高可以增加黄原胶产量。黄原胶合成属于GadenⅡ型,即菌体进入稳定期之后开始合成黄原胶,但随着黄原胶合成并在发酵液中积累,发酵液的传氧和传质受到限制。因此,发酵中后期采用高通气量和高搅拌转速提高发酵体系的传氧和传质可以提高黄原胶产量。同时,变速流加甘油策略可以减少碳溢流而进一步提高黄原胶产量。通过以上策略,黄原胶产量由17.8 g/L提高到33.9 g/L,发酵周期由120 h缩短至60 h(图3)。发酵前期低通气量和低搅拌转速还可以降低由高通气量和高搅拌转速所引起的泡沫而导致的染菌率。
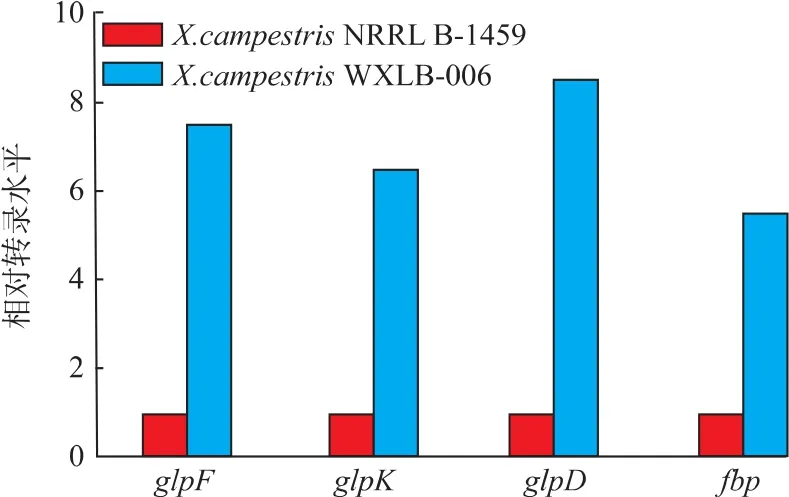
图2 两株菌中甘油代谢途径相关基因的相对转率水平Fig.2 Relative transcription level of glycerol metabolism related genes in two strains
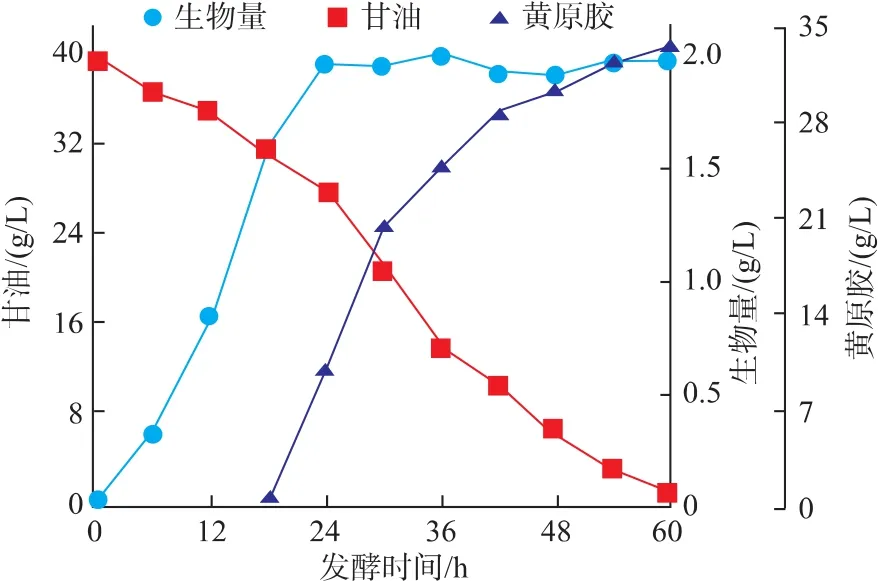
图3 X.campestris WXLB-006采用变通气量和变搅拌转速补料发酵结果Fig.3 Time courses of X.campestris WXLB-006 with variable aeration rate and stirring speed in fedbatch fermentation
2.5 水化速率
当前,黄原胶以其在质量分数1.0%KCl溶液中粘度进行分级,但这种分级方法忽视了黄原胶的一些实际应用(如透明性和水化速率)。商品黄原胶在去离子水中搅拌溶解60 min后达到其饱和粘度(图 4(a)),而新型黄原胶仅需 20 min(图 4(b)),这一时间为商品黄原胶三分之一。
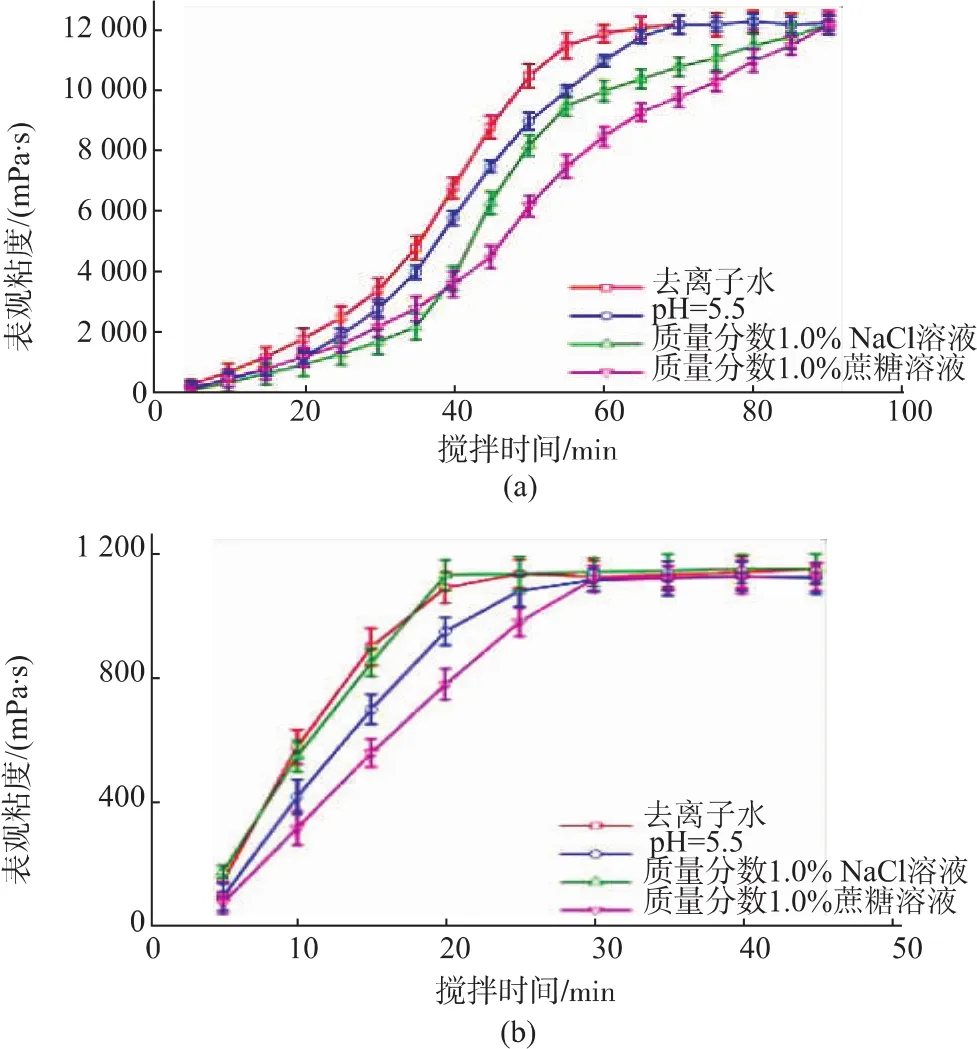
图4 商品黄原胶和新型黄原胶水化速率Fig.4 Hydration rate of commercial xanthan and new xanthan
虽然蔗糖、NaCl和弱酸对两种黄原胶的水化时间均有延长 (商品黄原胶从60 min增加到90 min;新型黄原胶从20 min增加到30 min),但是新型黄原胶的水化速率仍快于商品黄原胶。新型黄原胶快速水化的特性,不仅可以减少在搅拌溶解过程中空气的裹入,还可以降低搅拌设备投入,将其应用到速溶类食品中效果极佳。
2.6 反复冻融
很多食品都会选择添加一定量增稠剂、乳化剂或稳定剂等,这些食品在食用之前会因其中添加成分在冷冻条件下流变学性质的改变而发生形变,进而影响其外形和口感[22]。图5(a)中,商品黄原胶粘度几乎不受-20℃反复冻融影响,始终维持在11 500 mPa·s左右;但新型黄原胶粘度随冻融次数增加而逐渐增大,从初始 1 100 mPa·s增大到 1 850 mPa·s,且冻融处理3次以后,粘度基本稳定在1 850 mPa·s。
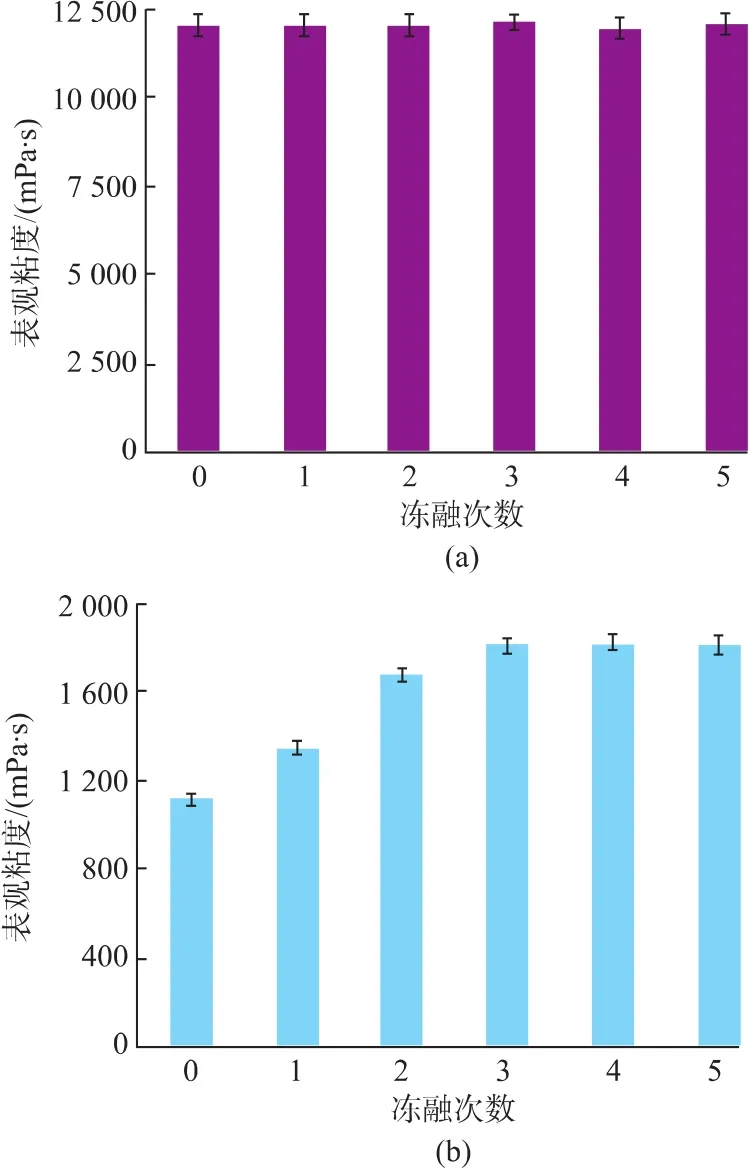
图5 冷冻对商品黄原胶和新型黄原胶粘度影响Fig.5 Refrigerated storage on the viscosity of commercial and new xanthan
通过透射电镜对冻融前后新型黄原胶溶液观察发现(图6),反复冻融使新型黄原胶在溶液中发生聚集,具体原因还有待进一步研究。新型黄原胶溶液冻融处理后粘度增大的特性使其应用到食品中意义重大。首先,复配使用时可以弥补其它增稠剂在冻融处理中粘度降低的不足,维持产品形态;其次,可以减少肉制品在冻融过程中肉汁流失,提高肉制品色泽和品质;最后,在冷链运输过程中,可以减少冰晶对产品结构破坏,提高产品品质并延长货架期[23]。
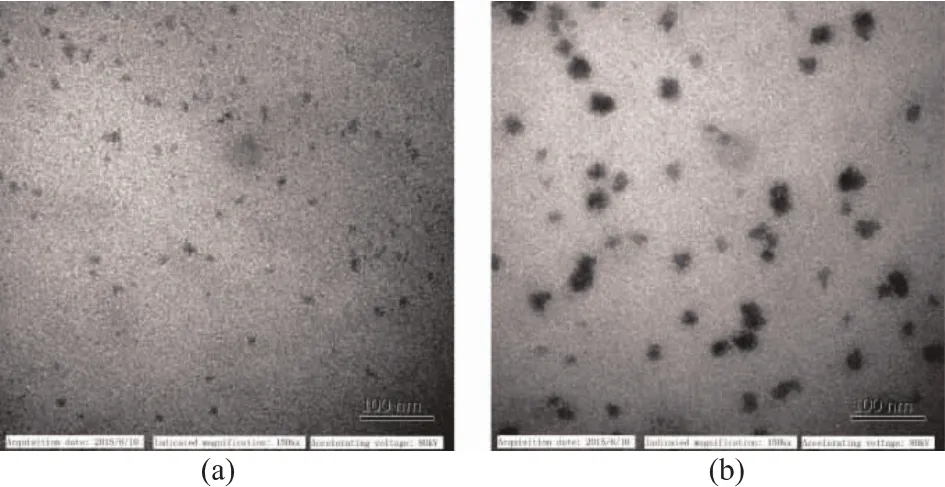
图6 冻融前后新型黄原胶溶液透射电镜图Fig.6 TEM images of new xanthan solutions before and after freeze-thaw
3 结 语
通过驯化得到了一株可以利用甘油发酵生产黄原胶的野油菜黄单胞菌突变株。RT-PCR结果显示突变株中甘油代谢相关基因的相对表达量均明显高于出发菌株。采用不同发酵策略使黄原胶产量达到33.9 g/L,发酵周期缩短至60 h,且发酵得到的黄原胶具有粘度低、透明性高、水化速率快和冻融处理后粘度增大的特性。

