海马齿状回区多巴胺D1受体在大鼠主动回避学习中的作用及其机制
王玮瑶, 张 岩 ,赵 可 ,孙传博,金清华
( 1. 延边大学医学院生理学与病理生理学教研室,吉林 延吉 133002;2. 吉林医药学院病理学教研室,吉林 吉林 132021)
哺乳动物的海马可参与包括学习和记忆过程在内的多种高级脑功能。研究[1-2]显示:海马参与不同种类的学习与记忆形成过程,如空间学习、物体识别和厌恶性动机学习等,尤其在各种回避性学习中海马是必不可少的。海马主要由CA1~CA3和齿状回(dentate gyrus,DG)构成,每个亚区在学习记忆中有不同的作用,而DG区作为新信息进入海马的传入点在海马的学习记忆功能中起关键作用。突触效应的长时程增强(long-term potentiation,LTP)是中枢神经系统中突触可塑性的典型表现,是海马依赖性学习过程的重要神经生理学机制[3-4],而将学习记忆中出现的、与学习记忆能力间存在平行关系的LTP样变化称之为“习得性LTP”(learning-dependent LTP,LD-LTP)。在产生和维持海马LTP的过程中,谷氨酸(glutamate,Glu)及其受体是主要的突触传递承担者[5],同时,海马LTP也受几种脑干上行神经递质系统的调节,其中包括来自中脑的多巴胺(dopamine,DA)系统[6]。DA是中枢神经系统中重要的单胺类神经递质,参与调节运动控制、认知、情感、摄食和内分泌等多种生理功能,脑内DA还在恐怖记忆等多种记忆形成过程中也起着重要的调节作用[7-8]。DA通过其膜受体发挥作用,目前已分离出的DA受体有5种,即D1~D5受体。研究[6]显示:海马DG区有DA能神经元的分布和D1受体的表达,而且DG区的D1受体可调节颗粒细胞的突触可塑性,但是海马DG区的DA及其D1受体在大鼠主动回避学习中的作用少有报道。因此,本实验在大鼠主动回避条件反射的建立以及消退过程中,观察大鼠海马DG区细胞外液中DA水平变化,并结合向DG区微量注射D1受体阻断剂,观察DA水平对主动回避学习记忆中DG区Glu释放和突触传递效应的影响,进一步探讨海马DG区DA及其D1受体在大鼠主动回避学习中的作用及其机制。
1 材料与方法
1.1 实验动物、主要试剂和仪器 选择处于成年阶段的SD雄性大鼠24只,体质量(200±20)g。实验所选用的大鼠由延边大学实验动物中心提供,许可证号:SCXK (吉) 2017-0003。水合氯醛(天津市大茂供应站),邻苯二甲醛、SCH-23390(D1受体阻断剂)、L-谷氨酸和DA(美国Sigma公司)。8R-6型脑立体定位仪(日本成茂公司),HTEC-300型生物活性物质微量分析系统和EFC-82型自动样本收集器(日本Eicom公司),交流放大器(英国Neurolog公司),Micro3型信号转化器(英国CED公司),穿梭箱(上海移数科技有限公司)。
1.2 实验动物分组和处理 将大鼠随机分为非训练组、训练组、对照组和SCH组,每组6只。非训练组大鼠只放入穿梭箱内不进行训练,训练组大鼠每天在固定时间段进行穿梭箱训练,每天训练结束后检测大鼠海马DG区细胞外液中DA水平。对照组和SCH组大鼠每天进行穿梭箱训练前,分别向2组大鼠海马DG区注射1 μL生理盐水或D1受体阻断剂SCH-23390,观察大鼠的主动回避反应率、DG区Glu水平和场兴奋性突触后电位(fEPSP)幅值的变化。
1.3 大鼠海马定位和透析探针的植入 大鼠腹腔注射10%水合氯醛(300 mg·kg-1)进行麻醉,待大鼠深度麻醉后取腹卧位固定于定位仪上,常规消毒后,切开头皮,根据Paxinos和Watson图谱,将微量透析探针的外套管垂直地插入大鼠右侧海马DG区上方1 mm处,定位坐标为前囟后(AP)3.2 mm、中缝线右旁开(R)1.6 mm、硬脑膜下深度(H)2.5 mm。因为对照组和SCH组大鼠除了行为学训练和微量透析以外还需测定突触可塑性指标—fEPSP幅值,因此埋植微量透析探针外套管的同时,在相同部位插入记录电极,并在同侧穿通纤维(perforant path,PP)处插入刺激电极。记录电极的定位坐标为AP 3.2 mm、R 2.0 mm、 H 3.5 mm,刺激电极定位坐标为 AP 6.9 mm、R 5.0 mm、H 4.5~5.0 mm。外套管和2种电极采用牙托粉固定,隔天经外套管将微量透析探针插入海马DG区并采用蜡封固。微量透析探针前端为1 mm长的半透膜(内径0.20 mm,外径0.22 mm,日本Eicom公司),侧面粘合微量注射用细管。
1.4 大鼠主动回避反应率的测定 采用穿梭箱对大鼠进行主动回避条件反射实验,包括条件反射建立和实验性消退两个部分。将大鼠放入穿梭箱后自由活动2 min使之适应实验环境,然后开始训练,训练时先给予声音刺激10 s,再给予电刺激15 s,间隔20 s后,重复上述操作,40次为一轮完整的训练。达到条件反射建立标准之后进行实验性消退实验,此时只给予声音刺激不给予电刺激。规定只有声音刺激出现时大鼠逃到对侧安全区而躲避了电刺激为1次主动回避反应,主动回避率达到65% 以上为条件反射建立标准,回降到35% 以下为条件反射消退标准。整个训练周期为1周。
1.5 DG区微量透析样本采集和微量注射 非训练组和训练组大鼠在每天的穿梭箱实验结束后,其微量透析探针连接微量泵,以1.5 μL·min-1的速度向大鼠海马DG区灌流改良林格尔液,30 min后采用自动样本收集器收集DG区细胞外液的微量透析样本,每管收集10 min,每次收集3个管。对照组和SCH组大鼠在每天进行穿梭箱训练之前,经微量注射用细管向海马DG区注射1 μL相应药物,微量注射速度为0.5 μL·min-1,注射药物包括生理盐水(对照组)或SCH-23390(SCH组,1 g·L-1),注入时程为2 min,滞留1 min后将细管与探针分离,给药结束后30 min开始进行穿梭箱训练,训练结束后收集大鼠DG区细胞外液的微量透析样本,收集方法与训练组相同。
1.6 大鼠DG区细胞外液中DA和Glu水平检测[2]DA水平检测:将12 μL微量透析样本注入到生物活性物质微量分析系统中,样本以0.23 mL·min-1的速度流经系统中的高效液相色谱分离柱和电化学检测器,检测大鼠DG区细胞外液中DA水平(单位:μg·L-1)。Glu水平检测:将12 μL微量透析样本与3 μL、 4 mmol·L-1邻苯二甲醛溶液混合均匀,常温下反应2.5 min后抽取10 μL反应液注入到生物活性物质微量分析系统中,经高效液相色谱分离柱和电化学检测器测定各样本中Glu水平(单位:mmol·L-1)。主动回避学习过程中大鼠训练前各自的基础DG区DA及Glu水平定义为100%,计算大鼠每天训练后DG区DA和Glu水平(以百分率表示)。
1.7 大鼠海马DG区fEPSP幅值的测定[9]大鼠海马DG区突触传递效应用fEPSP幅值表示,fEPSP幅值增加提示LTP形成。测定方法:通过灵活的刺激隔离器发出单个方波脉冲电刺激(0.1 ms/phase,强度为引起最大fEPSP效应的刺激强度的1/3,间隔30 s)作用到PP,诱发出的反应由交流放大器进行过滤(0.5~2.0 kHz)和放大,将电信号数字化,采用Spick2软件记录15个连续的波痕后进行统计学分析。以主动回避训练前fEPSP幅值的基础水平为100%,计算大鼠每天训练后的fEPSP幅值(以百分率表示)。

2 结 果
2.1 主动回避学习中大鼠海马DG区DA水平 训练组和非训练组大鼠海马DG区细胞外液微量透析样本中DA基础水平分别为(0.46±0.08)和(0.41±0.01)μg·L-1,组间比较差异无统计学意义(P>0.05)。在主动回避反应训练中,训练组大鼠主动回避反应率随训练天数的增加而升高,在训练第5天达到条件反射的建立标准(68.05 %±2.02 %),随后进行实验性消退,在训练第7天达到消退标准(28.53 % ± 3.53 %)。训练组大鼠DG区细胞外液中DA水平随条件反射的建立逐渐升高,训练第5天时达到最大值,高于第1天时的DA水平(P<0.05),并随着消退实验回降到训练前水平。非训练组大鼠第2~7天海马DG区DA水平与第1天比较差异无统计学意义(P>0.05)。在穿梭箱训练第3~5天,训练组大鼠DG区DA水平明显高于非训练组,组间比较差异有统计学意义(P<0.05)。见表1。
表1 2组大鼠海马DG区DA水平
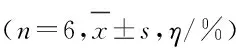

Group DA level (t/d) 1 2 3 4 5 6 7 Non-training 103.33±6.25 105.08±5.78 104.09±8.69 108.80±9.56 100.93±5.98 99.50±6.43 99.36±4.37 Training 102.14±16.20 140.13±21.67 489.24±91.67*△508.33±92.50*△547.58±60.88*△235.83±53.67 90.13±12.06
*P<0.05vsnon-training group;△P<0.05vs1 d.
2.2 主动回避学习过程中大鼠主动回避反应率 在主动回避反应训练中,对照组大鼠主动回避反应率随着训练天数的增加而升高,在训练第5天达到条件反射的建立标准;随后进行消退实验,在第7天达到消退标准。SCH组大鼠在主动回避反应训练过程中主动回避反应率有升高的趋势,但直到训练周期(共7 d)结束亦未能达到条件反射建立标准,提示阻断DG区D1受体可明显抑制主动回避学习过程。见表2。
表2 2组大鼠主动回避反应率
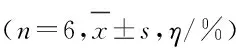
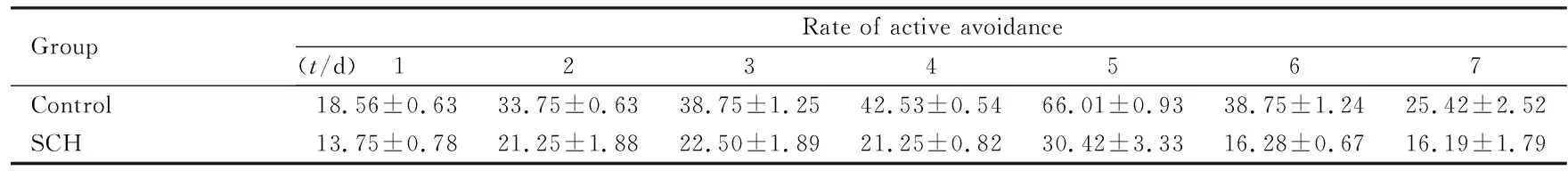
Group Rate of active avoidance (t/d) 1 2 3 4 5 6 7 Control 18.56±0.63 33.75±0.63 38.75±1.25 42.53±0.54 66.01±0.93 38.75±1.24 25.42±2.52 SCH 13.75±0.78 21.25±1.88 22.50±1.89 21.25±0.82 30.42±3.33 16.28±0.67 16.19±1.79
2.3 大鼠DG区Glu水平 在主动回避条件反射建立阶段,对照组大鼠DG区Glu水平随着训练天数的增加逐渐升高,第4和5天大鼠DG区Glu水平明显高于第1天(P<0.05);在随后的消退实验过程中Glu水平逐渐回降到训练前水平。SCH组大鼠海马DG区Glu水平在主动回避训练期间变化不明显,与对照组比较,在训练第5天SCH组大鼠DG区Glu水平明显降低(P<0.05)。见表3。
表3 2组大鼠海马DG区Glu水平
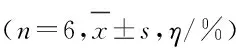
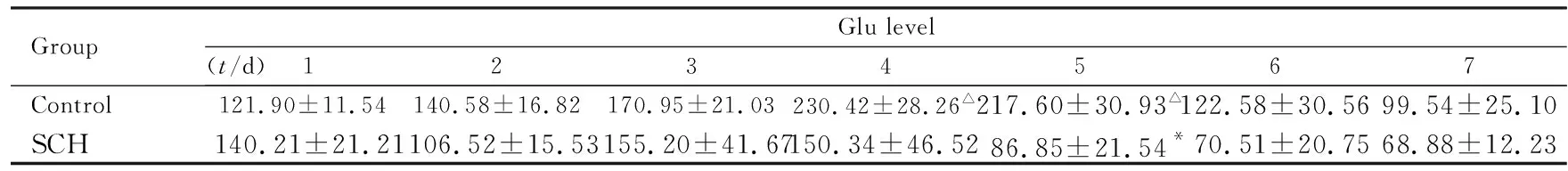
Group Glu level (t/d) 1 2 3 4 5 6 7 Control 121.90±11.54 140.58±16.82 170.95±21.03 230.42±28.26△ 217.60±30.93△ 122.58±30.56 99.54±25.10 SCH 140.21±21.21 106.52±15.53 155.20±41.67 150.34±46.52 86.85±21.54*70.51±20.75 68.88±12.23
*P<0.05vscontrol group;△P<0.05vs1 d.
2.4 大鼠DG区fEPSP幅值 在主动回避反应训练过程中,对照组大鼠DG区fEPSP幅值在条件反射建立阶段随着训练天数的增加逐渐变大,第5天达最大值,且高于第1天(P<0.05),并在随后的消退实验过程中逐渐降低。SCH组大鼠海马DG区fEPSP幅值在主动回避训练期间未出现明显变化,与第1天比较差异无统计学意义(P>0.05);而且在训练第3、5和6天,SCH组大鼠海马DG区fEPSP幅值明显低于对照组(P<0.05)。见表4。
表4 2组大鼠海马DG区fEPSP幅值
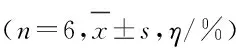

Group fEPSP amplitude (t/d) 1 2 3 4 5 6 7 Control 85.05±10.57 73.64±9.00 107.57±14.51 111.79±17.59 157.31±21.14△105.50±14.43 102.54±22.88 SCH 76.64±19.80 74.39±20.17 54.35±14.03*72.54±14.91 43.36±18.33*60.46±15.34* 60.58±11.99
*P<0.05vscontrol group;△P<0.05vs1 d.
3 讨 论
学习形成与记忆获得的过程主要发生在海马结构内[10],海马结构在细胞水平上分为CA1、CA2、CA3和DG区,其中DG区主要负责对新信息进行处理和编码[11]。DA是重要的中枢神经递质,参与运动、记忆、注意和奖赏等多种脑功能的调节。DA在脑内的神经传递依赖于两大类G蛋白偶联受体,即D1(D1和D5)和D2(D2~D4)家族受体,其对于腺苷酸环化酶(adenylate cyclase,AC)的作用是相反的。海马接收来自于黑质(substantia nigra,SN)和腹侧被盖区(ventral tegmental area,VTA)等处多巴胺能神经元的传入,研究[12-13]显示:活化VTA使得DA在海马内释放,对大鼠被动回避学习和海马突触可塑性起重要的调节作用;同时,如果VTA失活就会损伤LTP的维持[14]。作为突触传递效应的活性依赖性调节方式,LTP是中枢神经系统内突触可塑性的典型表现,也是海马学习记忆功能的重要生理学机制之一[3-4]。研究[15-16]显示:海马LTP在条件反射建立过程中出现,并在条件反射消退过程中消失,且其最高水平和完全消失发生在条件反射相关行为时,提示该类型LTP与学习有关联,即LD-LTP。虽然不少证据[13,17]表明:海马CA1区DA及其D1受体参与调节空间学习记忆和被动回避反应等多种学习记忆过程,且DG区观察到了D1受体的表达[18],但大鼠DG区DA及其D1受体是否参与主动回避学习目前尚不清楚。本实验中大鼠海马DG区DA水平和fEPSP幅值随着主动回避条件反射的建立逐渐增加,其后随条件反射消退而回降,提示海马DG区DA可能参与调节主动回避学习过程中的LD-LTP。
研究[19]显示:海马区的LTP(包括LD-LTP)的形成和维持由Glu及其促离子型受体所介导,而后者主要包括N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体和α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(α-amino-3-hydroxy-5-methyl-4- isoxazole-propionic acid,AMPA)受体。本课题组先前的研究[2,15]显示:海马DG内的Glu参与大鼠主动回避学习及相关LTP的产生过程。研究[20]显示:采用D1受体激动剂处理离体海马可增强NMDA和AMPA受体的磷酸化作用,进而使其介导的EPSP增强,而且在海马CA1区LTP的诱发需要D1受体与NMDA受体的共同激活[21]。 Kalivas等[22]发现:DA可以调节兴奋性氨基酸,即Glu的分泌,提示DG区内D1受体可能通过影响Glu的分泌来促进主动回避学习及其相关LTP的形成。阻断大鼠DG区D1受体可明显抑制主动回避学习以及该过程中Glu的释放和LD-LTP的产生[23]。本研究结果表明:大鼠DG区中的DA通过激活D1受体促进大鼠主动回避学习过程,并主要通过增加兴奋性氨基酸的兴奋传递来完成这一过程,但是Glu水平升高后是否通过NMDA受体和AMPA受体起作用,其受体激活的下游机制尚有待于进一步研究。

