聚丙交酯-乙交酯微球搭载鹿茸多肽联合骨髓间充质干细胞对大鼠坐骨神经损伤的修复作用及其机制
龚 庆,宋秋莹,邱莉晶,黄晓巍,赵文海
(1.长春中医药大学附属医院中医骨伤科,吉林 长春 130021;2.长春中医药大学中医学院耳鼻喉科,吉林 长春 130117;3.长春中医药大学药学院临床药学与药理教研室,吉林 长春 130117)
坐骨神经损伤是一种由外伤引起的临床常见病,可以造成患者严重残疾,影响患者的生活质量[1]。目前神经自体移植是外周神经损伤修复的最佳方法,然而也有其受限之处,即需要在不同的位置进行2次手术,除了供区神经功能丧失外,也会产生较为严重的并发症,因此寻找新的治疗方案十分必要[2-3]。鹿茸为吉林省名贵中药材,具有补肾壮阳、生精益血和补髓健骨之功效,鹿茸多肽(velvet antler peptide,VAP)是鹿茸的主要药效学物质[4-5]。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs)是一种具有自我复制能力和多向分化潜能的成体干细胞,可以向成骨、软骨、脂肪和其他类型细胞分化[6]。二者联合应用修复受损外周神经尚未见报道。内质网是真核细胞中重要的细胞器,参与调控蛋白质的合成。氧化应激、Ca2+紊乱和失衡等均可干扰内质网的正常运行,导致内质网应激的发生。内质网应激的适度激活有利于增强细胞的自我修复,增加细胞的存活率,若内质网应激激活过度或过长,则会引起细胞凋亡[7]。研究[8]表明:外周神经损伤的修复与内质网应激表达水平有关联。本研究观察聚丙交酯-乙交酯(polylactide-glycoli cacid,PLGA)微球搭载的VAP联合BMMSCs移植对大鼠坐骨神经损伤修复的影响,并阐明其与内质网应激的关系。
1 材料与方法
1.1 实验动物 健康Wistar大鼠60只,雄性,清洁级,体质量(180±10)g,购于吉林省长春市亿斯实验动物技术有限责任公司,动物许可证号码:SCXK(吉)-2016-0003。
1.2 细胞、药品、主要试剂和仪器 BMMSCs(中科院上海细胞库,货号:BNCC340947)。PLGA微球搭载的VAP(长春中医药大学制备),全蛋白提取试剂盒、BCA蛋白浓度测定试剂盒、ECL化学发光法检测试剂盒和HE染色试剂盒(北京索莱宝科技有限公司,货号:BC3711、PC0020、SW2010、G1120),蛋白质二硫键异构酶(protein disulfide isomerase,PDI)、葡萄糖调节蛋白78(glucoseregulated protein-78,GRP-78 )、 胱天蛋白酶12(Caspase-12)、GAPDH一抗和HRP二抗(博士德生物工程有限公司,货号:BM4904、PA1815、PA2103、A00227-1、BA1050)。凝胶成像仪(美国Aplegen公司,型号:OmegaLum C)。
1.3 模型制备、动物分组和给药方式 所有大鼠适应性喂养2周,给予充足的水和食物。60只大鼠随机分为4组,即坐骨神经横断对照组(对照组)、VAP微球组(VAP组)、BMMSCs移植组(BMC组)和VAP微球联合BMMSCs移植组(VAP-BMC组)。横断法[9]复制大鼠外周神经损伤模型,在无菌条件下,将各组大鼠右侧坐骨神经在靠近胫骨-腓骨分叉处横切,在无张力条件下采用9-0号可吸收神经缝合线以神经外膜缝合的方法对端缝合神经。神经吻合后,置于软组织中,采用4号可吸收线缝合伤口。造模7 d后给予药物治疗1次,在对照组大鼠横断坐骨神经区域注射1 mL PBS溶液,VAP组大鼠于相同位置注射1 mL含有15 mg载药PLGA微球的PBS溶液,BMC组大鼠于相同位置注射1 mL含有1×106个BMMSCs的PBS溶液,VAP-BMC组大鼠于相同位置注射1 mL含有15 mg载药PLGA微球和1×106个BMMSCs的PBS溶液。
1.4 各组大鼠神经功能评估 采用大鼠后肢运动功能的Basso、Beattie和Bresnahan(BBB)运动评级量表评估神经功能的恢复情况,根据BBB评估规则,观察4 min内各组大鼠的运动情况,当无自发运动和正常运动时,分别给出0和21的分数[10],达到14分时表示肢体可以支撑和四肢运动协调。在手术前记录1次BBB评分,以建立基线对照,手术后每周1次记录各组大鼠BBB评分以评价12周内各组大鼠外周神经的恢复情况。
1.5 组织标本制作和各组大鼠神经远近端坐骨神经轴突直径的测定 手术12周后腹腔注射5%的水合氯醛3 mL对大鼠实施安乐死,分离离断区域的神经组织并照相,取离坐骨神经离断点的近端和远端各5 mm内的神经组织置于10%的中性缓冲甲醛溶液中,将组织包埋于石蜡中,以5 μm的厚度进行切片用于组织学分析。对分离的神经组织进行HE染色,光学显微镜下观察各组大鼠坐骨神经横断面,采用CIAS-1自动图像分析仪测定各组大鼠神经远近端坐骨神经轴突直径。
1.6 Western blotting法检测各组大鼠坐骨神经组织中PDI、GRP-78和Caspase-12蛋白表达水平 将收集的坐骨神经组织经PBS清洗后,按照北京索莱宝提供的全蛋白提取试剂盒说明书提取各组大鼠坐骨神经总蛋白。采用BCA蛋白定量试剂盒对样品进行蛋白定量,调节蛋白浓度为2 g·L-1;将蛋白样品与等体积2×样品缓冲液混合,于100 ℃水浴5 min后即刻放入冰浴中冷却;将样品加入到放置好SDS-PAGE胶的加样孔内,每孔加样20 μL,280 mA恒定电流转膜60 min。转膜结束后,取出PVDF膜,采用TBST洗涤3次,每次5 min,之后将膜放入5%脱脂奶粉中,水平摇床,室温下封闭2 h。封闭结束后,将膜取出,TBST洗涤3次,每次5 min,向洗膜盒中加入相应的一抗(1∶1 000)稀释液,4℃储存,过夜。加HRP标记二抗(1∶2 000),水平摇床,室温封闭2 h。加入ECL发光液,室温孵育膜1 min。将膜正面朝上放到凝胶成像仪内,照相、记录结果。对电泳条带进行灰度值扫描,对各目的蛋白进行半定量分析。目的蛋白表达水平=目的条带灰度值/内参照灰度值。

2 结 果
2.1 各组大鼠BBB评分 各组大鼠在手术后1周表现出一定程度的功能缺陷。与对照组比较,各时间点VAP组、BMC组和VAP-BMC组大鼠BBB评分升高(P<0.01),即大鼠肢体运动情况明显改善,以VAP-BMC组大鼠BBB评分升高最明显。见图1和表1。

图1 不同时间各组大鼠BBB评分曲线
Fig.1 Curves of BBB scores of rats in various groups at different time points
2.2 各组大鼠坐骨神经形态表现和坐骨神经轴突直径 与对照组比较,VAP组和BMC组大鼠坐骨神经纤维更粗,轴突直径更长。见图2(插页三)。与对照组[(0.87±0.04) mm]比较,VAP组[(1.22±0.16) mm]、BMC组[(1.42±0.27) mm]和VAP-BMC组[(1.63±0.13) mm]大鼠轴突直径更长(P<0.01)。

表1 不同时间各组大鼠BBB评分


GroupBBB score(week) 12 3 4 5 6 Control5.10±0.145.11±0.265.22±0.185.26±0.165.91±0.516.31±0.28VAP7.05±0.16*7.09±0.18*7.69±0.45*7.97±0.27*8.21±0.22*8.40±0.25*BMC8.15±0.41*8.29±0.38*8.35±0.36*8.64±0.10*9.22±0.46*9.30±0.62*VAP-BMC8.52±0.36*8.82±0.51*9.03±0.45*9.97±0.26*10.23±0.54*10.60±0.50*GroupBBB score(week) 789101112 Control6.35±0.536.50±0.466.74±0.376.92±0.277.21±0.287.53±0.52VAP8.76±0.27*8.91±0.36*9.31±0.37*9.53±0.55*9.73±0.27*9.93±0.25*BMC9.48±0.18*9.69±0.35*9.83±0.20*10.32±0.50*10.53±0.46*10.73±0.62*VAP-BMC811.05±0.18*11.51±0.37*11.93±0.56*12.32±0.55*12.73±0.46*12.93±0.75*
*P<0.01 compared with control group.
2.3 各组大鼠坐骨神经组织中PDI、GRP-78和Caspase-12蛋白表达水平 与对照组比较,VAP组、BMC组和VAP-BMC组大鼠坐骨神经组织中PDI和Caspase-12蛋白表达水平明显降低(P<0.01),VAP-BMC组大鼠坐骨神经组织中GRP-78蛋白表达水平明显升高(P<0.01)。见图3和表2。
3 讨 论
外周神经损伤是一种临床常见的外伤性疾病,常规的手术移植治疗存在一定的弊端,寻找新的治疗手段已成为现代研究的热点[11]。鹿茸具有“补肾壮阳、生精益血、补髓健骨”的功效,用于肾阳不足、精血亏虚、阳痿滑精、腰脊冷痛和筋骨痿软等病症[12]。VAP是鹿茸的主要药效物质,现代研究[13-14]表明:其对外周神经损伤修复再生具有明显的促进作用,可以加快损伤神经变性坏死物质的清除,增加对神经再生物质的供给,加快轴浆的恢复,进而防止神经元坏死,促进神经损伤早期再生。有研究者[15-16]将VAP和PLGA制成复合膜结构,包裹损伤的神经,发现其可以加速神经的再生修复。但临床应用VAP时,面临其半衰期较短且易于被体内蛋白酶降解的困境。因此,本研究采用药物缓释载体(PLGA微球搭载VAP)来提高VAP的生物利用度。BMMSCs可在小鼠周围神经系统部位驻留,并具有保留细胞形态的能力,已经在外周神经损伤修复中被广泛应用[17-18]。分化的BMMSCs植入外周神经断端时,可以促进神经纤维的再生,其作用机制与BMMSCs移植促进周围神经损伤中的轴索再生与营养物质的产生有关联[19-20]。BBB运动评级量表评估和HE染色结果表明:PLGA微球搭载的VAP联合BMMSCs可明显修复受损的外周神经。
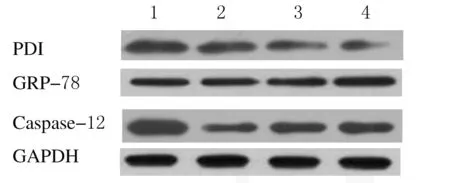
Lane 1:Control group;Lane 2:VAP group;Lane 3:BMC group;Lane 4:VAP-BMC group.
图3 各组大鼠坐骨神经组织中PDI、GRP-78和Caspase-12蛋白表达电泳图
Fig.3 Electrophoregram of expressions of PDI,GRP-78, and Caspase-12 proteins in sciatic nerve tissue of rats in various groups
表2 各组大鼠坐骨神经组织中PDI、GRP-78和Caspase-12蛋白表达水平


GroupPDIGRP-78Caspase-12Control1.16±0.180.82±0.131.38±0.25VAP0.95±0.15*0.79±0.140.70±0.18*BMC0.72±0.20*0.86±0.120.84±0.12*VAP-BMC0.52±0.13*1.19±0.18*0.89±0.17*
*P<0.01 compared with control group.
现代研究[21-24]表明:内质网持续应激与多种疾病的发生发展有密切关联,如糖尿病、神经退行性疾病和癌症等,而PDI、GRP-78和Caspase-12蛋白是内质网应激的标志性蛋白。PDI蛋白主要位于细胞内质网中,发挥促蛋白氧化还原、异构和分子伴侣的作用,参与蛋白的折叠与成熟过程;GRP-78蛋白是位于内质网上的重要分子伴侣,在应激过程中,过表达的GRP-78蛋白可以与错误折叠或未折叠蛋白疏水性残基端以及钙离子识别结合,减少内质网上错误折叠或未折叠蛋白的积累并维持钙离子平衡;Caspase-12蛋白是内质网应激的关键因子,参与细胞凋亡的调控[25-27]。本研究结果表明:PLGA搭载的VAP与BMMSCs联合应用可以明显下调内质网应激标志性蛋白的表达水平,在一定程度上抑制持续的内质网应激状态,恢复内质网的生理功能。
综上所述,PLGA搭载的VAP及BMMSCs移植可以修复受损的坐骨神经,且二者联合应用作用更加明显,其作用机制可能与抑制内质网应激有关。
——疾病防治的新靶标

