以弥漫性肺囊性病变伴咯血为表现的干燥综合征1例报告及文献复习
辛 桐,王 琦,陈 默,李 伟,高 鹏
(吉林大学第二医院呼吸内科,吉林 长春 130041)
干燥综合征(Sjögren syndrome,SS)是临床上较为常见的慢性自身免疫性疾病,主要累及泪腺和唾液腺等外分泌腺体。肺脏是易受累器官,其呼吸系统症状主要表现为呼吸困难,同时咳嗽、咳痰、胸部疼痛和发热[1]也较常见,仅有不足1%的患者表现为咯血,多为痰中带血[2]。胸部CT主要表现为双肺弥漫的斑片、纤维索条影、网格、结节影或弥漫性毛玻璃改变等,少数患者可表现为双肺多发囊性改变[3]。本文作者报道1例以弥漫性肺囊性病变伴咯血为表现的SS患者的诊治过程。目前国外仅见2篇类似的文献[4-5]报道,但患者的临床表现略有不同。本例患者以咯血收入本院,胸部CT显示大疱的直径略小,临床症状及CT表现更为罕见。本文作者对该患者的治疗过程进行分析,并结合文献复习,以加强临床医生对该病的认识。
1 临床资料
1.1 一般资料 患者,女性,23岁,未婚。因“呼吸困难伴咳嗽、咳痰1个月,咯血3 d”就诊。患者于1个月前无明显诱因出现呼吸困难及咳嗽、咳痰,呼吸困难轻微,活动后加重,咳少许白色泡沫痰,胸部CT显示双肺散在多发囊样改变。患者于3 d前无明显诱因出现咯血,鲜红色,晨起明显,每日2~3次,总量约为10 mL·d-1,为明确病因来本院就诊。既往病史:有海鲜过敏史,无其他慢性病病史及传染病病史。查体:一般状态尚可,浅表淋巴结未触及肿大,睑结膜苍白,听诊双肺呼吸音粗,未闻及干、湿啰音及胸膜摩擦音。心脏和腹部查体无明显异常。
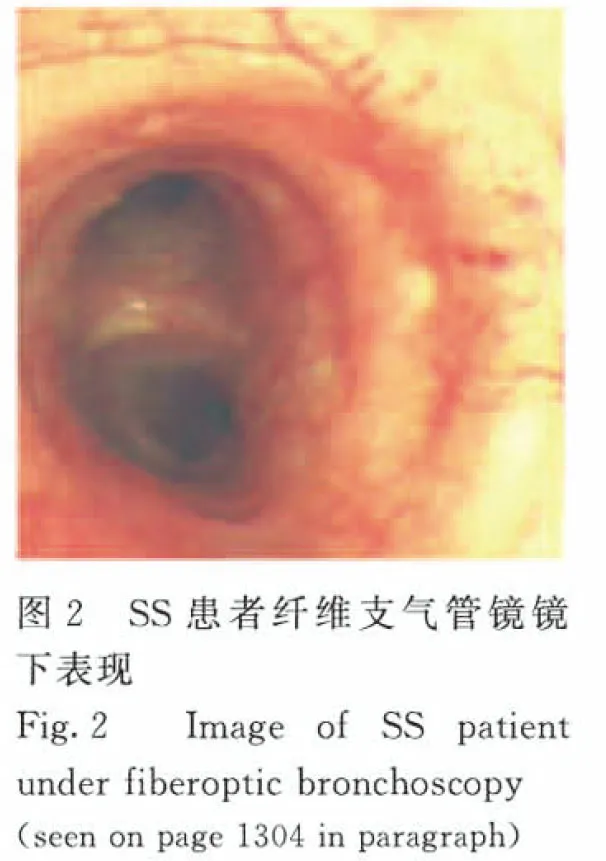
1.2 辅助检查 胸部CT:双肺散在多发囊样改变(图1)。实验室检查:①血常规中白细胞计数2.8×109L-1,中性粒细胞计数1.25×109L-1,红细胞计数3.58×1012L-1,血红蛋白水平89 g·L-1,平均红细胞体积70.5 fl,平均红细胞血红蛋白水平24.9 pg,平均红细胞血红蛋白水平302 g·L-1,血小板计数 262×109L-1。凝血常规、肝、肾功、甲状腺功能三项和尿常规正常。骨髓涂片、活检和血片检查大致正常。②支气管舒张试验中肺通气功能正常,支气管舒张试验阴性。弥散功能试验中肺弥散功能符合中度障碍,一氧化碳弥散功能(DLCO)=55.8%;残气/肺总量百分比轻度升高。③支气管镜检查中气管慢性炎症伴毛细血管增生(图2,见插页六)。气管镜灌洗液病理检查可见极少量细胞成分,未见恶性细胞。
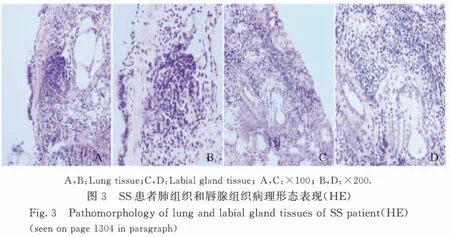
1.3 治疗经过 考虑该患者为年轻女性,主要表现为呼吸困难、咯血,胸部CT显示双肺散在多发囊样改变,初步诊断为淋巴管平滑肌瘤病。患者入院后给予抗炎、止血、对症支持治疗后,临床症状有所好转,无咯血。为进一步明确诊断,再次行纤维支气管镜检查,并行经支气管肺活检(TBLB)术,病理结果显示:右肺中叶支气管黏膜下灶状淋巴细胞浸润(图3,见插页六)。免疫组织化学染色结果显示:HMB45(-)、S-100(-)、MelanA(-)、SMA(+)、H-Caldesmon(+)和Desmin (+)。根据病理特点考虑SS,追问病史,患者自感口干、眼干症状2年余,进一步完善相关检查:类风湿因子1 100.0 IU·mL-1,ANA谱干燥综合征A抗体阳性,干燥综合征B抗体阳性,52 000蛋白抗体阳性,胞浆型-ANCA阳性,ANA筛查1∶1 000,ANA荧光模型为核颗粒性。免疫球蛋白G 20.90 g·L-1,补体C4 15.60×10-2g·L-1。唇腺活检:送检唇腺组织中可见灶状淋巴细胞浸润,每灶淋巴细胞数大于50个(图3,见插页六)。眼科滤纸试验、泪膜破碎时间测定、角膜染色实验:支持SS的诊断。最终诊断:SS、缺铁性贫血(中度)。规律口服糖皮质激素(小剂量强的松)和免疫抑制剂(复方环磷酰胺)治疗,患者病情好转,呼吸困难减轻,无咯血,肺弥散功能明显好转,2个月后复查胸部CT较治疗前无明显变化。
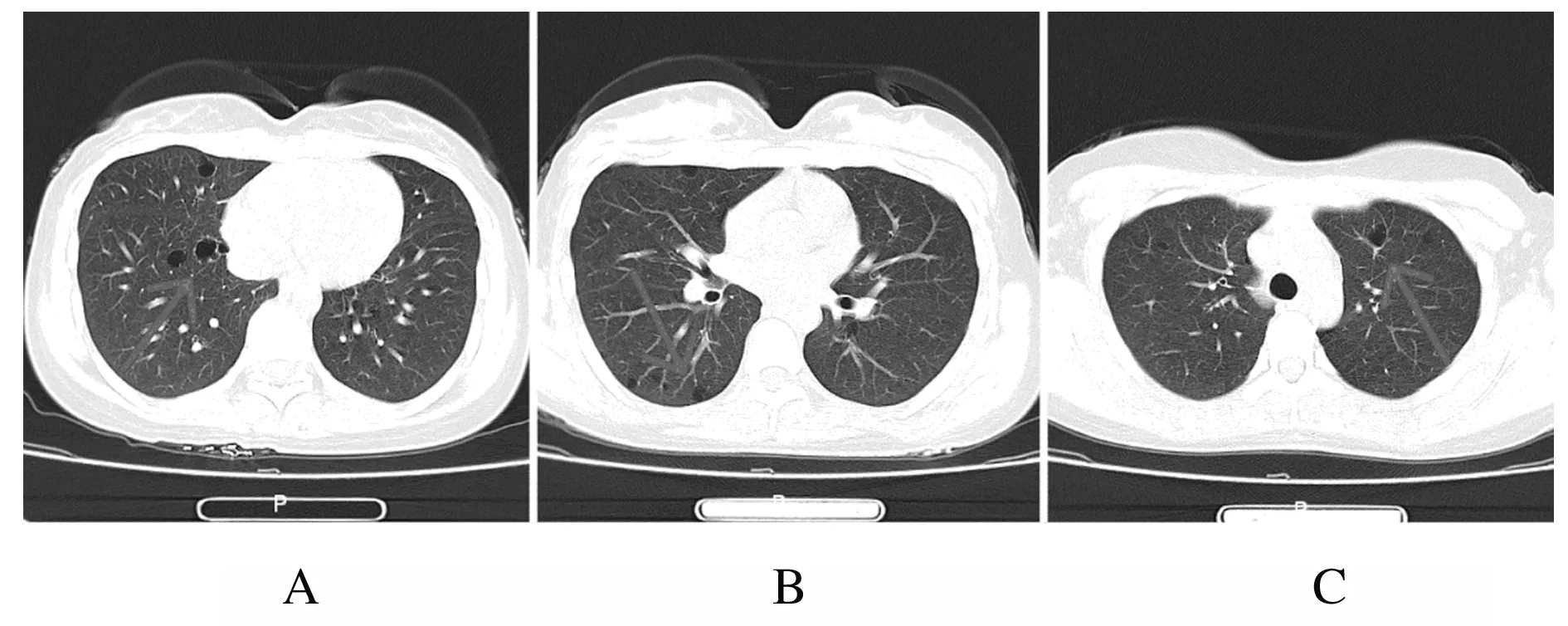
A:Inferior lobe of right lung;B:Middle lobe of right lung;C:Upper lobe of left lung.
图1 SS患者胸部CT影像
Fig.1 Chest CT images of SS patient
2 讨 论
SS是一种主要累及外分泌腺体的慢性炎症性自身免疫病。在我国人群中SS患病率为0.29%~0.77%,以女性多发,年龄集中在30~60岁[2,6]。SS可累及全身多器官系统,主要累及泪腺和唾液腺等外分泌腺以及骨骼、肌肉、肾脏、呼吸系统、消化系统和神经系统等,其中肺部损害的发生率高达9%~90%[4]。目前SS诊断依据主要根据2012年美国风湿病学会(ACR)关于SS的国际分类标准,主要包括:血清抗SSA和(或)抗SSB抗体(+);OSS染色评分≥3分;唇腺病理活检示淋巴细胞灶≥1个·4 mm-2,以上3项至少满足2项即可诊断[7]。
肺囊样病变被定义为由增生的上皮或纤维壁围绕的圆形空腔,与周围的正常肺组织具有明确的界限,囊内通常含有空气,也可含有液体或固体物质[8]。囊壁的厚度不一,但通常是薄壁(<2 mm)[9]。肺囊样病变涉及的疾病谱相对较广,症状表现无特异性,常见的可引起肺囊样病变的疾病有:淋巴管平滑肌瘤病(lymphangioleiomyomatosis,LAM)、特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)、淋巴细胞性间质性肺炎(lymphocytic interstitial pneumonia,LIP)、慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)、全小叶性肺气肿、肺囊肿、支气管扩张、肺朗格汉斯细胞组织细胞增多症(pulmonary Langehans cell histiocytosis,PLCH)、原发性SS、硬皮病、结节病(晚期)、类风湿关节炎、滤泡素基因相关综合征(follicular gene related syndrome,FLCN-S)或Birt-Hogg-Dubé综合征、肺孢子虫肺炎(pneumocystis carinii pneumonia,PCP)、肺淀粉样变性病、轻链沉积病(light chain deposition disease ,LCDD)、肺癌和肺转移癌等[10]。该患者在出现囊样改变的同时伴有咯血,主要的鉴别诊断应首先考虑为LAM。
SS临床上多见于双肺散在囊样改变伴咯血症状的年轻女性,更多见于LAM,因此根据临床特征误诊为LAM的病例并不少见[5]。该病例诊断过程中,根据育龄女性、进行性呼吸困难及咯血、胸部CT存在多个薄壁肺囊肿、肺通气和弥散功能下降等特点,疑似诊断为LAM,但最后通过血清学检查、TBLB、唇腺活检和泪腺等检查,确诊为SS。LAM主要发生于育龄期女性,几乎无男性患者,其临床表现为呼吸困难、咳嗽、咯血和胸痛等,尤其伴有反复发作的气胸、乳糜胸。SS诊断主要依靠高分辨率CT(HRCT)和病理活检。早期LAM的HRCT表现可无明显异常,或双肺野呈磨玻璃样改变。随病情进展可出现肺内弥漫性小结节、网格影,多均匀分布,伴或不伴有气胸和胸腔积液改变。典型LAM的HRCT表现为双肺野囊状透光影,囊腔呈圆形或类圆形,大小不等,直径为5~20 mm,多数约为10 mm,囊壁薄,壁光滑而完整,囊周无结节,囊状影之间肺野正常。病情进展时囊腔增大,量增多。在LAM患者中该类形态的囊腔发生率几乎为100%,这是诊断肺LAM(PLAM)的重要依据,因此胸部HRCT对 PLAM的诊断具有重要价值[11]。
尽管HRCT同样表现为双肺囊样改变,SS和LAM形态特点及病理生理学机制存在明显不同。SS囊性改变主要分布在肺野中下部区域,大多囊壁不规则,直径为5~60 mm,但LAM囊样改变主要于双肺野中均匀分布[11]。在组织学上,LAM囊肿是由沿血管、淋巴管和细支气管的LAM细胞浸润所致的气道狭窄、肺实质破坏、血管壁增厚、淋巴管长期发炎、空气滞留和静脉闭塞所致[12-13]。另有研究[14-15]显示LAM囊样改变更可能的原因是由于金属蛋白酶介导的弹性组织的破坏以及LAM细胞产生蛋白水解酶导致肺囊肿形成。而SS是由于细支气管周围淋巴细胞浸润和(或)淀粉样蛋白沉积导致气道变窄,并随之引起空气滞留,形成囊肿[16]。两者在肺囊肿的病理生理学机制上最主要的区别在于LAM存在特征性LAM细胞以及一些特殊表达的酶类,这些也是目前肺活检确诊LAM的重要依据之一。
LAM较为公认的咯血形成机制是远端血液回流受阻,血液淤滞甚至血管破裂,最近观点也表明小静脉的闭塞也可导致咯血[14, 17],而SS的咯血可能与血管受损有关,如急性坏死性血管炎和闭塞性血管炎等[2]。该患者纤维支气管镜镜下表现为支气管慢性炎症伴毛细血管增生,考虑为SS所致血管受损、破裂所致咯血。
至今,关于SS患者弥漫性肺囊样病变的影像报道较少,国内仅有4篇报道[18-21],Kobayashi 等[16]1988年首次报道SS患者伴肺大疱的临床表现,本文作者认为以单纯肺囊样表现的SS在临床诊断中容易漏诊。就现阶段而言,SS和LAM之间是否存在某种联系尚无定论,但两者在临床上的鉴别诊断至关重要,进行必要的HRCT和病理诊断可以更好地避免漏诊及误诊。尤其以肺部弥漫性囊样病变伴咯血为主要临床表现的育龄期女性,更应针对SS和LAM进行详细的鉴别诊断。

