9型腺相关病毒介导RNA干扰抑制p65基因表达对血管紧张素Ⅱ诱导H9c2细胞凋亡的影响*
邢梦瑶, 马小娟, 巩雪俐, 买买提祖农·买苏尔, 于文燕, 张雪梅, 孙 湛
(新疆医科大学基础医学院, 新疆 乌鲁木齐 830011)
心力衰竭(简称心衰; heart failure,HF)是一种严重的临床综合征,是各种严重心脏病的严重阶段[1],有着极高的死亡率,是当今最为重要的心血管病之一。 因此,寻求新的干预措施以改善心衰患者的预后及生存率是医学界亟待解决的问题。众多研究表明NF-κB信号通路参与了心衰、冠心病和高血压等多类心血管疾病的病理生理过程。不少研究人员认为NF-κB中p65的激活很有可能是心血管炎性等疾病的共同发生发展环节,通常涉及到造成心脏损伤的不利影响[2]。 前期研究发现,下调p65后可提高心肌细胞抗氧化的能力[3],抑制p65蛋白的表达可抑制NF-κB通路的激活。我们需寻找一种能有效抑制NF-κB通路中p65蛋白表达的方法来减轻心力衰竭等心血管疾病的病情。
材 料 和 方 法
1 材料
大鼠心室肌细胞H9c2由上海中科院细胞库提供。rAAV9-eGFP-p65-siRNA(本实验室设计构建,Virovek生产)。胎牛血清(fetal bovine serum,FBS; Gibco);DMEM高糖培养液(HyClone);细胞质蛋白/核蛋白抽提试剂盒和BCA蛋白定量分析试剂盒(Sigma);Western blot试剂盒(Cell Signaling Technology);凋亡试剂盒(BD Pharmingen)。Heracell二氧化碳培养箱(Thermo Fisher Scientific);DM4000B型倒置荧光显微镜(LEICA);EPICS ALTRA流式细胞仪(Beckman Coulter)。Quantity One分析软件(Bio-Rad)。
2 方法
2.1细胞培养 H9c2细胞用含有双抗及10% FBS的 DMEM 高糖培养在37 ℃、5% CO2的培养箱内。待细胞长到密度大概为培养瓶的80%~90%后用0.25%胰酶消化制成单细胞悬液后进行传代,每次传代时细胞密度控制在1×108/L。传3~5代。
2.2细胞分组 将H9c2细胞分为:(1)正常对照(blank control)组; (2)Ang II刺激(Ang II)组; (3)rAAV9-eGFP-p65-siRNA组;(4)rAAV9-eGFP+Ang II组;(5)rAAV9-eGFP组;(6)rAAV9-eGFP-p65-siRNA+Ang II组。
2.3病毒转染 将处理好的第2代或第3代融合约80%~90%的 H9c2细胞消化、计数, 分别接种于25 mm2培养瓶中,浓度约为1×105。加入含有10% FBS的 DMEM进行细胞培养,几乎所有细胞贴壁后取出培养液,用PBS洗涤2次,按不同的感染复数(multiplicity of infection,MOI)把细胞分为5组:MOI=0 vg/cell的细胞组(对照组),即未转染病毒组; MOI=1×106vg/cell的细胞组; MOI=2×106vg/cell的细胞组; MOI=4×106vg/cell的细胞组; MOI=5×106vg/cell的细胞组。按 MOI不同分别加入不同滴度的用 DMEM培养液稀释的 rAAV9-eGFP-p65-siRNA或 rAAV9-eGFP病毒液约1 mL,每组细胞做3个复样。将细胞置于37 ℃、5% CO2的培养箱中,每30 min十字晃动几下,3~4 h后,在原有液体的基础上继续加入适量 FBS及DMEM, 使 FBS终浓度达到10%。培养24 h后起,应用荧光倒置显微镜观察,MOI=0 vg/cell作为对照组,于转染后第1、2、3、4、5、6和7 d进行细胞形态和生长的观察,以波长为490 nm的蓝色光激发出绿色荧光的 H9c2细胞为阳性细胞,按一个随机高倍视野下计数200个细胞中阳性细胞的个数计算出平均百分率(重复6次),并照相记录。
2.4流式细胞术检测转染效率 在eGFP表达高峰时间分别收集实验组及对照组中H9c2细胞,离心,PBS洗涤2次后充分吹散细胞,200目滤网滤过,无需加抗体,直接用流式细胞术检测rAAV9-eGFP-p65-siRNA 和rAAV9-eGFP对H9c2细胞的转染效率,上述实验重复3次。
2.5CCK-8检测病毒对细胞活力影响 向96孔板中加入100 μL的H9c2细胞悬液,密度大约为5×106/L,放入培养箱内培养24 h(37 ℃、5% CO2),分别加入rAAV9-eGFP-p65-siRNA 和rAAV9-eGFP进行处理,120 h后每孔加入10 μL的CCK-8,孵育2~3 h后用酶标仪测定吸光度A(450 nm)值,上述实验重复3次。
2.6流式细胞术检测细胞凋亡 收集实验组及对照组中H9c2细胞,离心,PBS洗涤2次后加入400 μL PBS充分吹散细胞,200目滤网滤过,加入5 μL Annexin V-PE和5 μL 7-氨基放线菌素D(7-aminoactinomycin D, 7-AAD),室温下避光孵育15 min,直接上流式细胞仪检测,每组重复3次。
2.7Western blot检测蛋白水平 每条电泳道取 30 μg 提取的细胞总蛋白,以SDS-PAGE分离,然后再将蛋白通过电泳,转至PVDF膜上,之后用1% TBST洗膜,再用 10%封闭液将其封闭,加入 抗NF-κB 抗体(p65 抗体),在4 ℃冰箱孵育过夜,次日,洗膜后加入适量的 II 抗工作液,显色。采用化学发光法检测、拍照,计算目的蛋白的积分光密度值,并与内参照GAPDH比较,计算并进行统计学分析。图像上的每个条带重复测量 3 次,结果以积分吸光度值表示并记录。
3 统计学方法
应用SPSS 17.0及GraphPad Prism 5统计软件包进行统计分析。计量资料以均数±标准差(mean±SD)表示,多组间均数比较采用单因素方差分析,以P<0.05表示差异有统计学意义。
结 果
1 转染后大鼠心肌细胞H9c2中eGFP表达情况及细胞生长形态的观察
rAAV9-eGFP-p65-siRNA 和rAAV9-eGFP转染H9c2细胞后,在倒置荧光显微镜490 nm蓝光激发下呈绿色。转染后48 h,细胞中eGFP开始表达,表达强度随时间的推移而增强,转染后120 h达到高峰,之后开始逐渐减弱。整个观察周期过程中细胞状态良好,见图1。
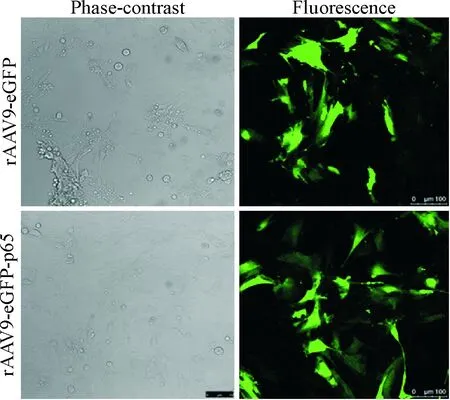
Figure 1.The expression of eGFP in H9c2 cells (120 h after transfection; ×200; MOI=4×106 vg/cell).
2 流式细胞术检测H9c2细胞的转染效率
转染后分别收集对照组和实验组细胞,流式细胞术结果表明,rAAV9-eGFP-p65-siRNA 和rAAV9-eGFP转染H9c2细胞120 h的转染率最高,分别为(53.4±1.8)%和(52.7±1.9)%,见表1。
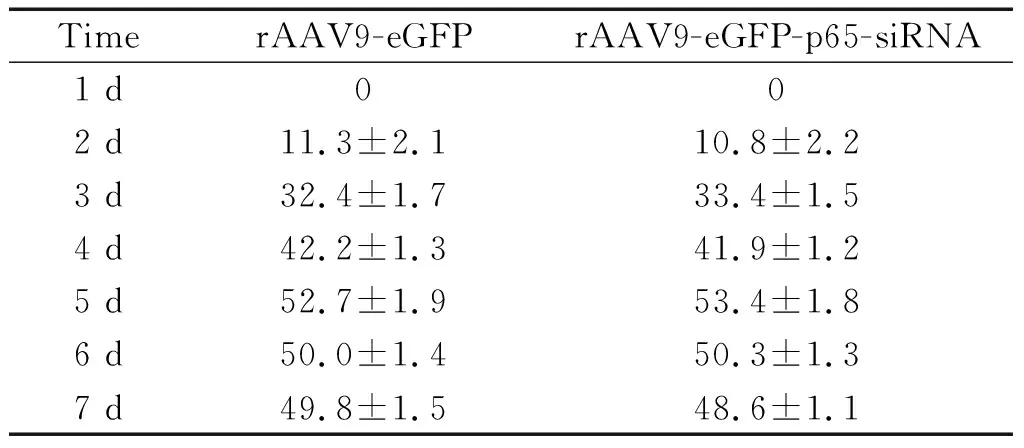
表1 细胞转染效率
3 CCK-8法检测细胞活力
对照组和实验组结果比较,各时点转染和未转染rAAV9-eGFP-p65-siRNA 和rAAV9-eGFP的细胞生长情况相似,差异无统计学显著性,说明转染rAAV9-eGFP-p65-siRNA 和rAAV9-eGFP均对H9c2细胞生长均无明显影响,无明显细胞毒性,见图2。
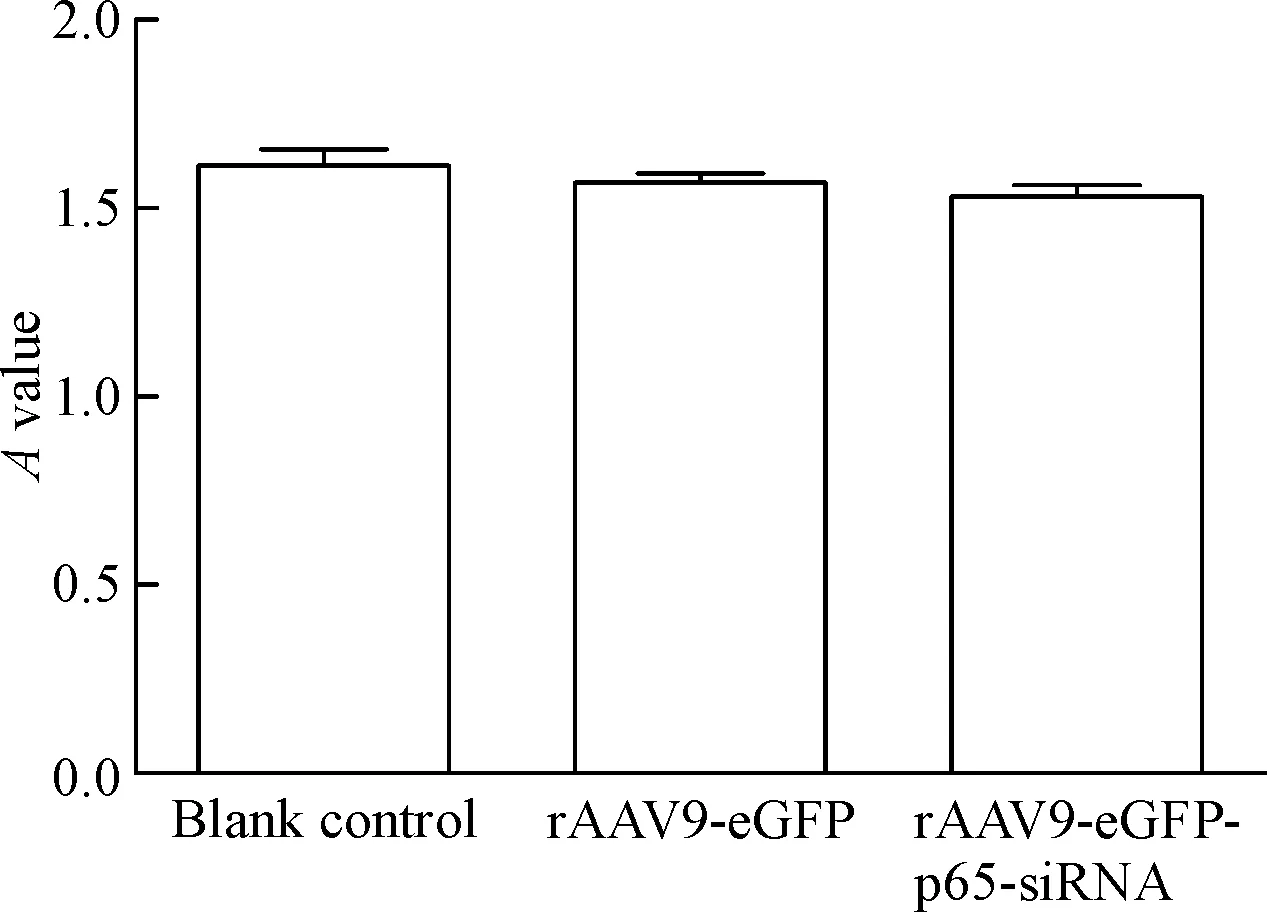
Figure 2.The viability of H9c2 cells measured by CCK-8 assay. Mean±SD. n=6.
4 流式细胞术检测细胞凋亡
Ang II组和rAAV9-eGFP+Ang II组的细胞凋亡率分别为(20.3±1.4)%和(18.3±1.9)%,和对照组相比凋亡率明显上升(P<0.05);而rAAV9-eGFP-p65-siRNA和rAAV9-eGFP-p65-siRNA+Ang II组的凋亡率明显下降,且和其它4组相比,差异均有统计学意义(P<0.05),见图3。
5 Western blot 检测p65表达情况
正常对照组中,p65有一定的表达,当给予rAAV9-eGFP-p65-siRNA的干扰时,p65表达降低(P<0.05)。当给予Ang II刺激时,p65的表达较对照组增加(P<0.05),但给予rAAV9-eGFP-p65-siRNA干扰后再给予Ang II刺激时,p65的表达不但不会增加,反而会降低。而rAAV9-eGFP对p65的表达无显著影响,见图4。
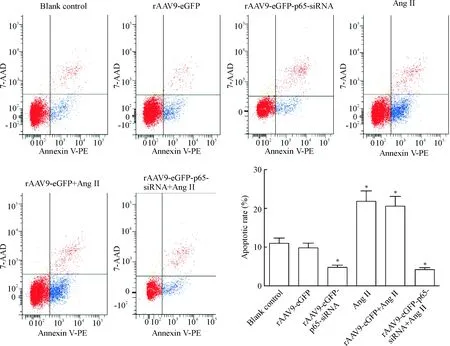

Figure 4.Western blot for determining the protein expression of p65 in the H9c2 cells. Mean±SD. n=3. * P<0.05 vs blank control group.
讨 论
心力衰竭是心脏症候群的终末期表现,其心脏不能为身体提供足够的血液供应,通常是由于左心室功能障碍,是最终导致心血管疾病患者死亡的最主要原因之一[4]。越来越多的证据表明[1],NF-κB信号通路的激活与心力衰竭等多种心血管疾病有着密切的联系。而NF-κB是一种广泛存在于细胞内的具有多向转录调节功能的关键因子,目前为止,已发现至少 5 个NF-κB家族成员,即c-Rel、p50、p52、p65 和RelB。细胞中发挥主要生理作用的是p65。NF-κB的过度活化可以引起多种疾病,若是能对其进行有效的拮抗,便可对心血管炎症反应、恶性肿瘤等多种相关疾病的治疗带来突破性进展[5]。因此调节和控制NF-κB通路中 p65的活性是一个理想的治疗靶向,将通过多重环节起效,达到治疗NF-κB相关疾病的目的。已有研究证实重组9型腺相关病毒载体(rAAV9-eGFP)对心肌有极强的靶向亲和力[6-7],可长期稳定地表达外源基因[8]。心力衰竭是一个慢性的过程,所以rAAV9-eGFP成为目前心脏疾病基因治疗的最佳载体。
高效特异性的 RNAi 技术目前已被广泛的应用于许多领域,比如基因功能研究、抗病毒感染和抗肿瘤等,具有高度特异性,高效性,快速性,长度、浓度依赖性及高稳定性等优势。据此,本实验通过将重组腺相关病毒 rAAV9-eGFP-NF-κB p65-siRNA转染大鼠心肌H9c2细胞后,靶向抑制 NF-κB 通路活性,在细胞水平研究靶向抑制 NF-κB 信号通路中p65的活性对心肌细胞凋亡的作用及细胞学机制,为防治心力衰竭发生提出新方案。
此实验证实rAAV9-eGFP-NF-κB p65-siRNA成功转染细胞后,第2天开始荧光表达,第5天达到高峰,并且Western blot结果显示p65蛋白表达量呈下降趋势,说明腺相关病毒介导的siRNA技术能有效地抑制大鼠心肌H9c2细胞NF-κB通路中 p65的表达。
Ang II刺激心肌细胞可分泌多种细胞因子,这些因子以旁分泌或自分泌的方式调控心肌细胞自身和周围的心肌细胞代谢结构功能而参与心肌重构。另据研究表明,NF-κB与血管紧张素II也存在密切的相关性[9],可共同激活多种核转录因子。资料显示,Ang II在刺激24 h、10-6mol/L 的浓度下时对细胞的刺激作用最强,因此本实验用此时间和浓度下的Ang II作为刺激因子[10]。
细胞给予Ang II刺激,细胞p65的表达量较空白对照组增高。在给予rAAV9-eGFP-NF-κB p65-siRNA转染的前提下,再使用Ang II刺激,p65蛋白表达量未见明显升高,进一步说明腺相关病毒介导的RNA干扰技术能有效沉默p65。p65表达的有效沉默是本实验的基础,为后续实验奠定了良好的基础。
细胞凋亡是其自身进行的一种程序性的死亡方式。 在心肌梗死、缺血再灌注损伤等可发展为心力衰竭的多种心血管疾病发生发展过程中都伴有心肌细胞的凋亡[11]。在各种心血管疾病的发病机制和预后中发挥着重要的作用[12]。有研究表明[13],Ang II刺激会诱导细胞凋亡,同时NF-κB也是参与细胞凋亡的关键因子[14],其在炎症、免疫反应、肿瘤发生和防止细胞凋亡中起着关键的作用[15-17],因为它激活许多基因的转录,从而参与细胞凋亡[18]。NF-κB通路被激活后向核内转移,p65表达量增加,抗凋亡作用减弱,同时激活各种炎性因子的产生,而这些炎性因子又不断刺激NF-κB的活化,导致细胞凋亡增加[19]。因此下调NF-κB通路的活性,可减轻心肌细胞的凋亡。本研究发现重组腺相关病毒 rAAV9-eGFP-NF-κB p65-siRNA转染大鼠心肌H9c2细胞后,p65表达降低,细胞的凋亡减少,可有效减少因细胞凋亡引起的细胞数量减少。
综上所述,本研究利用RNA干扰技术,重组9型腺相关病毒作为载体可以成功、高效地沉默心肌细胞中的p65表达,并且证实利用rAAV9-eGFP-NF-κB p65-siRNA转染大鼠心肌H9c2细胞可以明显地降低细胞凋亡率,这为后期心力衰竭等心血管疾病的相关防治研究提供了有力的条件。

