利拉鲁肽通过p38 MAPK通路改善高同型半胱氨酸血症诱导的大鼠海马氧化应激及炎症损伤*
张 瑶, 谢家钊, 胡 军, 金 肆, 江燕丽, 许 腾△
(1华中科技大学同济医学院附属梨园医院内分泌科, 湖北 武汉 430077; 2华中科技大学同济医学院基础医学院病理生理学系, 湖北 武汉 430030)
阿尔茨海默病(Alzheimer disease, AD)是一种在全球范围内严重威胁人类健康的慢性进行性神经退行性疾病,临床上主要表现为缓慢进展的痴呆。高同型半胱氨酸血症(hyperhomocysteinemia, Hhcy)是AD发病的重要独立危险因素[1]。近年来,AD与2型糖尿病的密切相关性以及抗糖尿病药物的神经保护效应已引起广泛关注[2]。胰高血糖素样肽1(glucagon-like peptide-1,GLP-1)类似物利拉鲁肽(liraglutide, Lir)是治疗2型糖尿病的有效药物,具有降糖和改善氧化应激损伤的作用。有学者报道,GLP-1能通过抑制内质网应激(endoplasmic reticulum stress,ERS)改善肥胖小鼠的血管内皮功能[3],但其能否通过该途径改善Hhcy诱导的海马损伤尚不清楚。研究表明,连续注射14 d同型半胱氨酸(homocysteine, Hcy)能诱导大鼠出现典型的AD样病理改变,如Tau蛋白异常磷酸化和β-淀粉样蛋白(amyloid β-protein,Aβ)聚集[4]。此外也有学者报道,Hhcy可通过上调内质网应激诱导大鼠海马神经元损伤[5],但其机制尚不清楚。有研究报道,Hhcy可以通过激活p38途径增加心肌细胞氧化应激,但在中枢神经系统是否也存在相同作用尚待研究[6]。对丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路的调控是在海马组织损伤期间对神经保护最有希望的策略之一,但Lir能否通过该信号通路减轻Hhcy诱导的海马损伤尚未见报道。
因此,本研究以Hhcy大鼠模拟散发型AD,探讨Hhcy大鼠海马组织中内质网应激、炎症反应和MAPK通路的改变以及Lir的保护作用及可能机制。由于Hhcy是AD的高风险因素,因此,本研究对AD的早期防治有重要意义。
材 料 和 方 法
1 动物和分组
选择2月龄SD雄性大鼠40只,体重(250 ±20)g,均购自华中科技大学同济医学院实验动物中心,动物合格证编号为SCXK(鄂)2016-0009。适应饲养7 d后随机分为5组,每组8只:对照(control,Ctrl)组每天尾静脉注射生理盐水,Hhcy组尾静脉注射生理盐水和Hcy(33.3 μg·kg-1·h-1),Lir低剂量[low-dose Lir, Lir(L)]组尾静脉注射Hcy,同时皮下注射Lir 12.5 μg·kg-1·h-1,Lir中剂量[middle-dose Lir, Lir(M)]组尾静脉注射Hcy,同时皮下注射Lir 25.0 μg·kg-1·h-1和Lir高剂量[high-dose Lir, Lir(H)]组尾静脉注射Hcy,同时皮下注射Lir 37.5 μg·kg-1·h-1。所有试剂均注射14 d,Hcy注射时间是每天上午9~10点,Lir每天注射2次(上午8:00和下午8:00),末次注射24 h后取材。实验操作过程符合中华人民共和国国家科学技术委员会颁布的《实验动物管理条例》中的管理制度。所有的动物研究都得到了华中科技大学同济医学院学术评审委员会的批准。
2 主要试剂和方法
2.1主要试剂 Lir注射液购自诺和诺德公司(批号FP52729-1);超氧化物歧化酶(superoxide dismutase, SOD)(货号A001-1-1)、 丙二醛 (malondialdehyde, MDA)(货号A003-1)和谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)(货号A005)检测试剂盒均购自南京建成生物工程有限公司;抗p38、p-p38、ERK1/2、 p-ERK1/2、 JNK和p-JNK抗体购自Cell Signaling Technology;抗免疫球蛋白重链结合蛋白(immunoglobulin heavy chain binding protein,BIP)和C/EBP同源蛋白(C/EBP homology protein, CHOP)抗体购自Proteintech;白细胞介素1β(interleukin-1β, IL-1β)(货号E-EL-R0012c)、IL-6(货号E-EL-R0015c)和肿瘤坏死因子α(tumor necosis factor-α, TNF-α)(货号E-EL-R0019c)ELISA试剂盒购自武汉伊莱瑞特生物科技有限公司。
2.2Western blot实验 用6%水合氯醛麻醉大鼠后,断头取脑,分离海马组织,置于预冷RIPA组织裂解液中进行匀浆, 4 ℃、 12 000 r/min离心后,取上清,采用BCA法测定蛋白浓度。将等量不同组别蛋白样品经SDS-PAGE分离后,转移至硝酸纤维素膜上,用5%脱脂奶粉室温封闭1 h,加入不同Ⅰ抗,4 ℃孵育过夜, TBST漂洗后再加入荧光标记的Ⅱ抗,室温孵育1 h,TBST漂洗后进行ECL曝光显影,胶片经过扫描后应用ImageJ软件进行定量分析条带灰度值,计算各组蛋白的相对表达量。
2.3免疫组织化学检测 大鼠麻醉后,断头取脑,分离海马组织,用生理盐水将血液冲洗完全后,制成石蜡切片,经过脱蜡,水化以及抗原修复。PBS洗2次,每次3 min,加3%过氧化氢灭活内源性过氧化物酶,BSA封闭30 min后分别加入Ⅰ抗,4 ℃孵育过夜。PBS漂洗后用SABC方法进行孵育(SA1022,博士德)。DAB显色后,脱水,透明,中性树胶封片。
2.4SOD和GSH活性及MDA含量测定 用6%水合氯醛麻醉大鼠后,断头取脑,剥离出海马组织,加入9倍体积0.9%氯化钠注射液冰上匀浆,离心后取上清液,分别采用羟胺法测定SOD活性;硫代巴比妥酸法测定MDA含量;过氧化氢酶活性法测定GSH活性,按照试剂盒说明书进行操作,用全自动酶标仪测定各管吸光度(A)值。
2.5IL-1β、IL-6和TNF-α含量测定 用6%水合氯醛麻醉大鼠后,断头取脑剥离出海马组织,加入9倍体积PBS匀浆,离心后取上清,采用酶联免疫吸附法检测IL-1β、IL-6和TNF-α含量, 按照试剂盒步骤操作,结合对应标准品浓度绘制标准曲线,根据标准曲线方程计算各指标含量。
3 统计学处理
采用 SPSS 19.0软件进行统计分析,计量资料以均数±标准差(mean±SD)表示,各组间比较采用单因素方差分析,满足方差齐性时组间比较采用 LSD-t检验,以P<0.05为差异有统计学意义。
结 果
1 Lir对Hhcy大鼠海马组织氧化应激的影响
与正常大鼠比较,Hhcy能显著降低大鼠海马组织中SOD和GSH的活性,同时提高MDA水平(P<0.01),而Lir可有效逆转上述变化,其中,Lir(L)组MDA水平降低,GSH活性升高(P<0.05),SOD活性无统计学意义;Lir(M)组和Lir(H)组MDA水平显著降低,SOD和GSH活性显著升高(P<0.05),见图1。
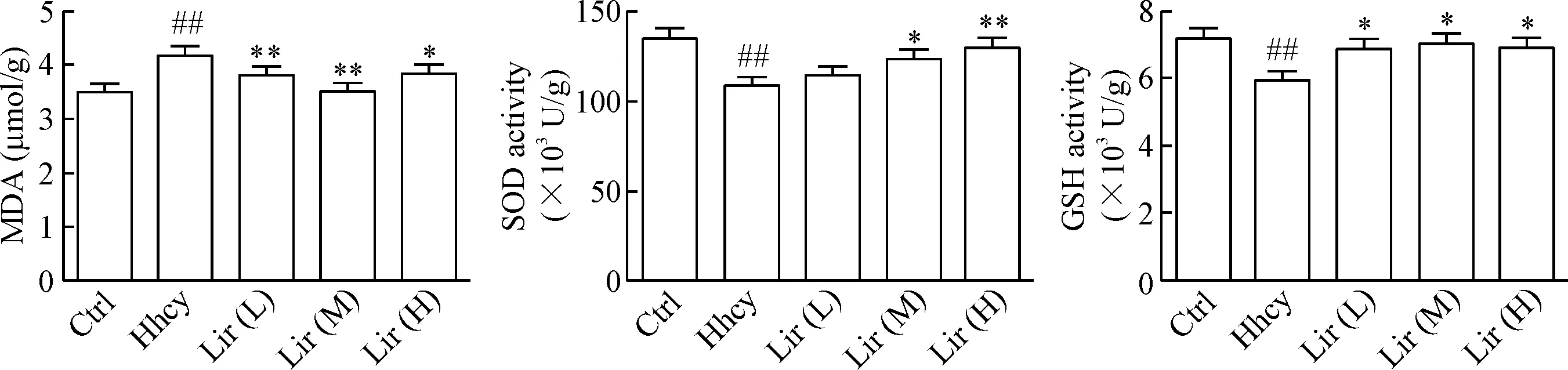
Figure 1.Lir attenuates Hhcy-induced oxidative stress in the rat hippocampal extracts measured by ELISA. Mean±SD.n=8.##P<0.01vsCtrl group;*P<0.05,**P<0.01vsHhcy group.
图1利拉鲁肽抑制高同型半胱氨酸血症引起的氧化应激
2 Lir对Hhcy大鼠海马组织ERS标志蛋白表达水平的影响
为研究Hhcy是否导致ERS,在连续注射Hcy 14 d后,我们检测了海马组织ERS标志蛋白BIP和CHOP的水平。结果显示,与Ctrl组相比, Hhcy组BIP和CHOP表达水平显著增高(P<0.01); Lir(L)组、Lir(M)和Lir(H)组BIP和CHOP表达量均显著降低(P<0.05或P<0.01),并呈剂量依赖性,见图2。
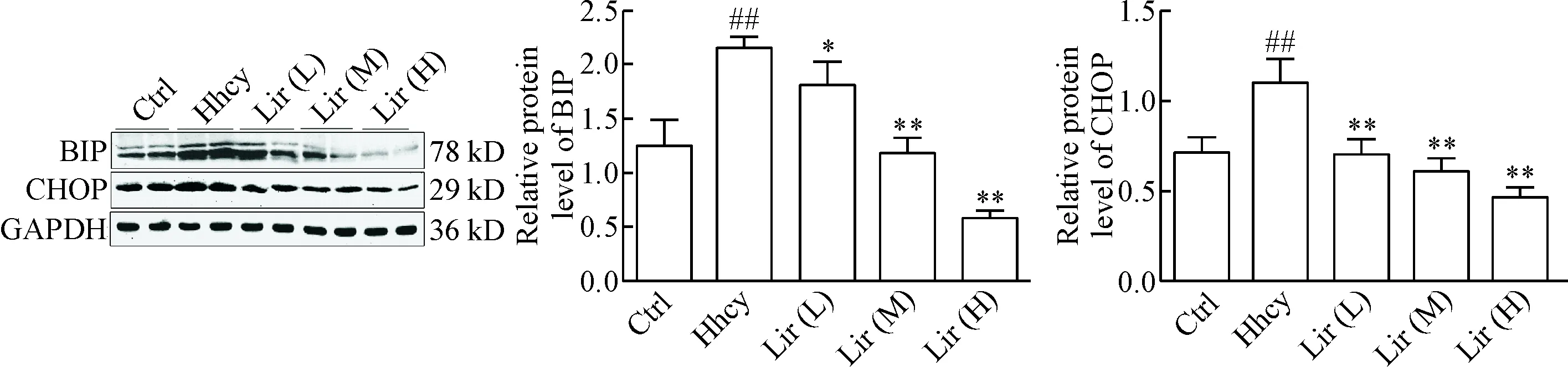
Figure 2.Lir attenuates Hhcy-induced BIP and CHOP expression in hippocampal subsets of rats measured by Western blot. Mean ±SD. n=8. ##P<0.01 vs Ctrl group; *P<0.05, **P<0.01 vs Hhcy group.
同时,我们还利用免疫组织化学技术检测BIP在大鼠海马组织表达定位的变化。与Ctrl组相比,Hhcy组海马组织中CA1、CA3和齿状回(dentate gyrus, DG) 区BIP胞浆染色加深,表明Hhcy使BIP表达聚积;与Hhcy组相比,Lir(L)和Lir(M)组CA1、CA3和DG区BIP胞浆染色变浅,表明Lir下调BIP的表达量,见图3。
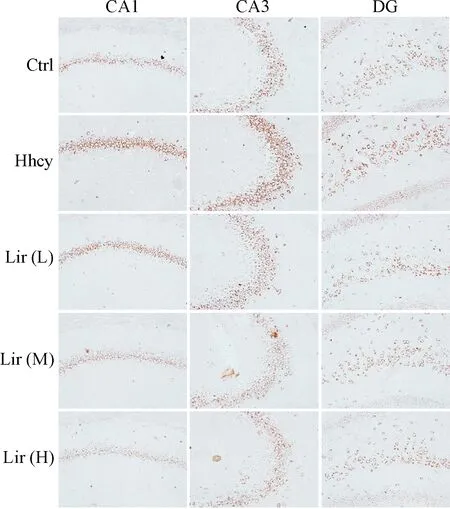
Figure 3.Lir attenuates Hhcy-induced BIP expression in hippocampal subsets of rats measured by immunohistochemical staining (×200).
3 Lir对Hhcy大鼠海马组织MAPK信号通路相关蛋白表达的影响
为进一步研究Lir影响ERS分子机制,我们检测了MAPK通路蛋白的表达水平。与Ctrl组相比,Hhcy组注射Hcy14 d后p-p38表达量明显增高(P<0.01),但p-ERK和p-JNK没有明显变化; Lir(L)、Lir(M)和Lir(H)组p-p38表达量较Hhcy组明显下调(P<0.05),其中Lir(M)和Lir(H)组p-p38表达量降低更为明显(P<0.01),见图4。以上结果表明Hhcy激活了p38 MAPK信号通路,Lir呈剂量依赖性下调p38 MAPK表达。
4 Lir对Hhcy大鼠海马组织的炎症因子的影响
ERS与炎症水平密切相关,因此我们同时检测炎症相关因子表达。与Ctrl组比,Hhcy能显著增高IL-1β、TNF-α和IL-6表达水平(P<0.01),Lir(L)组和Lir(H)组TNF-α和IL-6显著降低(P<0.01),而IL-1β的降低无统计学差异;Lir(M)组IL-1β、TNF-α和IL-6均显著降低(P<0.05),见图5。
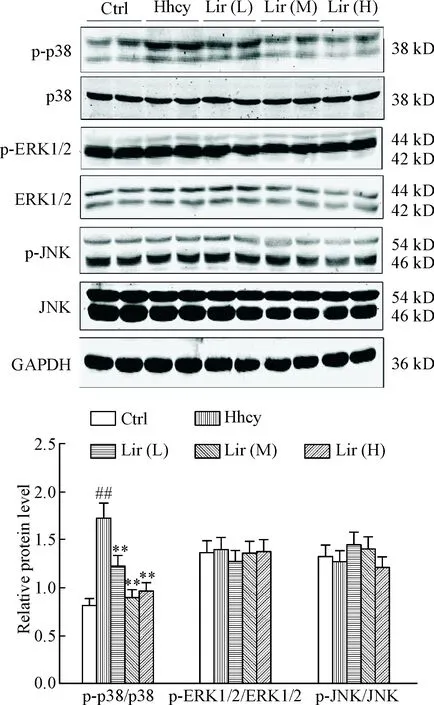
Figure 4.Lir attenuates Hhcy-induced p38 activation in rat hippocampal extracts measured by Western blot. Mean±SD. n=8. ##P<0.01 vs Ctrl group; **P<0.01 vs Hhcy group.
讨 论
ERS、氧化应激和炎症均参与AD的发生发展。Hossain等[7]认为Hhcy可导致大鼠Aβ的异常聚集,引起ERS标志物,而如BIP和CHOP表达上调,从而导致细胞凋亡的增加;Pimplikar等[8]认为炎症反应既是AD的诱因又是AD导致的后果;Hoozemans等[9]在AD患者和动物模型中发现在脑部的老年斑中炎症因子IL-1β、TNF-α和IL-6等表达增加。我们的研究发现,在Hhcy模型大鼠海马组织中,ERS标志蛋白BIP和CHOP表达量显著增高,表明Hhcy诱发了ERS;而酶类抗氧化物SOD和GSH的活性显著降低,MDA水平显著升高,提示其抗氧化能力减弱;同时,炎症因子IL-1β、TNF-α和IL-6显著升高,提示Hhcy促进了大鼠海马的炎症损伤。

Figure 5.Lir attenuates Hhcy-induced inflammation in rat hippocampal extracts measured by ELISA. Mean±SD. n=8. ##P<0.01 vs Ctrl group; *P <0.05, **P<0.01 vs Hhcy group.
氧化应激是指活性氧簇(reactive oxygen species,ROS)产生过多或发生代谢障碍,超过内源性抗氧化防御系统对其的消除能力,最终导致细胞脂质过氧化损伤。未折叠蛋白反应(unfolded protein response,UPR)是细胞内最重要的ERS反应。ROS应激信号由内质网传到细胞核中,继而引发一系列特定的靶基因和蛋白质翻译水平下降,产生UPR以维持细胞正常功能的一种自我保护机制。但当ROS过强时,内质网的功能紊乱造成UPR超载,细胞可能启动凋亡程序导致细胞坏死和组织损伤。有学者认为,ROS在UPR的上游和下游起作用,因此ERS和氧化应激是相互作用[10]。细胞内UPR是由内质网分子伴侣(如BIP和钙联结蛋白等) 和ERS感受器(如内质网样激酶、肌醇需求激酶1和活化转录因子6)所介导的[11]。在非应激状态下,3种感应蛋白的内质网腔内段与分子伴侣BIP结合而处于失活状态,以维持正常的非活性状态;当处于应激状态时,未折叠或错误折叠蛋白在内质网内聚集并竞争性结合BIP,致使BIP从3种跨膜蛋白上解离。适度的ERS和UPR是机体进行功能代偿和自我保护的一个过程,但当严重或过强的ERS持续存在时,UPR 不仅不能起到保护作用,反而会诱导 ERS 特异的转录分子,如CHOP等表达,并激活MAPK途径及各种caspase,导致各种细胞尤其是神经元的损伤[12]。本研究发现,在正常情况下BIP表达水平不高,Hhcy诱导14 d后BIP可显著提升,同时CHOP的变化趋势与BIP一致,表明Hhcy可导致ERS,进一步证明两者的关系。
GLP-1是一类通过细胞膜表面的受体(GLP-1R)发挥作用并呈葡萄糖依赖的肠促胰岛素,该受体在胰腺和大脑等组织有广泛分布,是一种可通过血脑屏障的营养因子[13]。Lir是临床上用于治疗2型糖尿病的 GLP-1R激动剂,可与脑内广泛分布的GLP-1R结合,改善AD脑内受损的胰岛素信号途径,促进神经突起生长,发挥神经保护作用[14]。有研究表明,Lir可改善阿尔茨海默病样转基因小鼠的空间学习记忆能力和Aβ的聚集,但作用机制尚不明确[15]。朱亭等[16]认为,Lir能减轻2型糖尿病患者的氧化应激状态。另外已有报道表明,GLP-1类似物艾塞那肽可减少啮齿动物模型胰腺中BIP、CHOP及人X盒结合蛋白1的表达[17],但目前尚无报道GLP-1类似物与脑组织ERS的关系。本研究给大鼠注射Hcy的同时给予不同剂量的Lir,结果发现,Lir可下调BIP和CHOP蛋白,并与剂量呈正相关,这表明Lir能在一定程度上抑制ERS。我们还发现,Lir可下调炎症因子IL-1β、TNF-α和IL-6的表达,提高SOD和GSH的活性,并降低MDA的水平。因此我们认为,Lir能改善Hhcy诱导的ERS,并减少氧化应激和炎症损伤。
为了进一步探讨Lir改善Hhcy大鼠海马ERS、氧化应激损伤和炎症反应的可能作用机制,我们检测了MAPK通路相关蛋白表达水平。研究表明,p38 MAPK信号转导系统通过对细胞转录、蛋白合成和受体表达等的调节,既与AD相关的Aβ沉积及Tau蛋白的异常磷酸化密切相关,又参与了这些异常病理状态所导致的炎症反应及应激反应,最终导致AD的发生发展[18]。我们的研究表明,Hhcy大鼠模型的p-p38表达水平明显增加,表明Hhcy能导致大鼠海马上调ERS,发生氧化应激和炎症反应,激活了p38 MAPK信号通路,同时给予Hhcy和Lir后,在低中浓度Lir组,p-p38呈浓度依赖性降低,继续增加Lir浓度后,p-p38并未进一步降低,我们猜测这种现象可能与GLP-1R受体饱和现象有关。
综上所述,Hcy连续尾静脉注射14 d后可诱发大鼠海马发生ERS,导致氧化应激和炎症损伤;而给予Lir连续治疗14 d后,ERS水平可显著下降,同时氧化应激与炎症损伤也得到改善,这可能与下调p38 MAPK信号通路有关。目前研究GLP-1及其类似物对ERS的作用主要是针对糖尿病的外周组织,本文揭示了GLP-1类似物Lir对Hhcy引起的中枢神经损伤也具有神经保护作用并探讨了其初步的分子机制。
——疾病防治的新靶标

