1株能利用高粱汁产L-乳酸的菌株鉴定及培养基优化
谢 瑞, 杨婷婷, 魏燕霞, 谢 雁
(1.西北师范大学 生命科学学院,甘肃 兰州 730070; 2.福建农林大学 园艺学院,福建 福州 350002;3.复旦大学 生命科学学院,上海 200438; 4.兰州财经大学,甘肃 兰州 730070)
乳酸(Lactic acid)又名α-羟基丙酸,其单体被广泛应用于食品、化工、纺织和皮革业[1],聚合物(聚乳酸)则被应用于农业、药学及医学领域[2-4],目前主要利用微生物发酵法来生产乳酸。国内外主要利用淀粉、纤维素、木薯、糖蜜等[5-6]成本较高的原料发酵生产L-乳酸,且大部分原材料都要进行复杂的预处理,实验操作繁琐,本研究基于以上两点选取西北地区普遍存在的廉价原料高粱为碳源,通过对其培养基进行优化发酵生产L-乳酸,解决了原材料成本高的问题,通过培养基优化进一步降低发酵成本。菌株鉴定主要有表型鉴定和基因鉴定两种方法。表型鉴定以菌株的形态特征、生理生化反应及代谢产物等为依据来鉴定菌株[7]。如BIOLOG、API50CHL和API等微生物鉴定方法,均是目前己经比较成熟的微生物鉴定体系[8]。虽然表型鉴定被广泛应用,但并不适用于所有乳酸菌鉴定。例如,它对一部分乳酸菌非常实用,但对某些乳酸菌来说,虽然表型性状很相似,但并不意味着其基因型亲源关系很近[9]。基因型鉴定有很多种类,但较为常见的为16S rRNA测序法;16S rRNA 结构既具保守性又具高变性。保守性反映生物物种的亲缘关系,高变性则揭示生物物种的特征核酸序列,是属种鉴定的分子基础[10]。因此,可以利用保守区设计通用引物扩增细菌的相应靶序列,再利用可变区的差异鉴别菌株[11]。由于此法不需进行复杂、繁琐的生理生化实验,也不需对混合菌种通过配置各种不同鉴定培养基来进行菌株分离,大大减少了实验操作步骤,且实验结果可靠,因此,成为近年来普遍应用的鉴定方法。本研究通过同时利用基因型鉴定和表型鉴定方法对菌株进行鉴定,确定菌株的种属。在培养基优化方面,通过在高梁汁中有选择性地加入几种少量的营养物从而配成最优的培养基,减少了药品的浪费,降低了培养基成本,优化了培养基配比,为更高效地发酵L-乳酸奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种 菌种A2由甘肃农业大学发酵工程实验室提供。
1.1.2 培养基 菌种活化培养基(MRS培养基,g/L):蛋白胨 10,牛肉膏 10,酵母膏 5,K2HPO42,CH3COONa·3H2O 5,柠檬酸氢二胺 2,MgSO4·7H2O 0.58,MnSO4·4H2O 0.25,吐温-80 1 mL/L,葡萄糖 20。121 ℃灭菌20 min。甜高粱:购自甘肃省民勤县甜高粱基地。
1.1.3 主要试剂及仪器 QJH-160B型榨汁机(厨具有限公司上海双蝶大溪分公司),SBA-40D生物传感器(山东省科学院生物研究所),XSP-8CA型显微镜(上海光学仪器一厂),扫描电镜(北京普瑞赛斯仪器有限公司)。乳酸菌成套生化鉴定管(青岛,海博生物公司), 爱思进基因组DNA微量试剂盒(杭州),K2HPO4、MnSO4·4H2O(AR,上海中泰),蛋白胨(北京,中科生物技术有限公司)。
1.2 方法
1.2.1 甜高粱预处理 将甜高粱秸秆通过榨汁机挤压榨汁得到甜高粱汁,过滤,-20 ℃冷藏备用。甜高粱汁中含蔗糖、果糖、葡萄糖[12],总糖含量高达19%~22%,此外,还含有少量的纤维素、蛋白质、乌头酸[13]。本研究甜高粱汁蔗糖含量为17.99 g/100 g。
1.2.2 菌种鉴定 利用DNA star、NTSYSpc Vesion 2.10、MEGA5软件进行系统发育树的构建,分析确定菌株A2的同源性。利用爱思进基因组DNA微量试剂盒提取制备菌株的16S rDNA。用于16S rDNA(核糖体DNA)扩增的引物分别为27F和1492R[14]。PCR产物通过SDS-琼脂糖凝胶电泳进行分离纯化。首先对菌株的全长16S rDNA的基因进行测序。然后将菌株的16S rDNA序列保存在基因库的数据库中并将这些序列提交到NCBI数据库,在基因文库中进行比对,最后利用比对报告(挑选同源性高于98%的序列作为参比序列),以MEGA5软件进行系统发育树的构造[15]。利用一系列生化鉴定法(革兰染色法、溶钙圈、乳酸菌成套生化鉴定管)对菌种进行进一步的鉴定。按照微生物实验手册对菌株进行革兰染色[16]。利用扫描电镜对菌体的形态进行观察。按照马蓓等[17]研究方法对菌液进行预处理,并经2次喷金后,在扫描电镜下观察菌体的形态。
1.2.3 基础培养基的优化 利用Design-expert 8.0软件的响应曲面法(RSM),根据BBD(Box-Benhnken Design)设计优化培养基组成及含量。通过4因素3水平进行实验设计。4因素分别为水/甜高粱汁、蛋白胨、K2HPO4和MnSO4·4H2O。因变量:L-乳酸/蔗糖转化率,计算公式如下:
式中,342:蔗糖相对分子量,180:葡萄糖相对分子量,v:加入一定量水的高粱液体积(L),m:未加入水的高粱液质量,L-乳酸浓度:mg/dL,蔗糖含量:17.99 g/100 g。
1.2.4 L-乳酸的发酵及测定 把菌株A2接入含甜高粱汁的最佳培养基中,在一定条件下厌氧发酵产L-乳酸。在发酵实验中,最适发酵温度37 ℃,接种体积为8%(体积分数)。L-乳酸和葡萄糖的含量用SBA-40D生物传感器测定,进样量为25 μL,测定范围:L-乳酸0~50 mg/100 mL,β-D-葡萄糖0~100 mg/100 mL,一般误差小于2%,不受颜色、混浊度等影响。
2 结果与分析
2.1 菌株A2的生理生化与分子鉴定
通过分子鉴定(16S rDNA测序)结合生理生化试验方法,最终鉴定出菌株A2的种、属。通过测序分析初步得出结论:菌株A2与LactobacillusplantarumS4(GU195645.1)同源性高达98%。对菌株A2进行革兰染色,在显微镜下观察菌株呈蓝色,可知菌株A2为革兰阳性菌(图1)。由图2可知,菌株A2在固体培养基中出现了明显的溶钙圈,说明菌株A2的确能产生乳酸。通过乳酸菌成套生化鉴定管,对菌株A2进行进一步的分析(表1),发现菌株A2在七叶苷、纤维二糖、麦芽糖、甘露醇、水杨苷、山梨醇、蔗糖、棉子糖、乳糖溶液中发生阳性反应,而在菊糖、1%马尿酸钠溶液中呈阴性反应。本研究主要通过菌株A2利用高粱汁中的蔗糖发酵生产乳酸,此鉴定方法说明了菌株A2可利用蔗糖发酵产乳酸。由图4可知,菌株A2呈杆状。由以上生化鉴定试验以及扫描电镜观察,可初步判定菌株A2为乳酸杆菌。通过分子和生化鉴定结果可知菌株A2为Lactobacillusplantarum。

图1 菌株A2通过革兰染色后的镜检图片Fig.1 Microscope picture of Gram′s stain about bacteria A2

图2 菌株A2的溶钙圈Fig.2 Soluble calcium circle of bacteria A2

表1 菌株A2的生化鉴定结果Table 1 Bacteria A2′s biochemical identification

图3 菌株A2的系统发育树Fig.3 Phylogenetic tree of microbial A2
2.2 L.plantarum发酵产L-乳酸的培养基优化
2.2.1 响应面法优化L.plantarum产L-乳酸培养基 在Ouyang等[18]、 Gao等[19]及Qin等[20]的研究中提到,降低原材料成本、寻找廉价的培养基和降低实验操作成本可以减少L-乳酸的生产成本。本研究将L.plantarum接入特定成分培养基中,通过RSM的BBD设计优化出最适宜L.plantarum发酵L-乳酸的培养基,找出此培养基中各成分(K2HPO4、MnSO4·4H2O、蛋白胨)含量的最佳配比;通过4因素3水平的响应面设计(表2)得出29组优化培养基配比(表3)。方差分析结果(表4)表明,影响L-乳酸/蔗糖转化率的显著性因素有A (水/甜高梁汁)、B(蛋白胨)、C(K2HPO4)和D(MnSO4·4H2O),说明本研究选取的4个因素是影响L-乳酸/蔗糖转化率的主要因素,其中A、B、D的影响极为明显(P<0.01)。各因素的相互影响程度可通过响应面软件的交互性分析得到说明,由表4可知:AB (水/甜高梁汁比与蛋白胨之间)、AC(水/甜高梁汁比与K2HPO4之间)、AD(水/甜高梁汁比与MnSO4·4H2O之间)、BC(蛋白胨与K2HPO4之间)的相互作用都很明显,说明4个因素之间也对菌株A2生产L-乳酸有明显的影响;其中,AB 与BC(P<0.01)的影响程度大于AC与AD(P<0.05)。此外,由表4可知,失拟检验(评估模型的拟合度)不显著,证明模型能与试验数据准确拟合;由模型显著(P<0.000 1),说明用RSM模拟的模型能很好地反映实际试验结果。 通过对BBD的实验数据进行拟合,得到一个模拟的二阶多项式方程:

图4 菌株A2在扫描电镜下的形态Fig.4 Morphology of strain A2 under scanning electron microscope
Y=42.43+7.75X1+5.12X2-2.43X3+4.41X4+7.24X1X2+4.56X1X3+3.99X1X4-6.98X2X3-0.45X2X4+7.500E-3X3X4-12.26X12+3.62X22-0.35X32-1.33
式中,X1:水/甜高梁汁(mL/mL);X2:蛋白胨 (g);X3:K2HPO4(g);X4:MnSO4·4H2O(g);Y:L-乳酸/蔗糖转化率(%)。

表2 培养基各成分在RSM实验中的代码及水平Table 2 The code and levels of various components of medium in RSM experiment
2.2.2 参数优化及验证实验 通过RSM的BBD设计,结果见表5。为了验证BBD预测结果的真实性,对最佳培养基配比进行了4组平行实验,其平均值为(48.39±1.22)%(n=4),修订后的实验结果在正常的偏差范围内(3.33),表明修改后的实际结果接近BBD的预测结果(50.32%),说明RSM模型的BBD设计与实际的实验是拟合的。通过验证得到L.plantarum的最佳培养基组分:水/甜高梁汁比为2,蛋白胨0.5 g,K2HPO41.4 g,MnSO4·4H2O 0.05 g。

表3 RSM实验设计及结果(N=29)Table 3 Experimental design and results of response surface methodology(N=29)
续表3

表4 2次多项模型及各项的方差分析结果Table 4 The analysis of variance for RSM model

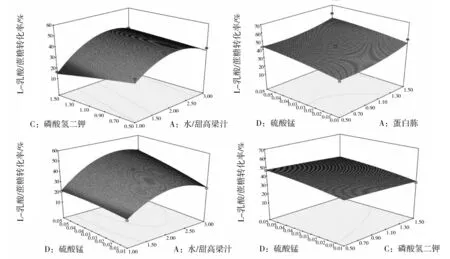
图5 不同因素对L-乳酸/蔗糖转化率影响的响应面图Fig.5 Response surface plots of L-lactic acid/sucrose conversion rate based on different factors

表5 最优条件和修正条件下L-乳酸/蔗糖转化率比较Table 5 The optimum L-lactic acid/sucrose conversion rate under different conditions
2.3 L. plantarum发酵产L-乳酸的产量及转化率
通过把L.plantarum接入已优化的培养基中,在一定的培养条件下,菌种发酵生产L-乳酸的产量在68 h时达到最大(表6),为(61.20±1.36) g/L,此时L-乳酸/葡萄糖转化率达到(90.74±2.28)%,L-乳酸/蔗糖转化率达到(47.20±1.81)%。L.plantarum的最佳培养基组成为甜高粱汁327.83 g/L,蛋白胨1.67 g/L,K2HPO44.7 g/L,MnSO4·4H2O 0.17 g/L。由此可知,L.plantarum是一种能更好地利用甜高粱汁发酵L-乳酸的优良菌种。

表6 L.plantarum在不同时间的L-乳酸发酵量及转化率Table 6 Yield and conversion rate of L-lactic acid produced by L.plantarum with fermentation time
3 讨 论
本研究以高粱汁为发酵培养基,接入一种能利用该特定培养基发酵L-乳酸的菌株,通过响应面分析法对加入该培养基的各营养物进行量的优化,最终得出最优的培养基配比。此外,还通过16S rDNA基因测序结果以及相关的生理生化实验结果,参考伯杰氏细菌鉴定手册的相关数据及菌株属性,确定菌株为L.plantarum。其最优培养基配比为甜高粱汁327.83 g/L,蛋白胨1.67 g/L,K2HPO44.7 g/L,MnSO4·4H2O 0.17 g/L。将L.plantarum接入该培养基后,得到L-乳酸产量为(61.20±1.36) g/L,L-乳酸/葡萄糖转化率为(90.74±2.28)%,L-乳酸/蔗糖转化率为(47.20±1.81)%。
Zhan等[21]报道了RhizopusoryzaeNRRL 395利用高粱中的淀粉发酵L-乳酸。由于RhizopusoryzaeNRRL 395不能直接利用高粱中的淀粉生产L-乳酸,故首先要对高粱汁中的淀粉进行液化和糖化(通过添加α-淀粉酶和淀粉葡萄糖苷酶)预处理,实验操作复杂,成本昂贵,且其报道的最高L-乳酸产量在72 h仅为32.6 g/L,远低于本研究的L-乳酸产量(68 h时,61.20±1.36 g/L的L-乳酸)。
Sule等[22]利用RhizopusoryzaeNRRL 395把角豆荚作为碳源进行L-乳酸发酵,发酵培养基需在30 ℃、150 r/min摇床培养。RhizopusoryzaeNRRL 395在含有10%(质量分数)角豆荚发酵培养基生产的L-乳酸产量仅为58 g/L。而其所需发酵时间为110 h大于本研究中最大产乳酸量时对应的68 h。这与本研究的静置厌氧培养(37 ℃)相比,其过程繁杂、耗时且最大产L-乳酸量低。
Gao等[23]也做了相关的研究,利用BacillussubtilisMUR1以葡萄糖为碳源生产L-乳酸。虽然能高效率、高收率地生产L-乳酸(产L-乳酸效率为16.1 g/L/h, 产量达183.2 g/L,底物转化率98.5%),但其发酵培养基中含有许多营养组分和微量元素,成分复杂,增加了生产成本,不利于大规模工业化生产。
虽然有许多生产L-乳酸的原料和菌种的相关研究报导,但对于主要以甜高粱汁为新型发酵培养基接入新菌种发酵L-乳酸的研究从未有过相关报道,且该研究具有高产量、低成本、实验操作简单的优点,预测其将有潜在的市场利用价值,适于大规模L-乳酸生产。

