CRP基因沉默后心肌细胞系H9c2的miR-21及其靶基因表达、细胞活力观察
程玲慧,余丽霞,叶凤英,权磊,谭文
(1华南理工大学生物科学与工程学院,广州 510006;2华南理工大学医学院;3广东工业大学生物医药研究院)
缺血性心脏病是全世界致死率最高的疾病之一[1]。缺血缺氧会造成心肌细胞不可逆转的损伤和坏死,并引起一系列剧烈的炎症反应[2]。受损的心肌组织通过炎症细胞清除伤口碎片,然而持续的炎症反应会进一步加重心肌细胞的凋亡。C反应蛋白(CRP)是一类急性反应蛋白,在感染、炎症或组织损伤的刺激下由肝脏快速合成[3]。在临床实践中,CRP一直被公认为重要的心血管疾病非特异性生物标志物。近来研究发现,以特异性的反义核苷酸降低大鼠血浆中CRP水平可以有效减少心肌梗死的面积[4]。相反地,对发生心肌梗死的小鼠皮下注射CRP可以增加心肌梗死面积,扩大心电图ST段的上升幅度[5]。CRP不仅可用于临床上对心血管疾病的早期诊断、筛查,还可作为功能性因子实质地参与心血管疾病病理变化,具有治疗相关疾病的潜能。然而,目前尚无研究直接证明CRP对心肌细胞的表型或内在分子通路产生影响。2016年6月~2018年2月,本研究通过慢病毒介导体外沉默H9c2心肌细胞的CRP基因,利用实时定量PCR分析细胞中miR-21及其下游靶基因PDCD4、PTEN和Spry1 mRNA的表达,探讨沉默CRP基因对H9c2心肌细胞中miR-21及其下游靶基因的调控作用,研究体外沉默CRP基因对H9c2心肌细胞活力的影响,为临床上治疗心血管疾病提供分子基础。
1 材料
实验所用H9c2心肌细胞购自中国科学院上海细胞所。胎牛血清、DMEM培养基和胰酶均购自Gibco公司,嘌呤霉素购自索莱宝科技有限公司。辅助包装质粒pGag/Pol、pRev、pVSV-G及转染剂Polybrene由赛业生物科技有限公司提供。ArctutusTMPicopureTMRNA Isolation Kit、TaqMan®MicroRNA Reverse Transcription kit、TaqMan®Universal Master Mix、superscript®Ⅲfirst-strand synthesis supermix for RT-qPCR和power upTMSYBR®green master mix试剂盒均购自赛默飞世尔生物公司。
2 方法与结果
2.1 沉默CRP基因载体构建与慢病毒包装 沉默CRP基因的慢病毒载体及技术支持由赛业生物科技有限公司提供。慢病毒包装采用四质粒包装系统,按说明书将1种表达质粒与3种辅助包装质粒共转染293T细胞。转染6 h后更换新鲜培养基;转染48 h后,收集病毒上清,按1 mL/支分装所获得浓缩的病毒颗粒,于-80 ℃长期保存。将浓缩的病毒颗粒按10倍倍比稀释后分别感染293T细胞,感染24 h后,更换新鲜培养基继续培养48 h,荧光显微镜下观察细胞荧光表达情况并计算病毒滴度。
2.2 H9c2心肌细胞的培养 以15% FBS的高糖DMEM培养基,于5% CO2、37 ℃培养箱中培养H9c2心肌细胞。当细胞贴壁70%~80%时,用0.08%胰酶消化约1 min,计数,以1∶2的比例传代,大约3天传代1次。取对数生长期的细胞,按3×105/孔的密度接种至6孔板内,每孔2 mL培养基,常规培养过夜。次日,细胞汇合度为50%左右,每孔细胞数约为1×106,则可以进行下一步慢病毒转染。
2.3 慢病毒转染H9c2心肌细胞 取上述待实验的H9c2心肌细胞,分为CRP沉默组和对照组。根据计算的病毒滴度,按感染复数20的病毒细胞比例加入慢病毒颗粒,其中CRP沉默组转染对CRP特异性沉默的pLV-shRNA-CRP慢病毒,对照组转染无敲减作用的pLV-shRNA-Scramble慢病毒。按5 μg/mL的最终浓度滴加转染剂Polybrene,转染后的细胞培养条件和常规培养条件相同。转染6 h后,若出现细胞毒性则立即更换新鲜培养基,若无则继续培养;转染12 h后,更换新鲜培养基。
2.4 慢病毒载体转染H9c2心肌细胞的筛选与鉴定 转染48 h后,荧光显微镜下观察绿色荧光表达情况,荧光率达到60%左右,加入含有0.25 μg/mL嘌呤霉素培养基进行筛选。嘌呤霉素筛选H9c2心肌细胞两代左右,观察细胞的荧光情况。H9c2心肌细胞可见大量绿色荧光颗粒,与同一视野下明场相比,表达绿色荧光蛋白的H9c2心肌细胞有80%以上,说明慢病毒已成功转染H9c2心肌细胞。此时用PBS溶液清洗两遍,收集细胞并利用实时定量PCR鉴定CRP基因的沉默效率。
2.5 H9c2心肌细胞CRP基因的沉默效率 采用实时定量PCR法检测。按ArctutusTMPicopureTMRNA Isolation Kit说明书从心肌细胞中提取RNA。根据superscript®Ⅲ first-strand synthesis supermix for RT-qPCR说明书合成cDNA,并利用power upTMSYBR®green master mix进行实时定量PCR。CRP上游引物5′-GCTTCTCTCAGGCTTTTGGTCA-3′,下游引物5′-GTCCCCACAATGTAGCCCTT-3′;GAPDH 上游引物5′-TCTCTGCTCCTCCCTGTTC-3′,下游引物 5′-ACACCGACCTTCACCATCT-3′。PCR反应条件:95 ℃ 2 min,循环1次;50 ℃ 2 min,95 ℃ 15 s,60 ℃ 1 min,循环40次;溶解曲线95 ℃ 15 s,60℃ 60 s,95 ℃ 15 s,循环1次。采用2-ΔΔCt法计算CRP mRNA相对表达量。CRP沉默组和对照组H9c2心肌细胞中CRP mRNA相对表达量分别为0.320±0.069、1±0.090,两组相比P<0.01。表明沉默CRP基因的H9c2心肌细胞株筛选成功。
2.6 H9c2心肌细胞miR-21表达 采用实时定量PCR法检测。按ArctutusTMPicopureTMRNA Isolation Kit说明书从心肌细胞中提取RNA,使用TaqMan®MicroRNA Reverse Transcription kit进行逆转录,TaqMan®Universal Master Mix进行实时定量。miR-21/U6引物均由赛默飞世尔生物公司提供(miR-21 Assay ID:000397,U6 Assay ID:001973)。PCR反应条件:50 ℃ 2 min,循环1次;95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,循环40次。采用2-ΔΔCt法计算miR-21的相对表达量。结果显示,CRP沉默组和对照组miR-21相对表达量分别为0.740±0.099、0.280±0.010,两组相比P<0.01。
2.7 H9c2心肌细胞PDCD4、PTEN和Spry1 mRNA表达 采用实时定量PCR法检测。按ArctutusTMPicopureTMRNA Isolation Kit说明书从心肌细胞中提取RNA。根据superscript®Ⅲ first-strand synthesis supermix for RT-qPCR说明书合成cDNA,并利用power upTMSYBR®green master mix进行实时定量PCR。所用引物由上海捷瑞生物公司合成。PDCD4上游引物5′-GAGGCAAGGGTGTCTGG-3′,下游引物5′-CGTATCTCCGTGCTCAAAG-3′;PTEN上游引物5′-TGGGAAAGGACGGACTG-3′,下游引物5′-CGCCTCTGACTGGGAAT-3′;Spry1上游引物5′-CCCAGGCTCTGCACTAGGTA-3′,下游引物5′-AGTCAGCGGAAATCTGCCAT-3′;GAPDH上游引物5′-TCTCTGCTCCTCCCTGTTC-3′,下游引物5′-ACACCGACCTTCACCATCT-3′。PCR反应条件:95 ℃ 2 min,循环1次;50 ℃ 2 min,95 ℃ 15 s,60 ℃ 1 min,循环40次;溶解曲线95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s,循环1次。采用2-ΔΔCt法计算PDCD4、PTEN和Spry1 mRNA相对表达量。CRP沉默组的PDCD4、PTEN和Spry1 mRNA表达均低于对照组(P均<0.01),见表1。
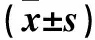
表1 两组PDCD4、PTEN和Spry1 mRNA
注:与对照组相比,*P<0.01。
2.8 H9c2心肌细胞活力检测 采用MTT法检测。按照每孔5×103的比例将H9c2心肌细胞接种于96孔板中。设置三个组别分别为空白组、对照组和CRP沉默组,每组设置4个复孔,并设置3次平行实验。培养12 h后,空白组不转染病毒加入等量的DMEM培养基,对照组转染pLV-shRNA-Scramble慢病毒颗粒,CRP沉默组转染pLV-shRNA-CRP慢病毒颗粒。转染24 h后,取出96孔板,沿着各孔孔壁轻轻加入5 mg/mL的MTT原液10 μL,于37 ℃、5% CO2的培养箱中避光孵育4 h。4 h后取出96孔板,轻轻翻转96孔板,将其倒扣在干净的滤纸上弃掉含MTT的培养基并防止紫色甲臜也被弃掉。往96孔板各孔中加入100 μL DMSO,在室温、避光条件下,溶解摇匀紫色甲臜结晶20 min。用多功能酶标仪测定570 nm波长处的吸光度,整理数据并进行分析。CRP沉默组、对照组和空白组细胞活力分别为0.78±0.030、0.66±0.010、1.00±0.013;与空白组相比,CRP沉默组和对照组细胞活力均下降(P均<0.01);与对照组相比,CRP沉默组细胞活力上升(P<0.05)。
3 讨论
缺血性心脏病是一种常见的心血管疾病,严重威胁人类健康。在心脏血流供应长期受损情况下,缺血级联反应将被激发,心肌细胞因缺血缺氧发生不可逆的坏死,导致大量心肌细胞损失,严重影响了心脏功能。此时心肌成纤维细胞增生,导致形成,发生心室重塑,心功能下降,最终可能导致心力衰竭[6]。
临床上,对CRP与冠心病、心肌梗死、心律失常等之间的关系有比较深入的研究,已证实CRP是心血管疾病非特异性的预测因子与危险因子[7]。CRP作为心血管疾病重要的炎症介质,可以诱导黏附分子在内皮细胞中表达,并在动脉粥样硬化的炎症反应中起关键作用[8]。此外,CRP损害内皮祖细胞的血管生成功能并减弱其存活和分化。Nagai等[9]证实,CRP通过炎症反应增强了压力超负荷引起的心脏重塑。在CRP转基因小鼠模型中,CRP在高血管紧张素Ⅱ条件下促进心脏纤维化和炎症反应[10]。事实上,CRP可增加大鼠新生心肌细胞缺氧诱导的凋亡和一氧化氮产生,CRP与受损心肌细胞中暴露的配体结合可导致补体系统介导的组织损伤的恶化[11]。可见,CRP不再单纯地用于临床上对疾病的早期诊断、筛查,而作为功能性因子参与心血管疾病病理变化,具有治疗相关疾病的潜能。miR-21是目前研究较为成熟的miRNAs之一[12]。miR-21的功能重要性很大程度上取决于其调控的靶基因。PDCD4、PTEN和Spry1是当前miR-21参与介导的缺血性心血管病的重要靶基因。PDCD4抑制与细胞增殖有关的转录因子的合成,从而抑制细胞存活[13]。Cheng等[14]发现,经过氧化氢处理过的心肌细胞中,PDCD4和miR-21表达明显上调。miR-21以PDCD4的mRNA作为靶标,保护心肌细胞免受缺血再复灌损伤并提高其存活率[15],在心肌细胞生长、死亡和心脏成纤维细胞功能中发挥重要作用[16]。PTEN最初作为一种肿瘤抑制因子而被发现,其自身具有磷酸酯酶特性可诱导细胞凋亡[17]。Lee等[18]在研究CRP对H9c2心肌细胞中生存素表达影响时发现,CRP可以显著增加促凋亡因子PTEN表达量。Spry1是受体酪氨酸激酶途径的保守抑制剂,可负向调控多条RTK信号途径,进而抑制细胞生长、迁移[19]。
本实验首次将炎症因子CRP和影响心血管疾病进程的重要因子miR-21联系起来,发现CRP沉默组较对照组miR-21相对表达量高,PDCD4、PTEN和Spry1 mRNA表达均低,证实沉默CRP基因可以增加H9c2心肌细胞中miR-21的表达,抑制PDCD4、PTEN和Spry1表达,与沉默CRP基因对miR-21的促进作用相呼应。本实验还发现,CRP沉默组和对照组较空白组细胞活力均下降,CRP沉默组较对照组细胞活力上升,表明沉默CRP基因可以显著增加H9c2心肌细胞活力。PDCD4和PTEN都是促凋亡因子,PDCD4抑制与细胞增殖有关的转录因子的合成;而PTEN可以抑制PI3K-Akt信号通路,调节细胞的增殖、凋亡以及迁移等。Spry1主要在心肌成纤维细胞中表达,在H9c2心肌细胞中Spry1 mRNA的表达量非常低。因此,H9c2心肌细胞活力的增加很可能和沉默CRP基因后PDCD4、PTEN表达下降有关。
综上可见,沉默CRP基因可促进H9c2心肌细胞存活,这可能与其可增加H9c2心肌细胞中miR-21表达,抑制PDCD4、PTEN和Spry1的基因表达有关。因此,CRP具有开发新型药物治疗缺血性心血管病的潜能。沉默CRP基因可能有助于减少缺血性心脏病病发生过程中的心肌细胞凋亡,从而改善心肌梗死等缺血性心脏病的预后状况,降低心肌缺血后一系列并发症的概率。但本实验只基于正常的H9c2心肌细胞,要进一步明确沉默CRP基因可以促进动物体内miR-21表达并对缺血性心脏产生保护作用,还需要建立CRP敲除动物模型和缺血模型进行更全面、深入的探究。

