下调miR-215-5p对TGF-β诱导的人肺成纤维细胞IMR-90增殖抑制作用观察
杜伟,郭丽娜,庞席宁
(1 辽宁中置盛京老年病医院,沈阳 110000;2 中国医科大学附属盛京医院;3 沈阳军区总医院浑南分院)
肺纤维化是由多种病因引起的纤维增殖性疾病,其主要特征包括成纤维细胞异常增殖、细胞外基质沉积、炎性细胞浸润等,最终会导致不可逆肺组织结构破坏和肺功能丧失[1]。目前对肺纤维化仍缺乏理想的治疗手段,西医治疗以糖皮质激素为主,但长期应用会产生明显的不良反应。中医治疗则主要采用辩证疗法,但总体来看其治疗效果仍然有限。因此,深入探讨发病机制寻找有效的作用靶点对于肺纤维化的治疗具有重要意义。miRNA是一类长度在19~25 bp的内源单链RNA分子,能够通过对其下游靶基因的调控参与多种疾病的发生、发展,包括肺纤维化[2,3]。Huang等[4]研究发现,与对照组相比,在肺纤维化组织以及博来霉素诱导的小鼠肺纤维化组织中miR-215-5p表达均明显升高,然而miR-215-5p是否与肺纤维化的发生有关以及其如何参与肺纤维化的进展仍未明确。2016年10月~2018年3月,本研究采用TGF-β处理体外培养的人肺成纤维细胞,在体外模拟肺纤维化的发病过程,观察下调miR-215-5p对TGF-β诱导的人肺成纤维细胞IMR-90增殖的影响。
1 材料与方法
1.1 材料 细胞株:人肺成纤维细胞系IMR-90购自上海中乔新舟生物科技有限公司。主要试剂:EMEM细胞培养液和胎牛血清购自美国Gibco公司;Lipofectamine2000转染试剂购自美国Invitrogen公司;阴性对照(NC)inhibitor以及miR-215-5p inhibitor购自上海吉玛制药技术有限公司;MTT试剂以及细胞周期检测试剂盒购自上海碧云天生物技术有限公司;cyclinD1抗体购自武汉三鹰生物技术有限公司;α-SMA抗体购自美国Abcam公司;RB1抗体购自生工生物工程(上海)有限公司。RNA提取试剂盒以及SYBER green master mix购自天根生化科技有限公司。
1.2 细胞培养 IMR-90细胞培养于含10%胎牛血清、100 IU/mL青霉素和100 μg/mL链霉素的EMEM培养基中,置于5% CO2、37 ℃的细胞培养箱中培养。每2~3天传代1次,取第12~20代的细胞进行后续实验。
1.3 TGF-β处理与下调miR-215-5p方法 将IMR-90细胞按照3×104个/孔的细胞密度接种至6孔板,待细胞长至80%融合时进行转染。按照Lipofectamine2000试剂盒说明书进行操作,采用终浓度为50 nmol/L的miR-215-5p inhibitor转染细胞。实验设置对照组、TGF-β组、TGF-β+NC inhibitor组、TGF-β+miR-215-5p inhibitor组。对照组正常培养;TGF-β组参考文献[5],采用10 ng/mL的TGF-β处理;TGF-β+NC inhibitor组采用阴性对照inhibitor转染24 h后采用10 ng/mL的TGF-β处理;TGF-β+miR-215-5p inhibitor组采用miR-215-5p inhibitor转染24 h后采用10 ng/mL的TGF-β处理。
1.4 细胞增殖情况观察 细胞分组及处理同1.3。按照3×103/孔的细胞密度将细胞接种至96孔板,在各组处理结束前4 h加入0.5 mg/mL的MTT试剂。分别在NC inhibitor或者miR-215-5p inhibitor转染24、48、72、96 h吸除上清液,加入100 μL的DMSO溶解细胞生成的结晶。在酶标仪上测量各组在570 nm波长处的光密度值,以此代表各组细胞的增殖情况。
1.5 细胞周期检测 细胞分组及处理同1.3。于NC inhibitor或者miR-215-5p inhibitor转染48 h,350 g离心5 min收集各组细胞,洗涤后吸除上清。加入预冷的70%乙醇,将细胞置于4 ℃固定3 h。根据试剂盒说明书进行操作,加入25 μL的碘化丙啶染色液,将细胞置于37 ℃避光孵育45 min。染色结束后采用流式细胞仪观察各组细胞周期变化情况。
1.6 细胞cyclinD1、RB1和α-SMA mRNA检测 采用荧光定量PCR法。采用试剂盒提取细胞转染48 h后各组细胞的总RNA并反转录成cDNA。在PCR反应管中加入1 μL 10倍稀释的cDNA模板,上下游引物各0.5 μL,SYBER green master mix 10 μL,用双蒸水补足总反应体积至20 μL。然后将反应管置于ExicyclerTM96 PCR仪上进行荧光定量检测。实验中用到的引物序列如下:cyclinD1正向引物为5′-AAACAGATCATCCGCAAACAC-3′,反向引物为5′-GTTGGGGCTCCTCAGGTTC-3′;α-SMA正向引物为5′-ACTGGGACGACATGGAAAAG-3′,反向引物为5′-AGATGGGGACATTGTGGGT-3′;RB1正向引物为5′-GGGTGATTCCTAAGCCACTTG-3′,反向引物为5′-TGGGTTATCAGGACTCCCACTC-3′;GAPDH正向引物为5′-ACCACAGTCCATGCCATCAC-3′,反向引物为5′-TCCACCACCCTGTTGCTGTA-3′。PCR反应条件:94 ℃ 5 min;94 ℃ 10 s,58 ℃ 20 s,72 ℃ 20 s,35个循环;72 ℃ 2 min;4 ℃ 5 min。以GAPDH为内参,采用2-ΔΔCt法计算各组目的mRNA相对表达量。
1.7 细胞cyclinD1、RB1和α-SMA蛋白检测 采用Western blotting法。收集各组转染48 h细胞,采用RIPA裂解液裂解,离心收集总蛋白,采用BCA试剂盒对蛋白进行定量。100 ℃煮沸5 min将蛋白变性后,取30 μg变性蛋白进行聚丙烯酰胺凝胶电泳,然后将蛋白电泳产物电转移至PVDF膜上。采用5%脱脂奶粉封闭蛋白后采用TTBS洗膜3次,在杂交袋中分别加入稀释一抗(cyclinD1 1∶5 000倍稀释;α-SMA 1∶5 000倍稀释;RB1 1∶1 000倍稀释;GAPDH 1∶1 000倍稀释),于4 ℃孵育过夜。TTBS洗膜后加入1∶10 000倍稀释的二抗,于37 ℃孵育1 h。采用ECL试剂盒曝光胶片,按照试剂盒说明书进行操作并计算蛋白相对表达量。
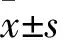
2 结果
2.1 各组细胞增殖情况比较 各组细胞增殖能力比较见表1。从转染48 h开始,TGF-β组细胞增殖能力高于对照组(P均<0.05);与TGF-β组相比,TGF-β+NC inhibitor组细胞增殖能力没有明显变化(P均>0.05);然而与TGF-β+NC inhibitor组相比,TGF-β+miR-215-5p inhibitor组细胞增殖能力降低(P均<0.05)。
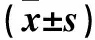
表1 各组细胞增殖能力比较
注:与对照组相比,aP<0.05;与TGF-β+NC inhibitor组相比,bP<0.05。
2.2 各组细胞周期变化情况比较 与对照组相比,TGF-β组G1期细胞比例降低,S期细胞比例升高(P均<0.05)。与TGF组相比,TGF-β+NC inhibitor组各个时期细胞比例均未发生变化(P均>0.05)。与TGF-β+NC inhibitor组相比,TGF-β+miR-215-5p inhibitor组G1期细胞比例增加,S期细胞比例降低(P均<0.05)。见表2。
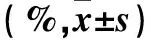
表2 各组细胞周期变化情况比较
注:与对照组相比,aP<0.05;与TGF-β+NC inhibitor组相比,bP<0.05。
2.3 各组cyclinD1、RB1和α-SMA表达比较 与对照组相比,TGF-β组cyclinD1、α-SMA表达升高,RB1表达降低(P均<0.05)。与TGF-β组相比,TGF-β+NC inhibitor组cyclinD1、RB1和α-SMA均未发生明显变化(P均>0.05)。与TGF-β+NC inhibitor组相比,TGF-β+miR-215-5p inhibitor组cyclinD1、α-SMA的表达下调,RB1表达升高(P均<0.05)。
3 讨论
肺纤维化过程中巨噬细胞及损伤的上皮细胞会释放大量的细胞因子,如TGF-β、IGF-1、PDGF等,促进成纤维细胞的增殖分化,诱导胶原的大量生成进而引发不可逆的肺部损伤[6,7]。其中,TGF-β是作用最强的致纤维化因子[8,9]。在TGF-β作用下肺成纤维细胞和间质细胞异常增生是肺纤维化的重要机制之一[10]。
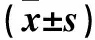
表3 各组细胞cyclinD1、RB1和α-SMA表达比较
注:与对照组相比,aP<0.05;与TGF-β+NC inhibitor组相比,bP<0.05。
本研究采用TGF-β处理肺成纤维细胞,在体外模拟了肺纤维化过程,结果显示,与对照组相比TGF-β组肺成纤维细胞增殖能力显著增强,表明在TGF-β的作用下肺成纤维细胞发生了类似肺纤维化损伤,与前人研究[5]结论一致。而与TGF-β组相比,TGF-β+NC inhibitor组细胞增殖能力无显著变化,表明转染NC inhibitor未影响肺成纤维细胞的增殖能力。而与TGF-β+NC inhibitor组相比TGF-β+miR-215-5p inhibitor组细胞增殖能力降低,说明下调miR-215-5p能够抑制TGF-β诱导的肺成纤维细胞增殖。
细胞的增殖周期有G1/S和G2/M两个关键性限制点,细胞周期蛋白cyclinD1是细胞通过G1/S限制点的重要调节蛋白[11]。在胃癌细胞中上调miR-215-5p能够显著提高细胞内cyclinD1的表达并增加S期细胞的比例;相反,抑制miR-215-5p则能够显著降低cyclinD1表达并阻碍细胞周期的进展[12]。本研究结果显示,与对照组相比,TGF-β组肺成纤维细胞G1期比例降低,S期比例升高,同时cyclinD1表达升高,表明TGF-β促进了细胞周期转换。而与TGF-β组相比,TGF-β+ NC inhibitor组细胞周期未发生显著变化,cyclinD1表达不变,表明转染NC inhibitor不影响细胞周期转换。与TGF-β+NC inhibitor组相比,TGF-β+miR-215-5p inhibitor组G1期细胞比例增加,S期细胞比例降低,cyclinD1表达降低,该结果提示下调miR-215-5p能够逆转TGF-β诱导的细胞周期转换。我们的结果与前人研究结果一致。
RB1是细胞周期的负性调控因子,该基因因为与视网膜母细胞瘤的发生密切相关而得名。RB1能够结合转录因子调节细胞增殖和分化,维持细胞生长发育的平衡[13]。在细胞内,RB1通过与E2F结合而抑制E2F的活性,进而调节细胞周期由G1期向S期的转化。抑制RB1的活性会促使细胞进入S期,促进细胞的增殖[14]。Deng等[15]研究发现,miR-215-5p能够结合于RB1的3′-UTR,抑制RB1的表达,进而影响胃癌细胞的周期转换以及细胞增殖。我们的研究结果显示,与对照组相比,TGF-β组RB1的表达显著降低,与TGF-β组相比TGF-β+ NC inhibitor组细胞RB1的表达未发生显著变化,表明转染NC inhibitor不影响细胞RB1的表达水平。与TGF-β+NC inhibitor组相比,TGF-β+miR-215-5p inhibitor组细胞内RB1表达显著降低,表明下调miR-215-5p能够促进RB1的表达。我们推测其原因可能是由于下调miR-215-5p阻碍了miR-215-5p对RB1的靶向抑制作用,进而延缓了细胞周期转换。
α-SMA是肌成纤维细胞的标志物,当肺部受损后肺成纤维细胞会向肌成纤维细胞转化,而过多的肌成纤维细胞会引起肺组织过度收缩,顺应性下降以及胶原的形成,最终导致纤维化[16,17]。在多种因素导致的肺纤维化过程中均能够检测到α-SMA的升高[18,19]。本研究结果显示,与对照组相比,TGF-β组α-SMA表达显著升高,表明TGF-β在体外引发了肺成纤维细胞向肌成纤维细胞的转化。与TGF-β组相比,TGF-β+NC inhibitor组α-SMA未发生明显变化,表明转染NC inhibitor不影响细胞中α-SMA的表达。然而与TGF-β+NC inhibitor组相比,TGF-β+miR-215-5p inhibitor组α-SMA的表达显著降低,表明下调miR-215-5p能够通过阻碍肺成纤维细胞向肌成纤维细胞的转化而缓解肺纤维化。Freytsis等[20]研究同样发现,RB1基因敲除小鼠的主动脉瓣组织中α-SMA的表达显著下降,然而其机制仍不明确。我们将在未来的研究中进一步探讨其具体机制。
综上可见,下调miR-215-5p能够抑制RB1表达进而下调cyclinD1,阻碍TGF-β诱导的肺成纤维细胞的周期转换进而抑制肺成纤维细胞的增殖;同时,下调miR-215-5p也能够抑制α-SMA的表达阻碍TGF-β诱导的肺成纤维细胞向肌成纤维细胞转化。抑制miR-215-5p具有缓解肺纤维化的潜力,miR-215-5p可以作为肺纤维化的治疗靶点。

