膦甲酸钠和苦参素注射液体外配伍稳定性考察
温海燕,宋金春
(武汉大学人民医院药学部,湖北 武汉 430060)
膦甲酸钠为非核苷类广谱抗病毒药物,体内外研究表明,能有效抑制乙型病毒性肝炎(简称乙肝)病毒DNA的复制,目前已用于慢性乙肝或重度乙肝的治疗[1]。苦参素注射液的主要成分为氧化苦参碱(含量>98%),是从中药植物苦参及苦豆子中提取的生物碱,临床主要用于慢性乙肝、肝纤维化等疾病的辅助治疗,具有一定的抗病毒作用[2]。作为《慢性乙型肝炎防治指南》唯一推荐的抗病毒中药,苦参素能有效降低乙肝病毒DNA水平,还有保护肝脏、抗肝纤维化、消炎、免疫调节等多重作用[3]。近年来的大量研究表明,苦参素和膦甲酸钠对体内外的乙肝病毒具有良好的抑制作用[4-5]。两药联用治疗重度慢性肝炎安全有效,可明显促进患者肝功能的恢复,但少数患者出现头晕、恶心、乏力等轻微不良反应[6]。本研究中对膦甲酸钠和苦参素在不同条件下体外配伍的稳定性进行了考察。现报道如下。
1 仪器与试药
1.1 仪器
WD-A型药物稳定性检查仪(天津药典标准仪器厂);LC-20AT型高效液相色谱仪(日本岛津公司);TG328A型电子分析天平(上海天平仪器厂);UV-1800型紫外分光光度计(日本岛津公司);雷磁PHS-25型pH计(上海圣科仪器设备有限公司)。
1.2 试药
膦甲酸钠氯化钠注射液(武汉大安制药有限公司,规格为每瓶250 mL∶膦甲酸钠3 g∶氯化钠2.5 g,批号为21707061-1);苦参素注射液(江苏正大天晴制药有限公司,规格为每支 2 mL∶苦参碱 0.6 g,批号为160824204);膦甲酸钠标准品(上海扶生实业有限公司,批号为FS-1490,纯度≥99%);苦参素对照品(阿拉丁试剂有限公司,批号为D1408005,规格为100 mg,纯度为98.14%);甲醇为色谱纯;四己基硫酸氢铵、磷酸二氢钠、三乙胺均为分析纯。
2 方法与结果
2.1 含量测定
2.1.1 色谱条件
色谱柱:Kromasil C18柱(150 mm ×4.6 mm,5 μm);流动相:40 mmol/L 磷酸盐缓冲液(含 0.25 mmol/mL四己基硫酸氢铵和 50 mmol/L 三乙胺,pH =7.6)-甲醇(V /V,75 ∶25);流速:1.0 mL /min;检测波长:230 nm;柱温:30 ℃;进样量:20 μL。
2.1.2 溶液制备
对照品贮备液:分别称取膦甲酸钠和苦参素对照品120 mg,精密称定,置100 mL容量瓶中,加入流动相定容至刻度,即得。
对照品配伍液:按照临床配伍,称取膦甲酸钠对照品0.3 g和苦参素对照品0.06 g,精密称定,置 25 mL容量瓶中,用流动相定容至刻度,即得。
供试品配伍液:按临床配伍,取膦甲酸钠氯化钠注射液250 mL,注入苦参素注射液2 mL,震荡混匀,即得。
2.1.3 测定波长选择
分别量取上述已配制的膦甲酸钠和苦参素对照品贮备液适量,均用流动相稀释至质量浓度为5 μg/mL,得紫外样品。在200~500 nm波长范围内进行紫外全波长扫描,分别得膦甲酸钠和苦参素的紫外光谱图,两种样品图谱交点对应波长230 nm即为高效液相色谱法的检测波长。
2.1.4 方法学考察
标准曲线制备:取对照品贮备液,采用流动相分别稀释至 2,4,5,6,8,10 倍,各取 20 μL 进样,按照 2.1 项下色谱条件测定峰面积,分别以膦甲酸钠和苦参素的质量浓度(X)为横坐标、峰面积(Y)为纵坐标进行线性回归,得回归方程,膦甲酸钠为 Y=536.81X-17 398,R2=0.999 7(n=6);苦参素为 Y =4 606.6 X-39 912,R2=0.9997(n =6)。结果表明,膦甲酸钠和苦参素质量浓度均在0.1~1.2 g/L范围内与峰面积线性关系良好。
精密度试验:分别取标准曲线制备项下质量浓度为1 g/L膦甲酸钠和0.20 g/L的苦参素对照品溶液各20μL,重复进样5次,测定峰面积,计算日内精密度;连续进样5 d,计算日间精密度。结果日内精密度的 RSD磷甲酸钠为 1.55% (n=5)、苦参素为 1.63% (n=5),日间精密度的 RSD磷甲酸钠为1.64%(n=5)、苦参素为1.71% (n =5),表明仪器精密度较好。
重复性试验:分别取膦甲酸钠氯化钠注射液和苦参素注射液,平行制备供试品配伍液6份,按2.1.1项下色谱条件进样。结果膦甲酸钠和苦参素峰面积的 RSD分别为1.43%和1.52%(n=6),表明方法重复性良好。
稳定性试验:按照2.1.2项下方法制备对照品配伍液各 5 份,摇匀。置常温下,分别于 0,2,4,6,8 h 时进样。结果膦甲酸钠和苦参素峰面积的 RSD分别为1.32% 和 1.35% (n =5),表明膦甲酸钠与苦参素对照品配伍液在室温8 h内较稳定。
加样回收试验:称取膦甲酸钠原料药和苦参素各9份,均分为3组,精密称定,置100 mL容量瓶中,每组中分别加入高(120.00%)、中(100.00%)、低(80.00%)浓度的膦甲酸钠与苦参素对照品,用流动相稀释定容,再用超纯水稀释5倍,取上述稀释溶液各20 μL,按2.1.1项下色谱条件进样测定,计算回收率。结果见表1。
2.2 配伍稳定性考察
配伍液制备:按照2.2项下制备供试品配伍液,摇匀。置不同条件下,稀释10倍后,按照2.1.1项下色谱条件进样20 μL,考察不同条件对膦甲酸钠和苦参素配伍液的影响。
不同条件下配伍液图谱:取2.1.1项下供试品配伍液,分别置强光照射、高温(60℃)条件下放置8 h后进样,观察图谱变化。结果见图1。
配伍液的外观及pH变化:将供试品配伍液分别置4 ℃、(23 ±2)℃ (室温)及 45 ℃ (高温)条件下,分别于0,8,12,24,48,72,96,120,168,240,360 h 时观察上述配伍液外观是否有浑浊、沉淀、云状物、气泡、变色[控制条件,相对湿度(25±5)%,避光]。结果在 15 d内配伍液澄清,无浑浊、变色现象,未发生沉淀。在上述不同时间配伍液的pH变化见表2。
配伍液含量变化:分别在 0,2,4,8,24,48,72,96,120,168,240,360 h时抽取上述供试品配伍液,用超纯水将抽取液稀释5倍,照2.1.1项下色谱条件进样测定,计算配伍溶液中2种药物的含量。在4℃条件下,样品含量较稳定,经过15 d后仍大于90%;而在室温及45℃条件下,样品含量开始下降,且在15 d内含量小于90%,认为其含量不稳定。在4℃,(23±2)℃和45℃下,膦甲酸 钠质量浓度分别为 (2.29 ±0.07)g/L,(2.26 ±0.08)g/L,(2.18 ±0.11)g/L,苦参素质量浓度分别为 (0.45 ±0.02)g/L,(0.45 ±0.01)g /L,(0.44 ±0.02)g/L。相对百分含量见表 3。

表1 加样回收试验结果(n=9)

图1 不同条件下配伍液高效液相色谱图
3 讨论
3.1 流动相选择
参考文献[7-9],对不同的液相条件进行检测,对流动相的条件进行选择和调整,最终选择文中所用流动相。其中四己基硫酸氢铵作为离子对试剂,能有效与膦甲酸钠结合,使其在色谱柱上能有效保留;而加入三乙胺,能减少苦参素的拖尾,改善峰形。在此条件下,可以获得较满意的峰形,出峰时间适宜,且膦甲酸钠和苦参素分离度较好,可同时测定两者的含量。

表3 膦甲酸钠与苦参素配伍相对百分含量变化试验结果(n=3)
3.2 不同条件对峰形和保留时间的影响
由于药品通常于避光、阴凉环境下保存,而在配伍制备的过程中,通常会受到光照、温度等不同环境因素的影响。因此,对高温(60℃)、强光照条件下放置8 h的样品进行观察,结果表明,在以上条件下,色谱峰的保留时间和峰形均未受影响。
3.3 不同条件对配伍含量的影响
在药物配伍过程中,时间、温度等条件的改变,易使其稳定性和含量发生变化,从而影响其药理和生化活性[10]。一般来说,随着时间的延长和温度的升高,由于可能产生的化学或物理变化会导致其稳定性和药物含量下降,故需对其长期稳定性进行考察[11]。上述试验结果表明,两者配伍液在4℃条件下含量变化较稳定,而在室温和45℃条件下药物含量明显下降,提示两者配伍应保存于低温条件下尽快使用。
综上所述,膦甲酸钠和苦参素按临床常用剂量进行配伍,稳定性较好,液体澄清,pH稳定。但本研究中仅对物理化学变化做了初步探究,未对其长期使用的微生物等生物污染进行考察,故在临床应用中需现配现用。
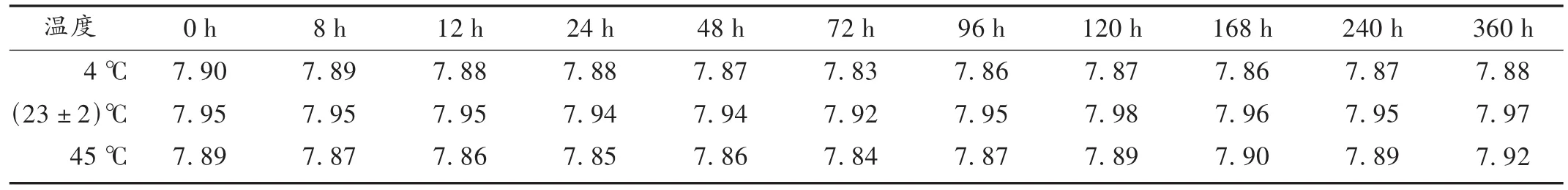
表2 膦甲酸钠和苦参素配伍液不同温度条件下不同时间pH测定结果(n=5)

