川芎嗪防治大鼠重症急性胰腺炎肾损伤机制研究
牟燕飞 ,穆小松 ,唐显军 ,杨 燕 ,胡 敏
(1.重庆大学附属肿瘤医院·重庆市肿瘤研究所·重庆市肿瘤医院,重庆 400030; 2.中国人民解放军第三二四医院,重庆 400020)
重症急性胰腺炎(SAP)属急性胰腺炎(AP)的特殊类型,占AP的10% ~20%,具有病情发展迅速、并发症多、病死率高的特点,其发生、发展与抗炎因子、促炎因子、蛋白酶及蛋白酶抑制剂、细胞凋亡等密切相关[1-2]。李聃等[3]研究发现,AP患者的胃肠道、血清中存在的大量炎性介质,参与了SAP发生与演变的整个过程,并可使单核巨噬细胞、中性粒细胞及内皮细胞过度激活,从而引起体内废物、毒物代谢异常,导致肾脏损伤和加重微循环障碍。因此,改善微循环和抑制炎性介质的释放对SAP至关重要。目前很多学者提出,川芎嗪具有钙通道阻滞剂的作用,可有效阻滞细胞外钙内流,抑制炎性介质释放,改善细胞凋亡与微循环障碍[4]。基于此,本研究中将川芎嗪用于SAP模型大鼠的治疗中,以观察川芎嗪能否通过调节细胞凋亡和炎性介质的释放而防治大鼠SAP导致的肾损伤。现报道如下。
1 材料与方法
1.1 动物、仪器与试药
84只健康雌性SD大鼠,体质量180~260 g(四川省医学实验中心)。7170A型全自动生化分析仪(日本日立公司);DG5031型酶联免疫检测仪(上海医疗仪器设备厂)。川芎嗪注射液(遂成药业股份有限公司,国药准字 H20043412,规格为每支2 mL∶40 mg);牛磺胆酸钠(上海研生实业有限公司);原位细胞凋亡、白细胞介素6(IL-6)、白细胞介素 10(IL-10)、肿瘤坏死因子 - α(TNF-α)等试剂盒均购自上海心语生物科技有限公司。
1.2 方法
将84只大鼠随机均分为对照组、SAP组、川芎嗪组,各28只。所有大鼠均禁食但不禁饮 12 h,后用2.5%戊巴比妥钠溶液腹腔注射麻醉。对照组开腹后翻动胰腺,即缝合关闭腹腔。SAP组大鼠上腹正中切口进腹,提起胃、十二指肠,找到胰管开口,于开口下15 mm处切开十二指肠,并置入无菌塑料管;分别结扎胰管开口远端、近端,以形成20 mm左右的十二指肠闭袢;向闭袢内注入5%牛磺胆酸钠0.3 mL,使整个胰腺均匀隆起后退出针头;5~10 min见胰腺出现肉眼可见的水肿出血,则表示SAP动物模型建模成功,随即缝合关闭腹腔。川芎嗪组在动物模型制作成功后,立即给予0.6%川芎嗪注射液,腹腔注射,用量为每100 g体质量1 mL。对照组、SAP组给予等量生理盐水腹腔注射。
于术后6,12,24,48 h相应时间点每组各随机选取5只大鼠处死,开腹观察胰腺和肾脏形态,吸取腹腔积液并计量,观察其颜色与浑浊度。取胰腺组织以10%福尔马林溶液固定,行苏木素-伊红(HE)染色。取左肾组织迅速置液氮中,-80℃保存。经心脏穿刺采血4 mL,室温下静置30 min凝固后,4℃下以3 000 r/min的速率离心10 min,-20℃保存。
1.3 观察指标
测定不同时间的腹腔积液量;胰腺组织病理评分:将经福尔马林溶液固定的胰腺组织按常规流程进行石蜡包埋、切片,HE染色,光镜下观察,并根据Kusske法[5]进行病理评分;炎性介质:将-20℃保存的标本于室温复融,根据IL-6,IL-10,TNF-α试剂盒说明分别配置标准品,再使用DG5031型酶联免疫检测仪进行检测;肾损伤相关指标:取500 μL血清,用全自动生化分析仪检测淀粉酶、尿素氮(BUN)、肌酐(Cr);肾脏组织细胞凋亡指数:参照原位细胞凋亡试剂盒说明书进行检测,显色使用DAB试剂盒进行。在光镜下,肾脏细胞核中有棕黄色颗粒即为阳性细胞,在阳性表达分布区域、200倍光镜下随机选择5个无重叠视野,计数阳性细胞。细胞凋亡指数(AI)为凋亡阳性细胞数占总细胞数的百分比。
1.4 统计学处理
全部数据初步以 EpiData 3.1软件校正,采用SPSS 22.0统计学软件进行处理。计量资料以±s表示,行 t检验。P<0.05为差异有统计学意义。
2 结果
结果见表1至表5。
3 讨论
SAP的发展常累及机体多个重要脏器,并伴大量炎性介质的释放,可在较短时间内引发瀑布样级联反应,使肾脏无法正常代谢机体废物、毒物,最终导致全身性炎性反应综合征,甚至死亡[6]。本研究结果显示,3组大鼠不同时间点的腹腔积液量两两比较有明显差异(P<0.05),表明川芎嗪能有效控制SAP的发展,减轻胰腺组织的进一步损伤。川芎嗪是从川芎中提取的吡嗪生物碱,具有抗血小板聚集、扩张小动脉、改善微循环等作用,对促进炎性介质代谢、抑制炎性细胞因子的释放有重要价值[7]。本研究结果显示,SAP组与川芎嗪组术后6,12,24 h的水肿、炎症、出血、坏死评分比较无明显差异(P>0.05),但川芎嗪组术后48 h的评分均明显低于 SAP 组(P<0.05),且川芎嗪组与对照组术后 6,12,24,48 h的 IL-6 比较无明显差异(P>0.05),表明川芎嗪在抑制巨噬细胞释放炎性因子,降低SAP大鼠炎症水平的同时,也可减轻胰腺病理性改变,从而提高SAP的治疗效果,这与母传贤等[8]的研究结论相似。
表1 3组大鼠胰腺组织病理评分、炎性介质及肾损伤相关指标比较(±s,n=5)
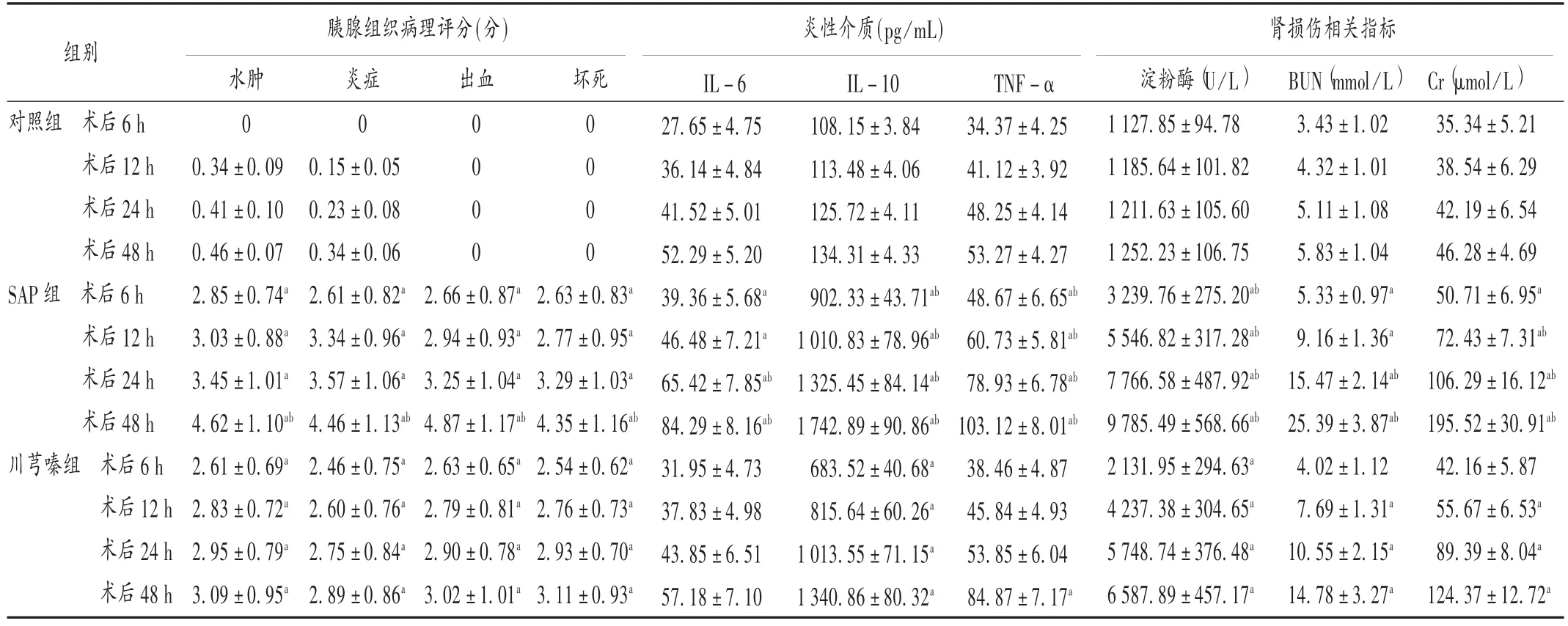
表1 3组大鼠胰腺组织病理评分、炎性介质及肾损伤相关指标比较(±s,n=5)
注:与对照组同时点比较,aP<0.05;与川芎嗪组同时点比较,bP<0.05。下表同。
胰腺组织病理评分(分) 炎性介质(pg/mL) 肾损伤相关指标组别出血 坏死对照组 术后6 h术后12 h术后24 h术后48 h SAP组 术后6 h术后12 h术后24 h术后48 h川芎嗪组 术后6 h术后12 h术后24 h术后48 h 2.63 0 0 0 0 ±0.83a 2.77 ±0.95a 3.29±1.03a 4.35 ±1.16ab 2.54 ±0.62a 2.76±0.73a 2.93 ±0.70a 3.11±0.93a水肿0 0.34 ±0.09 0.41 ±0.10 0.46±0.07 2.85 ±0.74a 3.03 ±0.88a 3.45±1.01a 4.62 ±1.10ab 2.61 ±0.69a 2.83±0.72a 2.95 ±0.79a 3.09±0.95a炎症0 0.15 ±0.05 0.23 ±0.08 0.34±0.06 2.61 ±0.82a 3.34 ±0.96a 3.57±1.06a 4.46 ±1.13ab 2.46 ±0.75a 2.60±0.76a 2.75 ±0.84a 2.89±0.86a 0 0 0 0 2.66 ±0.87a 2.94 ±0.93a 3.25±1.04a 4.87 ±1.17ab 2.63 ±0.65a 2.79±0.81a 2.90 ±0.78a 3.02±1.01a IL-6 27.65±4.75 36.14 ±4.84 41.52±5.01 52.29 ±5.20 39.36 ±5.68a 46.48±7.21a 65.42 ±7.85ab 84.29 ±8.16ab 31.95±4.73 37.83 ±4.98 43.85 ±6.51 57.18 ±7.10 IL-10 108.15±3.84 113.48 ±4.06 125.72±4.11 134.31 ±4.33 902.33 ±43.71ab 1 010.83±78.96ab 1 325.45 ±84.14ab 1 742.89 ±90.86ab 683.52±40.68a 815.64 ±60.26a 1 013.55 ±71.15a 1 340.86 ±80.32a TNF-α 34.37±4.25 41.12 ±3.92 48.25±4.14 53.27 ±4.27 48.67 ±6.65ab 60.73±5.81ab 78.93 ±6.78ab 103.12 ±8.01ab 38.46±4.87 45.84 ±4.93 53.85 ±6.04 84.87 ±7.17a淀粉酶(U /L)1 127.85 ±94.78 1 185.64 ±101.82 1 211.63 ±105.60 1 252.23±106.75 3 239.76 ±275.20ab 5 546.82 ±317.28ab 7 766.58±487.92ab 9 785.49 ±568.66ab 2 131.95 ±294.63a 4 237.38±304.65a 5 748.74 ±376.48a 6 587.89±457.17a BUN(mmol/L)3.43 ±1.02 4.32 ±1.01 5.11 ±1.08 5.83±1.04 5.33 ±0.97a 9.16 ±1.36a 15.47±2.14ab 25.39 ±3.87ab 4.02 ±1.12 7.69±1.31a 10.55 ±2.15a 14.78±3.27a Cr(μmol/L)35.34 ±5.21 38.54 ±6.29 42.19 ±6.54 46.28 ±4.69 50.71 ±6.95a 72.43 ±7.31ab 106.29 ±16.12ab 195.52 ±30.91ab 42.16 ±5.87 55.67 ±6.53a 89.39 ±8.04a 124.37 ±12.72a
表2 3组大鼠不同时间腹腔积液量比较(±s,mL,n =5)

表2 3组大鼠不同时间腹腔积液量比较(±s,mL,n =5)
组别对照组SAP组川芎嗪组术后6 h 0 3.45 ±1.09ab 2.03 ±0.92a术后12 h 0 3.96 ±1.12ab 2.24 ±0.96a术后24 h 0 4.21 ±1.05ab 2.46 ±1.01a术后48 h 0.51 ± 0.19 4.68 ± 1.07ab 2.72 ± 1.03a
表3 3组大鼠肾脏组织细胞凋亡指数比较(±s,%,n=5)

表3 3组大鼠肾脏组织细胞凋亡指数比较(±s,%,n=5)
组别对照组SAP组川芎嗪组1.19 ± 0.42 5.36 ± 1.12ab 3.73 ± 0.94a 1.31 ± 0.44 10.06 ± 1.15ab 6.44 ± 0.98a 1.38 ± 0.46 14.16 ± 1.79ab 9.04 ± 1.81a 1.43 ±0.40 18.09 ±2.17ab 11.52 ± 2.13a术后6 h 术后12 h 术后24 h 术后48 h
SAP肾损伤是导致SAP患者死亡的主要因素。本研究中通过对血清淀粉酶、BUN、Cr的分析可知,SAP大鼠均存在不同程度的肾脏损伤,且随着时间的推移不断加重。这不仅促使微循环阻力增大,血液瘀滞,也会增强中性粒细胞的趋化作用,刺激中性粒细胞黏附于血管内皮而出现颗粒状脱落,进而促进自由基生成及IL-10,TNF-α等炎性介质释放;并加重局部组织损伤,增加毛细血管通透性,导致血流灌注下降,组织缺氧坏死[9-10]。因此,借助川芎嗪的作用机制降低大鼠炎性介质水平,能缓解大鼠的肾损伤,使血清淀粉酶及BUN、Cr显著下降[11]。肾脏损伤与细胞凋亡呈正相关,若细胞被广泛破坏,细胞膜磷脂将过度氧化,酶、蛋白质、核酸等随之变性,致机体处于严重的应激状态[12]。廖雯靓[13]指出,肾小管上皮细胞与急性肾衰竭早期就可出现凋亡现象,故调控细胞凋亡对改善SAP预后,保护肾脏组织,降低死亡率至关重要。本研究结果显示,3组大鼠术后6,12,24,48 h的肾脏组织细胞凋亡指数均呈增高趋势,对照组各个时间点均明显低于川芎嗪组和SAP组,且川芎嗪组各个时间点均较SAP组明显下降。提示川芎嗪可通过对抗大鼠体内自由基的氧化,改善肾血管灌注,达到保护肾小管上皮细胞及减少凋亡的目的[14]。
综上所述,川芎嗪能增加溶酶体膜的稳定性,扩张肾毛细血管,增加肾血流量,缓解组织缺血、缺氧状态,加快机体代谢。但AP发病机制复杂,受多种致病因素影响,川芎嗪对胰腺、肾脏之外的组织器官是否有保护作用,有待进一步研究。

