彩色多普勒超声参数结合MELD积分对预测食管曲张静脉套扎后不良事件的作用研究
魏 倩
成都医学院第一附属医院 超声科(成都610500)
食管曲张静脉套扎(esophageal variceal ligation,EVL)是食管曲张静脉出血的重要治疗手段,但EVL后再出血风险大。Child-Turcotte-Pugh(CTP)评分是临床广泛应用的预测急性曲张性出血危险分层的重要指标[1]。MELD模型是判断晚期肝病病情的评分方式, 最初用于肝移植患者等待名单筛选,有研究[2]发现,此模型可准确预测终末期肝病患者近期病死率。虽然肝静脉压力梯度(hepatic venous pressure gradient,HVPG)在门静脉高压症的诊断、并发症发生风险预测和预后评估等方面均有重要价值,但其由于有创、检查费用昂贵等原因,在临床应用中受较大限制。彩色多普勒超声作为无创检测方法能准确测定门静脉及相关血管的内径、流速及血流量等指标,其中门静脉内径与HVPG呈独立正相关,可用于临床评估肝静脉压力梯度[3]。因此,本研究采用MELD模型结合彩色多普勒超声测量门静脉内径、血流量,探讨其预测和评估EVL后再出血风险的价值,现报道如下。
1 资料与方法
1.1 临床资料
2015年1月至2017年10月,将成都医学院第一附属医院因单纯食管静脉曲张破裂出血且经内镜行EVL的肝硬化患者共124例作为研究对象。纳入标准:1)符合EASL临床实践指南有关肝硬化诊断标准;2)本研究患者及家属均签署知情同意书;3)患者EVL后持续静脉使用生长抑素及其拟似物或血管加压素;4)均使用抗生素预防术后感染。排除标准:1)经胃镜检查无法确定出血病因的肝硬化患者;2)确诊有肝细胞癌,已行TIPS治疗,脾栓塞治疗和外科分流或断流手术的患者;3)既往有肝胆疾病行外科手术导致肝脏解剖变异者;4)伴有胃底静脉曲张或单发胃底静脉曲张;5)特发性门静脉高压症。 患者基本临床资料包括性别、年龄、Child分级等(表1)。

表1 患者一般情况[(n%),±s]

项目Child分级A级B/C级MELD积分≥18PVD/cmPVV/(cm/s)PV-CI /(cm·s)构成比/值15(12.1) 109(87.9)78(62.9)1.05±0.3818.85±4.080.075±0.012
1.2 方法
1.2.1 研究方案 计算EVL前MELD分值及门静脉充盈指数。 设定EVL后21 d为观察终止点,记录临床疗效:未再出血、再出血。
1.2.2 MELD计算公式 MELD分值=3.8×loge[胆红素(mg/dL)]+11.2×loge(INR)+9.6×loge[肌酐(mg/dL)]+6.4×(病因: 胆汁性或酒精性为0; 其他为1)[4].
1.2.3 彩色多普勒超声门静脉充盈指数的测量 超声诊断仪采用美国GE LOGIQ E9。禁食8 h以上,遵循腹部血管检查标准,调节时间增益,使用低脉冲重复频率,置样框于血管管腔中央,调整直径为2~3 mm,声束与血流夹角≤60°。分别测定门静脉内径(portal venous diameter,PVD)、门静脉流速 (portal venous velocity,PVV),用门静脉横截面积除以PVV计算门静脉充血指数(portal venous congestion index,PV-CI) 。
1.2.4 EVL术后早期再出血定义 EVL术后24 h起至术后14 d 内的再发呕血或黑便,或胃管内抽出血性液体,且血红蛋白、红细胞压积进行性下降,或临床上有低血容量休克证据,或有出血表现需要输血者[5]。
1.3 统计学方法

2 结果
2.1 基本情况
所有患者中,有45例进行术前输血,均行内镜下EVL治疗。EVL后3周内共47例(37.9%)发生再出血,其中有3例(4.1%)死亡,余77例未出现呕血及便血。
2.2 EVL后3周内再出血的危险因素分析
相关性分析发现,MELD积分≥18,PV-CI≥0.11 cm·s,术前输血与再出血风险明显相关(P< 0.05),而性别、年龄、Child分级与再出血风险无明显相关性(P>0.05)(表2) 。
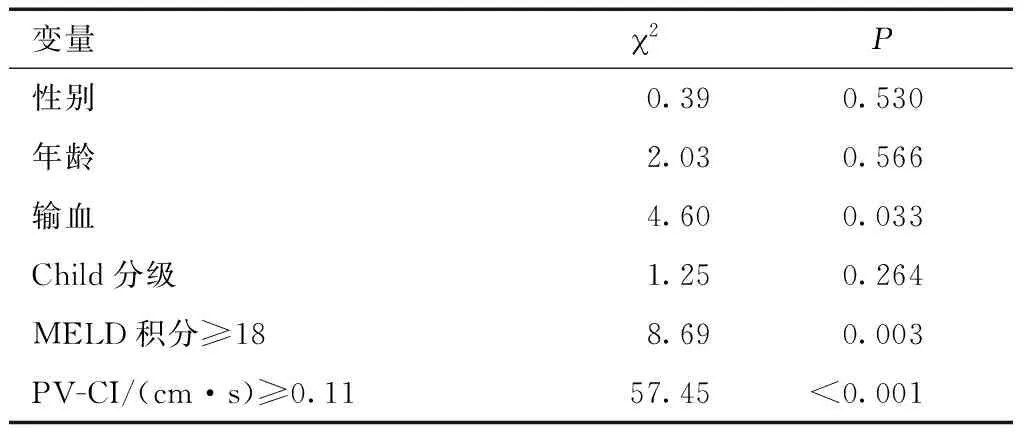
表2 变量相关性分析
2.3 MELD积分≥18联合PV-CI≥0.11 cm·s对再出血风险的预测
MELD积分≥18联合PV-CI≥0.11 cm·s相较MELD积分≥18或PV-CI≥0.11 cm·s单独出现而言,再出血概率更大(OR=55.94)(术前输血在引入模型后并未改善其拟合度,且系数无统计学意义,故不纳入模型)(表3)。

表3 模型参数估计
2.4 EVL后3周内死亡危险因素分析
变量分析发现,MELD积分≥18,PV-CI≥0.11 cm·s,Child分级,年龄,术前输血与3周内病死率均不相关(P>0.05),在拟合Poisson模型后各变量的参数也没有统计学意义,此种情况与死亡例数过少(仅3例)有关。
3 讨论
食管静脉曲张是肝硬化门静脉高压症最常见、最危险的并发症之一,EVL是控制和预防食管静脉曲张破裂出血的主要措施,但术后3周内的早期再出血仍是临床上难以克服的致命性并发症。HVPG是肝静脉和下腔静脉间的压力差,被认为是诊断肝硬化门静脉高压症的金标准,>13.57 cm H2O时可出现门静脉高压症的表现[6]。一般认为16.28 cm H2O是发生静脉曲张破裂出血的阈值,当HVPG较基线值下降>20%,再出血风险明显下降[7]。尚罕有HVPG与EVL术后早期再出血相关的文献报道。有研究通过测定HVPG的方式预测EVL后早期再出血,从而对患者进行治疗和预防,研究[8]发现,HVPG=16.98 mm Hg为预测再出血的阈值,且在该时间内的预测准确性最高,认为HVPG对EVL术后早期再出血具有预测价值。但由于HVPG有侵人性、风险大、价格高和随访困难等问题,限制了其在临床上的广泛应用,故迫切需要寻找能预测食管静脉曲张程度及出血的非侵入性指标。
多普勒超声是一种无创、简单、经济的检查方法。既往研究[9]发现,用彩色多普勒超声测定可预测食管曲张静脉出血的危险性,但由于技术设备的限制和检查医生的主观性较大,客观性较差,故不是最佳的预测模型。最近的研究[10]发现,肝硬化患者肝静脉减振指数(damping index of hepatic vein,HV-DI)、肝静脉渡越时间(hepatic vein arrival time,HVAT )等超声参数的变化与HVPG相关,但鲜见应用上述指标预测食管曲张静脉套扎后再出血风险的研究。
有研究[11]表明,PV-CI 与HVPG 呈正相关,有食管静脉曲张的患者PV-CI值显著升高,而PV-CI值越小,发生食管静脉曲张的可能性就越小。时晨等[12]研究除证实上述研究外,还指出PV-CI截断值为0.11时预测中-重度食管静脉曲张程度的特异性达100%,提示了PV-CI可作为预测食管静脉曲张存在及其程度的无创性指标。本研究发现,3周内47例发生再出血的患者中PV-CI≥0.11 cm.s占41例,接近时晨等[12]的研究结果,但其研究是针对未行EVL治疗的食管曲张静脉患者,与本研究对象有差异。
MELD模型具有简单可行、重复性好、客观性强的特点,其与Child肝功能分级在评价肝硬化患者短、中期存活率中的价值目前尚无定论[13-14]。食管静脉曲张破裂出血与再出血的危险性与肝病的严重程度关系密切。与国内外的大多数研究结果相同,Bambha研究[15]认为,MELD≥18是再出血的强有力预测指标。申振宇等[16]研究发现,随着MELD积分升高,再出血率和病死率随之增高。有研究[17]认为,MELD模型在预测3个月内再出血率上并不优于Child-Pugh评级。本研究发现,MELD模型积分仅和EVL后再出血的风险相关,证实MELD模型是EVL后短期内(3周内)再出血风险的预测价值的客观指标,MELD积分(≥18)越高,则再出血和死亡的风险就越高;联合彩色多普勒超声检查测量计算PV-CI≥0.11 cm.s具有更高的预测价值。MELD模型联合PV-CI≥0.11 cm.s可更好地预测EVL后近期再出血的风险。
综上所述,食管急性曲张性静脉出血患者MELD积分≥18且PV-CI≥0.11cm·s, EVL 后3周内再出血的风险增加,MELD积分与彩色多普勒超声检查结合可有效预测EVL后近期内再出血的风险。