锌原卟啉-9腹腔注射对脑出血大鼠神经功能的改善作用及其机制
吴丹,张曼青,殷小平,周君,陈志颖,鲍兵
(1江汉大学附属医院 武汉市第六医院,武汉 430015;2九江学院基础医学院;3九江学院附属医院;4上海交通大学附属第六人民医院)
脑出血(ICH)是指原发性非外伤性脑实质出血,临床表现为头痛、癫痫及神经功能缺损,有较高的发病率和致死率[1,2]。ICH后继发的脑组织损伤是影响患者预后、转归的关键因素[3],而炎症因子及自由基的瀑布式产生对ICH后继发性脑损伤起决定性作用[4,5]。现有的治疗不能很好地控制ICH后继发性脑损伤的发展。研究[6]发现,血红素加氧酶-1(HO-1)在中枢神经细胞(神经元及胶质细胞)中广泛表达,是核转录因子2(Nrf2)-抗氧化反应元件(ARE)信号通路下游的重要抗氧化及解毒蛋白,对ICH后继发性脑损伤具有抗炎症反应、减轻氧化应激损伤、抑制细胞凋亡等神经保护作用。本研究运用HO-1的选择性抑制剂锌原卟啉-9(ZPP-Ⅸ)抑制HO-1表达,观察用药后Nrf2-ARE通路上下游蛋白Nrf2、NF-κB、TNF-α等表达的变化及神经功能评分差异,探讨HO-1对ICH灶周神经保护作用的机制,为ICH后继发性脑损伤治疗提供新的实验理论依据。
1 材料与方法
1.1 实验动物及分组 95只普通级雄性SD大鼠,购买于湖南斯莱克景达实验动物有限公司[证书编号:SDXK(湘)2009-0004],质量250~300 g。按随机双盲原则分成ZPP-Ⅸ组(30只)、ICH组(30只)、DMSO组(30只)、正常组(5只)。
1.2 主要试剂 ZPP-Ⅸ(50 mg ZPP-Ⅸ溶于35%DMSO,终浓度10 mg/mL,给药剂量10 mg/kg);DMSO一抗:Anti-Nrf2兔来源多克隆抗体,Anti-HO-1兔来源多克隆抗体,NF-κB兔来源单克隆抗体,TNF-α兔来源单克隆抗体,Anti-CD-11b兔来源多克隆抗体,β-actin兔抗大鼠单克隆抗体(70-Mab1445);二抗:羊抗小鼠多克隆抗体带Cy3荧光素,羊抗兔多克隆抗体带FITC荧光素;Odyessy二抗(1∶15 000);SDS-PAGE凝胶配制试剂盒;DAPI染色试剂;硝酸纤维素膜(NC膜,0.45 μm);BCA试剂盒;蛋白酶抑制剂cocktail;上样缓冲液。
1.3 ICH模型制备及ZPP-Ⅸ给予方法 参照文献[7]的方法将ZPP-Ⅸ组、ICH组、DMSO组大鼠于脑立体定位仪上缓慢注射自体股动脉血50 μL至基底节区,制备ICH模型;正常组大鼠于相同部位打孔进针,不注血。参照Gareia18分测评法[8],将神经功能缺陷评分≥3分及脑切片中有明显的圆形、椭圆形或不规则的血肿存在定义为模型制备成功标准;血液沿针道反流、流入脑室或死亡者均剔除,剔除后补充相当数量并制模成功的大鼠。ZPP-Ⅸ组在制模后30 min内腹腔注射10 mg/kg ZPP-Ⅸ[9],DMSO组给予10 mg/kg的35%DMSO,正常组、ICH组均给予等量生理盐水。
1.4 大鼠神经功能评价 采用Gareia18分测评法评价制模前24 h及制模后6 h、12 h、24 h、48 h、72 h、7 d大鼠神经功能,共分为6项,即自发活动、轻瘫试验、前肢运动、加强运动功能、痛觉、深感觉,神经功能缺损最严重计0分,无神经功能缺损计18分。
1.5 大鼠脑组织Nrf2、binding-Nrf2、HO-1、NF-κB、TNF-α蛋白检测 取各组大鼠,于制模后6 h、12 h、24 h、48 h、72 h、7 d麻醉开胸,迅速暴露心脏,从左心室插管至主动脉根部,在右心耳剪开一小口做出口,4 ℃生理盐水200 mL灌注后至流出液体清亮,换4%多聚甲醛灌注固定至老鼠肢体僵硬;断头取脑,脑组织迅速放入液氮(-80 ℃)中速冻,最后用锡纸包好保存于-80 ℃冰箱中备用。将大脑从-80 ℃冰箱中取出,迅速取血肿灶周3 mm脑组织,采用Western blotting法检测Nrf2、binding-Nrf2、HO-1、NF-κB、TNF-α蛋白。最后红外线双色激光成像分析机扫描NC膜后得到的图像,用Odyessy Version3.0软件分析,计算目的蛋白与β-actin灰度值比值。
1.6 大鼠脑组织Nrf2、HO-1、NF-κB、TNF-α mRNA检测 大鼠处死以及标本获取方法同“1.5”,采用RT-PCR法检测制模后6 h、12 h、24 h、48 h、72 h、7 d脑组织Nrf2、HO-1、NF-κB、TNF-α mRNA。
1.7 大鼠脑组织Nrf2、HO-1、NF-κB、TNF-α与小胶质细胞(CD11b标记)共染阳性细胞数计数 大鼠处死以及标本获取方法同“1.5”,大鼠大脑从-80 ℃冰箱取出,在预冷的多聚甲醛中固定20~30 min,再行切片(5 μm),然后采用免疫荧光双标法检测Nrf2、HO-1、NF-κB、TNF-α蛋白与小胶质细胞共表达情况。Optpro成像分析系统扫描、图像分析。取ICH灶周范围内观察在200倍视野下计数5个不重复视野,得出5个视野的平均数。

2 结果
2.1 各组不同时点神经功能评分比较 结果见表1。
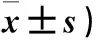
表1 各组不同时点神经功能评分比较(分,
注:与正常组比较,*P<0.05;与ICH组比较,△P<0.05;与DMSO组比较,▲P<0.05。
2.2 各组制模后不同时点binding-Nrf2、Nrf2、HO-1、NF-κB、TNF-α蛋白表达比较 结果见表2。

表2 各组制模后不同时点binding-Nrf2、Nrf2、HO-1、NF-κB、TNF-α蛋白灰度值比较
注:与正常组比较,*P<0.05;与ICH组比较,△P<0.05;与ZPP-Ⅸ组比较,▲P<0.05。
2.3 各组制模后不同时点Nrf2、HO-1、NF-κB、TNF-α mRNA表达比较 结果见见表3。
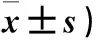
表3 各组制模后不同时点Nrf2、HO-1、NF-κB、TNF-α mRNA表达比较(灰度值,
注:与正常组比较,*P<0.05;与ICH组比较,△P<0.05。
2.4 各组制模后不同时点Nrf2、HO-1、NF-κB、TNF-α蛋白与CD11b共染阳性细胞数比较 结果见表4。
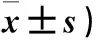
表4 各组制模后不同时点Nrf2、HO-1、NF-κB、TNF-α蛋白与CD11b共染阳性细胞数比较(个,
注:与ZPP-Ⅸ组比较,△P<0.05。
3 讨论
ICH后众多因素参与了继发性脑损伤的形成,其中灶周炎症反应与炎症因子的释放被认为是造成继发性脑损伤的主要原因。Nrf2-ARE信号通路是内生的重要的抗氧化、抗炎症反应的通路[10],HO-1是其下游重要的抗氧化蛋白,调控其表达是否会影响其上游的激活,目前暂没有研究报道。ZPP-Ⅸ作为HO-1选择性抑制剂,被广泛用于Nrf2-ARE-HO-1信号通路的离体、在体研究[11,12]。
本课题小组前期及既往研究[10,13]发现,Nrf2的激活剂莱菔硫烷可抑制炎症反应,减轻神经功能损伤,提高下游抗氧化蛋白(如HO-1、NQO-1等)的表达,减轻ICH灶周水肿,提高神经保护作用。在体研究[11]发现ICH后HO-1表达上调的时间点与Nrf2激活的时间点具有高度一致性,进一步说明HO-1是Nrf2下游的一重要蛋白[14]。回顾研究结果[6,15,16],HO-1对中枢神经系统众多疾病均具有保护作用。而其在ICH中的作用存在广泛争议。表现出的作用与其表达的部位及作用的时间点有关。在神经内皮细胞中表达的HO-1具有较明确的神经保护作用,而在胶质细胞中的HO-1可能具有神经保护作用,但目前证据不足。且HO-1在ICH早期具有神经保护作用,在晚期可能表现出神经毒性作用,但并没有确切地指出具体时间点。本研究与研究[17~20]大体方向一致,但更确切地阐述了一些关键问题。
本研究显示,与正常组比较,ICH组、ZPP-Ⅸ组、DMSO组制模后6 h、12 h、24 h、48 h、72 h、7 d神经功能评分减少,证明DMSO作为ZPP-Ⅸ溶剂不会加重ICH后神经功能障碍;与ICH组比较,ZPP-Ⅸ组12 h、24 h、48 h、72 h、7 d的神经功能评分减少,说明ZPP-Ⅸ具有神经毒性作用,可加重ICH后神经功能障碍。本研究还显示,与正常组比较,ICH组、DMSO组、ZPP-Ⅸ组各时间点HO-1、Nrf2、NF-κB、TNF-α蛋白表达均增加,binding-Nrf2蛋白水平减少,证实ICH后一方面启动抗炎性、抗氧自由基通路的活化,即通过促进Nrf2入核,另一方面也启动了炎症反应的级联放大;与ICH组比较,ZPP-Ⅸ组12 h、24 h、48 h、72 h及7 d HO-1蛋白表达减少,binding-Nrf2、NF-κB、TNF-α表达增加,提示ZPP-Ⅸ对ICH大鼠Nrf2-ARE信号通路有抑制作用,可能是通过抑制HO-1的表达实现。本文从mRNA表达水平分析得出的结果基本与蛋白的结果基本一致,个别时间点有细微差异。本文研究还发现,与ZPP-Ⅸ组比较,ICH组制模6 h 、12 h、24 h、48 h、72 h、7 d的HO-1与CD11b共表达阳性细胞增加,ICH组制模12 h 、24 h、48 h、72 h、7 d的Nrf2与CD11b共表达阳性细胞增加。说明HO-1可促进Nrf2通路的激活,虽然可一定程度促进下游炎症因子NF-κB、TNF-α的表达,但Nrf2通路及小胶质细胞激活后可以显著抑制下游炎症因子表达从而起到神经保护作用。
总之,ZPP-Ⅸ可能是通过抑制HO-1的表达,从而抑制Nrf2的解离、入核及增加下游NF-κB、TNF-α的表达,来加剧ICH大鼠神经功能损伤的作用。

