“葛根定眩胶囊”对颈性眩晕模型大鼠颈椎X线征象、部分体液因子的影响研究
丰广魁 马先军 陈隐漪 杜 青 石薷月 孟 梓
(1.南京中医药大学连云港附属医院脑病科,江苏连云港222004; 2.连云港中医药高等职业技术学校,江苏连云港222007)
颈性眩晕(cervical vertigo,CV)是一种由各种颈源性因素引起的,以眩晕等交感神经症状为主的症候群,常见头晕目眩,转头加重,甚者恶心呕吐、步履不稳、颈项僵痛,或伴麻木、耳鸣等症状,常有低头、伏案等颈椎劳损的诱因。近年来我们采用院内制剂葛根定眩胶囊治疗颈性眩晕在临床上取得了较好的疗效,为了探讨其作用机制进行了本实验,现报告如下。
1 实验材料
1.1 实验动物 SPF级SD雄性大鼠,体重(200±20)g,由南京中医药大学实验动物中心提供,许可证号:SCXK(京)2013-0003,适应性饲养1周。
1.2 药品与试剂 葛根定眩胶囊由南京中医药大学连云港附属医院制剂室提供,苏药制字Z04001243。药物制备:葛根、桂枝、生白芍、炙甘草、僵蚕、羌活、川芎、钩藤、生姜、大枣按10∶4∶4∶2∶3.3∶3.3∶2∶5∶5∶5比例配备;取葛根一半、川芎,粉碎成细粉,过筛,混匀;另取剩余葛根、桂枝、生白芍、炙甘草、僵蚕、羌活、钩藤、生姜、大枣加水煎煮3次,滤过,合并滤液浓缩,加乙醇使含醇量至60%,静置,取上清液回收乙醇,减压浓缩至适量,与上述细粉拌匀干燥粉碎,装胶囊即得。盐酸氟桂利嗪胶囊(西比灵),由西安杨森制药有限公司生产,规格:5mg/粒。注射用青霉素钠,华北制药股份有限公司生产。水合氯醛(分析纯)上海国药集团生产。大鼠(Rat)内皮素(ET)酶联免疫吸附法(ELISA)检测试剂盒,由上海抚生生物有限公司提供;大鼠(Rat)降钙素基因相关肽(CGRP)ELISA检测试剂盒,由上海远慕生物科技有限公司提供。
1.3 主要仪器 Labsystems Finnpipette 100μL单道移液器,银河生物有限公司;Thermo 50μL 8道移液器,杭州雷琪实验器材有限公司;HH-4数显恒温水浴锅,国华电器有限公司;华东电子DG5033A酶标仪,南京华东电子集团医疗装备有限责任公司。2cm×80cm的木杆、鼠板等,自制。
2 实验方法
2.1 分组与造模 大鼠随机分为空白组、模型组、西比灵组(简称西药组)、葛根定眩胶囊组(简称中药组),每组10只。除空白组外其余各组均造模,造模方法在颈椎失稳法基础上予以改良[1],即剪断颈后部肌肉,切除C5~6棘突及韧带,包括棘上韧带和棘间韧带,用剪刀破坏C5~6关节囊,致大鼠颈椎上下椎体明显失稳,然后逐层缝合。术后连续注射青霉素(4万单位/只)3d。术后1周,待伤口愈合,上下左右转动大鼠头部一次后,迅速放于平衡木杆上,观察大鼠行为步态,以大鼠不能在木杆上站立或移动,或出现摇晃、停滞、调转方向移动认定为造模成功。
2.2 给药 确定造模成功后次日开始对大鼠进行灌胃给药,每日上午8∶00—12∶00给药1次,药液量按体重比1mL/100g计。空白组和模型组灌胃等量双蒸水;葛根定眩胶嚢成人剂量是每次1.8mg(4粒),3次/d,大鼠给药剂量折算为486mg/kg;西比灵成人每次5mg,1次/d,大鼠给药剂量折算为0.45mg/kg。
2.3 指标检测
2.3.1 平衡木试验[2]各组于造模后和治疗4周、8周后进行评价。选用2cm×80cm的平衡木杆悬空放置,先将大鼠的头部上下左右旋转,再迅速将其放置于木杆上,观察其通过木杆时的情况。平衡木试验评分标准(自拟):大鼠不能在木杆上移动,或摇晃、停滞、调转方向,仅稍有移动而不能通过木杆计0分;大鼠在木杆上摇晃、停滞、调转方向,有明显移动,甚至能通过木杆,计1.5分;大鼠较流畅行走,通过木杆,计3分。
2.3.2 X线评分 治疗8周后进行评价。各组大鼠注射1%戊巴比妥钠(40mg/kg)后摄颈椎侧位X线片,使用宋沛松评分法进行评分[1]。颈椎生理弯曲状况:存在,计0分;轻度僵硬,计1分;丧失,计2分;完全丧失并反屈,计3分。椎间隙狭窄情况:无,计0分;轻度,计1分;中度,计2分;重度,计3分。椎体前后缘有无骨赘增生:无,计0分;轻度,计1分;中度,计2分;重度,计3分。钩椎关节及关节突关节有无增生硬化:无,计0分;关节模糊不清,计1分;关节轻度增生硬化,计2分;关节明显增生硬化,计3分。
2.3.3 ET-1、CGRP测定 各组大鼠于给药4周及8周后,眼眶取血于抗凝离心管中,将血液充分混匀,-80℃冷藏保存。采用ELISA法测定ET-1,双抗体夹心法测定CGRP,严格按照试剂盒说明书操作。
2.4 统计学方法 采用SPSS 19.0统计软件进行数据统计、处理和分析,计量数据用(±s)表示,釆用t检验,假设检验统一使用双侧检验,以P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
3 实验结果
3.1 各组大鼠干预前后平衡木得分比较 见表1。
表1 各组大鼠干预前后平衡木得分比较(±s) 分

表1 各组大鼠干预前后平衡木得分比较(±s) 分
注: 与空白组比较,▲P<0.05,▲▲P<0.01;与模型组比较,*P<0.05,**P<0.01;与西药组比较,##P<0.01。
组别 动物数(只)剂量(mg/kg) 造模后 干预4周后 干预8周后空白组 10 3.00±0.00 3.00±0.00 3.00±0.00模型组 10 0.30±0.60▲▲ 0.30±0.60▲▲ 0.15±0.45▲▲西药组 10 0.45 0.15±0.45▲▲ 0.9±0.77▲▲ 1.35±0.81▲▲**中药组 10 486 0.15±0.45▲▲ 1.65±0.81▲▲* 2.4±0.73▲**##
3.2 各组大鼠干预后颈椎X线评分比较 见表2。
表2 各组大鼠干预后颈椎侧位片X线评分比较(±s) 分

表2 各组大鼠干预后颈椎侧位片X线评分比较(±s) 分
注: 与空白组比较,▲▲P<0.01;与模型组比较,**P<0.01;与西药组比较,##P<0.01。
组别 动物数(只) 剂量(mg/kg) X线评分空白组 10 0.00±0.00模型组 10 7.40±0.97▲▲西药组 10 0.45 4.50±1.27▲▲**中药组 10 486 2.50±1.18▲▲**##
3.3 各组大鼠干预各时期血浆ET-1、CGRP含量及其比值比较 见表3。
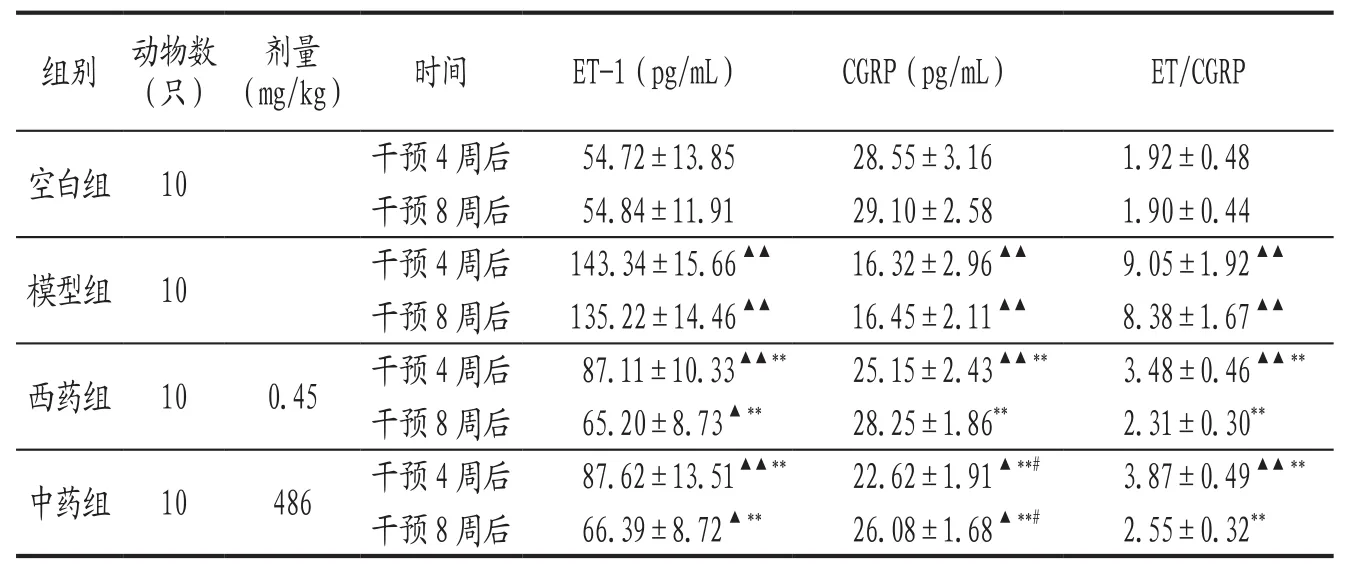
表3 各组大鼠干预各时期血浆ET-1、CGRP含量及其比值比较
4 讨论
颈性眩晕与颈椎生理曲度变直、反弓、不稳、负荷有关[3-4],这些原因导致颈部交感神经兴奋进而引发椎-基底动脉痉挛诱发眩晕。大鼠的颈椎失稳法模型符合颈性眩晕的发病机制,而且操作相对简单,成功率高[5],是颈性眩晕的理想动物模型。宋沛松等[1]建立的造模方法其操作风险与创伤均较大,为此我们做了改良,即破坏C5~6颈椎,本次造模大鼠无死亡发生,造模后平衡木试验与空白组有显著差异,表明造模成功。平衡木试验能够验证大鼠的平衡能力及大鼠的“眩晕”状态,操作简单易行,但尚无评分标准,我们自行拟定了3个等次作为评价标准。盐酸氟桂利嗪(西比灵)是临床常用治疗眩晕的药物,能够防止血管痉挛且对椎基底动脉的作用效果最强[6],因此选择其作为对照药。
颈性眩晕属于中医“眩晕”“项痹”范畴,多因劳倦伤(颈项)筋,失却气之温煦,内外寒湿凝滞筋脉,络脉痹阻、气血难荣清窍而致,故寒湿凝涩、筋脉不舒、气血运行不畅是本病的病机关键,当治以解肌舒筋、通利太阳经脉。葛根定眩胶囊为我院2004年获批的院内制剂,由桂枝加葛根汤加羌活、川芎、僵蚕、钩藤组成。本方重在解肌舒筋通络,通利太阳经枢。葛根定眩取桂枝加葛根汤解肌通经、舒筋和营,加羌活辛温通络散寒祛湿,川芎通络活血,僵蚕祛风活络,钩藤息风通络。
本研究结果显示,经过8周给药,中药组与西药组大鼠平衡木试验得分皆显著高于模型组,且中药组明显优于西药组。给药8周后,颈椎X线评分中药组明显低于模型组和西药组。有研究表明,桂皮醛可改善肌肉的挛急和挛缩[7];芍药苷、甘草酸具有较好的缓解肌肉痉挛及镇痛作用[8];僵蚕中所含草酸铵具有明显的抗惊厥作用,对强直、痉挛的肌肉有松弛作用[9]。由此推测,葛根定眩胶囊对大鼠行为学及颈椎不稳起到的干预及治疗作用可能与其不仅作用于血管,还能松弛颈部肌肉痉挛,进而改善颈椎交感神经兴奋有关。
除了解剖和交感神经因素外,体液因素可能是颈性眩晕的重要物质基础之一[10-11],其中包括ET-1、CGRP两种因子。血浆中ET和CGRP是已知的最强的内源性缩血管因子和舒血管因子[12],对血管的作用力强且持久,共同调节血流变化与维持血管的舒缩功能。有研究表明,血浆ET-1、CGRP可能是诱发颈性眩晕的关键物质,两者的失衡与颈性眩晕的发生发展关系密切[13],两者的比值更有意义[11]。本研究结果显示,给药4周、8周后,中药组ET-1水平明显低于模型组,作用近似于西药组(P>0.05);中药组CGPR水平显著高于模型组,但改善效果不及西药组;中药组ET-1/CGRP比值显著低于模型组,近似西药组(P>0.05)。但是体液因子的异常是因还是果还不完全明晰,而体液因子的异常无法解释颈性眩晕的发作性,我们推测是果不是因。有文献报道,葛根的主要成分葛根总黄酮有扩张脑及内耳血管、调节循环等作用,调整血浆ET-1与CGPR的相对水平[14]。川芎有效成分阿魏酸钠可以通过拮抗ET受体和ET效应,抑制血管内皮素的产生[15]。葛根定眩胶囊也有调节体液因子的作用,但升高CGPR作用显著弱于西药组,降低ET-1及调节ET-1/CGRP比值也不及西药组,这与其改善大鼠行为学及颈椎X线评分不相一致,说明对体液因子的影响不是葛根定眩胶囊的优势所在。由此推测,葛根定眩胶囊的作用机制不完全在影响体液因子方面,可能与其具有解肌疏筋活络作用,能够改善颈椎小关节紊乱、解除颈肌痉挛进而抑制颈椎交感神经兴奋有关,确切机制还有待进一步研究。

