抵当汤调控深静脉血栓形成大鼠Th1/Th2信号漂移的实验研究
安 震 张 玥 张玉冬 侯光敏
(1.山东中医药大学,山东济南250014; 2.山东中医药大学附属医院周围血管病科,山东济南250014)
近年来,深静脉血栓形成(deep venous thrombosis,DVT)的发病率逐年上升,随着对本病发病机制研究的不断深入,炎症在DVT中的作用越来越受到重视[1]。有学者提出DVT形成的关键事件最有可能是静脉壁的炎症[2]。炎症细胞因子作为炎症反应的关键物质,能够通过诱导组织因子的表达促进血液的高凝状态,在DVT中起着重要的作用。辅助性T细胞(Th)的两种亚型Th1和Th2细胞分别分泌肿瘤坏死因子-α(TNF-α)、干扰素-γ(INF-γ)等促炎因子和白介素-4(IL-4)、白介素-10(IL-10)等抗炎因子,这些因子的失衡导致Th1/Th2的漂移,从而导致疾病进展。本研究以动物实验为基础,从分子生物学的角度探讨Th1/Th2在DVT中的变化规律以及中药抵当汤的干预作用。
1 实验材料
1.1 实验动物 雄性Wistar大鼠120只,12周龄,体重200~250g,清洁级,购自山东大学动物实验中心(许可证号:SCXK鲁20130009)。1.2 实验药物 抵当汤的四味药物均购于山东中医药大学附属医院,依据《伤寒论》记载的剂量,折算后大黄45g、炒水蛭40g、炒虻虫10g、桃仁6g。汤液浓缩后折算药物浓度为2g/mL,4℃冰箱储存备用。
1.3 实 验 试 剂 TNF-α、IL-4和IL-10的 大 鼠 放免试剂盒,北京普尔伟业生物科技有限公司;大鼠IFN-γ ELISA试剂盒,R&D进口分装,上海门碟塔生物有限公司;水合氯醛,上海化学试剂采购供应站分装厂。
1.4 实验仪器 DDL-5冷冻离心机,上海安亭科学仪器厂;SN-695型智能放射免疫γ测量仪,上海核所日环光电仪器有限公司;WT11001R型电子天平,江苏省常州市万得天平仪器厂。
2 实验方法
2.1 模型制备 采用Rryers法[3]。用10%的水合氯醛按3mL/kg体重腹腔麻醉后,动物取仰卧位,腹中部皮肤去毛,碘伏消毒2遍,铺无菌巾。做剑突下腹正中切口,长6cm,将腹腔肠管移出体外,用湿纱布包裹后置于右腹部。打开后腹膜,仔细游离左肾静脉与下腔静脉汇合处,用4#外科非吸收性丝线于左肾静脉下方结扎下腔静脉,1#外科非吸收性丝线结扎左肾静脉水平以远下腔静脉段的主要属支,将外置肠管回纳腹腔,1#丝线缝合腹壁和皮肤,给予腹腔注射青霉素10万单位/只,4h后成功建立DVT大鼠模型。此法一般在结扎后3h血栓形成率为60%~80%,结扎后6h血栓形成率为100%[3]。课题组前期在进行预实验时,采用Rryers法造模4h后肉眼下均发现有血栓形成。
2.2 分组与给药 将120只Wistar大鼠随机分为假手术组、模型组、抵当汤小剂量组和抵当汤大剂量组,每组30只。各组大鼠又分别按照术后第1、3、7日处死时间的不同随机平均分笼饲养,每笼10只。假手术组按照下腔静脉造模术的方法分离出下腔静脉后,不予以结扎,而后关腹。术后4h开始每日给药。假手术组和模型组给予生理盐水灌胃,每日1mL/100g,1次/d;抵当汤大、小剂量组分别每日予1.8、0.9g/100g药液灌胃,1次/d。
2.3 取材 分别于术后第1、3、7日取相应笼中的大鼠,最后一次灌胃2h后,腹腔麻醉,开腹,操作同造模方法,腹主动脉取血,立即置于不加抗凝剂的试管内,于30min内送核医学科离心后保存待测。
2.4 观察指标及方法
2.4.1 血清TNF-α、IL-4、IL-10 取腹主动脉血2mL,注入普通塑料试管内,4℃、离心半径17.8cm、3000r/min离 心10min,离 心 血清,-20℃保存备用。测定前使样本置于室温或冷水中复融,再次4℃、离心半径17.8cm、3000r/min离心5min,取上清液测定。
2.4.2 血浆IFN-γ 取腹主动脉血2mL,注入含EDTA的试管内,离心半径17.8cm、3000r/min离心30min去除颗粒,-20℃保存备用。测定前至室温中复融,采用固相夹心法酶联免疫吸附试验(ELISA)测定。
2.5 统计学方法 采用SPSS 22.0统计软件进行数据处理。数据资料用(±s)形式表示,采用t检验,多组间比较用方差分析,组间两两比较用q检验。P<0.05为有显著性差异,P<0.01为有非常显著性差异。
3 实验结果
实验过程中各组大鼠均有因麻醉过量、相互咬伤、手术操作不当以及其他原因而未能获得标本就已经死亡的情况,剩余只数见表1、表2。
表1 各组大鼠干预各时期血清TNF-α、IL-4、IL-10,血浆IFN-γ水平比较(±s)
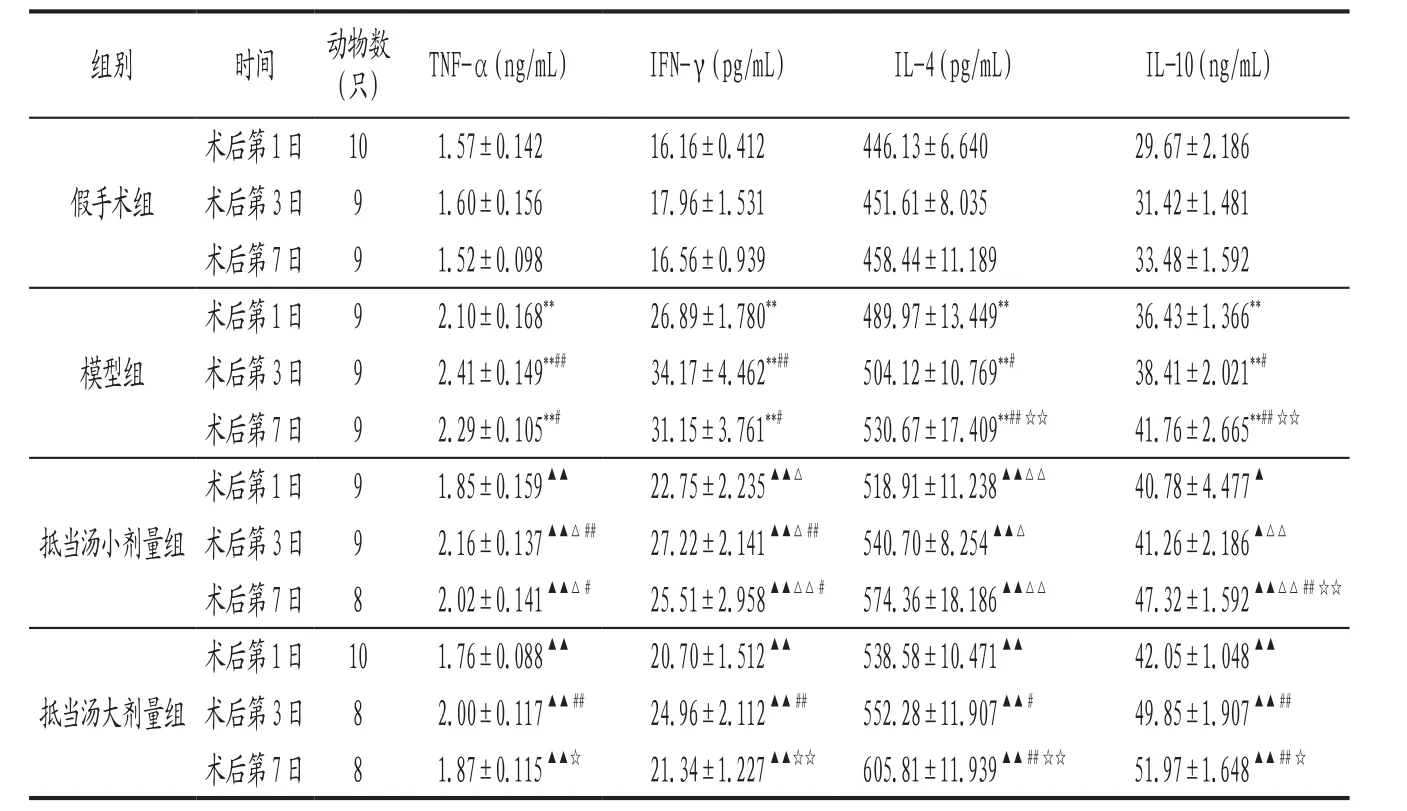
表1 各组大鼠干预各时期血清TNF-α、IL-4、IL-10,血浆IFN-γ水平比较(±s)
注: 与假手术组比较,**P<0.01 ;与模型组比较,▲P<0.05,▲▲P<0.01 ;与抵当汤大剂量组比较,△P<0.05,△△P<0.01;与本组术后第1日比较,#P<0.05,##P<0.01;与本组术后第3日比较,☆P<0.05,☆☆P<0.01。
组别 时间 动物数(只) T N F-α(n g/m L) I F N-γ(p g/m L) I L-4(p g/m L) I L-1 0(n g/m L)假手术组术后第1日 1 0 1.5 7±0.1 4 2 1 6.1 6±0.4 1 2 4 4 6.1 3±6.6 4 0 2 9.6 7±2.1 8 6术后第3日 9 1.6 0±0.1 5 6 1 7.9 6±1.5 3 1 4 5 1.6 1±8.0 3 5 3 1.4 2±1.4 8 1术后第7日 9 1.5 2±0.0 9 8 1 6.5 6±0.9 3 9 4 5 8.4 4±1 1.1 8 9 3 3.4 8±1.5 9 2模型组术后第1日 9 2.1 0±0.1 6 8** 2 6.8 9±1.7 8 0** 4 8 9.9 7±1 3.4 4 9** 3 6.4 3±1.3 6 6**术后第3日 9 2.4 1±0.1 4 9**## 3 4.1 7±4.4 6 2**## 5 0 4.1 2±1 0.7 6 9**# 3 8.4 1±2.0 2 1**#术后第7日 9 2.2 9±0.1 0 5**# 3 1.1 5±3.7 6 1**# 5 3 0.6 7±1 7.4 0 9**##☆☆ 4 1.7 6±2.6 6 5**##☆☆抵当汤小剂量组术后第1日 9 1.8 5±0.1 5 9▲▲ 2 2.7 5±2.2 3 5▲▲△ 5 1 8.9 1±1 1.2 3 8▲▲△△ 4 0.7 8±4.4 7 7▲术后第3日 9 2.1 6±0.1 3 7▲▲△## 2 7.2 2±2.1 4 1▲▲△## 5 4 0.7 0±8.2 5 4▲▲△ 4 1.2 6±2.1 8 6▲△△术后第7日 8 2.0 2±0.1 4 1▲▲△# 2 5.5 1±2.9 5 8▲▲△△# 5 7 4.3 6±1 8.1 8 6▲▲△△ 4 7.3 2±1.5 9 2▲▲△△##☆☆抵当汤大剂量组术后第1日 1 0 1.7 6±0.0 8 8▲▲ 2 0.7 0±1.5 1 2▲▲ 5 3 8.5 8±1 0.4 7 1▲▲ 4 2.0 5±1.0 4 8▲▲术后第3日 8 2.0 0±0.1 1 7▲▲## 2 4.9 6±2.1 1 2▲▲## 5 5 2.2 8±1 1.9 0 7▲▲# 4 9.8 5±1.9 0 7▲▲##术后第7日 8 1.8 7±0.1 1 5▲▲☆ 2 1.3 4±1.2 2 7▲▲☆☆ 6 0 5.8 1±1 1.9 3 9▲▲##☆☆ 5 1.9 7±1.6 4 8▲▲##☆
表2 各组大鼠干预各时期IL-10/TNF-α、IFN-γ/IL-4比值比较(±s)
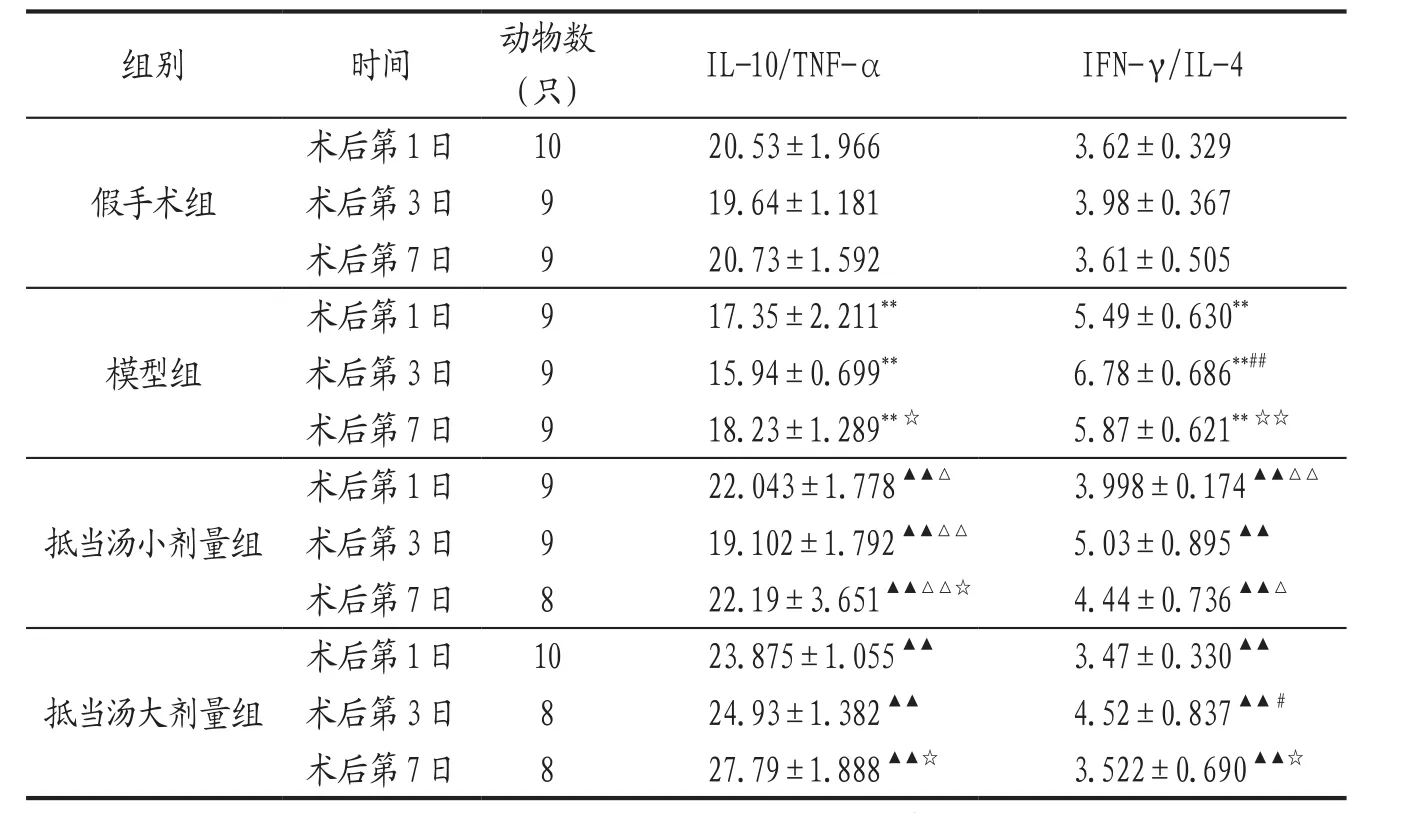
表2 各组大鼠干预各时期IL-10/TNF-α、IFN-γ/IL-4比值比较(±s)
注: IFN-γ/IL-4比值数值过小,为了计算方便,表中数值为比值×100。与假手术组比较,**P<0.01;与模型组比较,▲▲P<0.01;与抵当汤大剂量组比较,△P<0.05,△△P<0.01;与本组术后第1日比较,#P<0.05,##P<0.01;与本组术后第3日比较,☆P<0.05,☆☆P<0.01。
组别 时间 动物数(只) I L-1 0/T N F-α I F N-γ/I L-4假手术组术后第1日 1 0 2 0.5 3±1.9 6 6 3.6 2±0.3 2 9术后第3日 9 1 9.6 4±1.1 8 1 3.9 8±0.3 6 7术后第7日 9 2 0.7 3±1.5 9 2 3.6 1±0.5 0 5模型组术后第1日 9 1 7.3 5±2.2 1 1** 5.4 9±0.6 3 0**术后第3日 9 1 5.9 4±0.6 9 9** 6.7 8±0.6 8 6**##术后第7日 9 1 8.2 3±1.2 8 9**☆ 5.8 7±0.6 2 1**☆☆抵当汤小剂量组术后第1日 9 2 2.0 4 3±1.7 7 8▲▲△ 3.9 9 8±0.1 7 4▲▲△△术后第3日 9 1 9.1 0 2±1.7 9 2▲▲△△ 5.0 3±0.8 9 5▲▲术后第7日 8 2 2.1 9±3.6 5 1▲▲△△☆ 4.4 4±0.7 3 6▲▲△抵当汤大剂量组术后第1日 1 0 2 3.8 7 5±1.0 5 5▲▲ 3.4 7±0.3 3 0▲▲术后第3日 8 2 4.9 3±1.3 8 2▲▲ 4.5 2±0.8 3 7▲▲#术后第7日 8 2 7.7 9±1.8 8 8▲▲☆ 3.5 2 2±0.6 9 0▲▲☆
3.1 各组大鼠干预各时期血清TNF-α、IL-4、IL-10,血浆IFN-γ水平比较 结果见表1。说明抵当汤对血栓引起的TNF-α、IFN-γ升高有抑制作用,且其作用表现出剂量依赖性;能剂量依赖性地升高IL-4、IL-10水平。各组大鼠TNF-α、IFN-γ水平随手术的天数呈现先升高而后下降的趋势,说明随着血栓的形成,细胞因子TNF-α、IFN-γ水平逐渐升高,在术后第3天达到高峰,第7天时已逐渐下降。各组IL-4、IL-10水平随手术的天数呈现逐渐升高的趋势。
3.2 各组大鼠干预各时期IL-10/TNF-α、IFN-γ/IL-4比值比较 结果见表2。
4 讨论
随着近年来分子生物学的发展,对于DVT发病机制的研究越来越深入。越来越多的研究证明炎症与DVT的发生密切相关。Th1和Th2是Mossman在1989年根据T细胞分泌因子的不同提出的两个功能亚群,Th1和Th2细胞能够分泌多种炎症细胞因子,其中Th1分泌的TNF-α、IFN-γ具有促炎作用,Th2分泌的IL-4、IL-10具有抑炎作用[5]。正常情况下,Th1/Th2在体内存在着动态平衡,当Th1/Th2平衡失调并向某一状态转化时,称之为Th1/Th2漂移现象[6]。习惯上把Th1及其细胞因子占优势的状态称为Th2向Th1漂移,反之Th2及其细胞因子占优势的状态称为Th1向Th2漂移。Th1/Th2漂移,能够影响疾病进展。本研究结果显示,血栓形成后同一时相,模型组较假手术组TNF-α、IFN-γ、IL-4和IL-10显著升高,差异有非常显著性(P<0.01),说明在排除手术的原因后,血栓形成能引起TNF-α、IFN-γ、IL-4和IL-10的升高。随着天数的增加,IL-10/TNF-α比值在第3天变小,第7天增大,而IFN-γ/IL-4比值在第3天增大,第7天回落。说明血栓形成后,机体存在TNF-α、IFN-γ等促炎因子分泌增加,导致Th1占优势,Th2向Th1漂移,且在第3天达到高峰。这与DVT的临床表现相一致:发病初期,随着Th1细胞因子分泌的增加,机体的炎症反应明显,表现为肢体红肿热痛;随着病程的延长,Th2细胞因子分泌逐渐增加,下调静脉壁的炎症,表现为患肢红肿热痛减轻,血栓也趋于稳定。
DVT属于中医学“股肿”“瘀血流注”范畴,临床表现多有患肢的红、肿、热、痛,中医辨证多属瘀热互结。DVT后瘀血阻于经脉,气血运行不畅,瘀久化热,热邪又可伤津灼血,使血脉滞涩,即所谓“瘀积发热”“留瘀化火”。“血不利则为水”,瘀血阻于脉中,营血回流受阻,导致津液代谢、输布障碍,聚而为湿。瘀久化热,热邪灼津,炼液成痰。可见瘀和热不仅是DVT过程中的病理产物,还是新的致病因素[7-8]。因此中医治疗当以泻热逐瘀为主要治法。抵当汤出自《伤寒杂病论》,由水蛭、虻虫、桃仁、大黄四味药物组成,是治疗下焦蓄血证的经典方剂。方中水蛭逐恶血破癥,具有破瘀血而不伤新血,专入血分而不伤气分的特点;虻虫入肝经而专破瘀血;辅以活血祛瘀的桃仁,下瘀泻热的大黄,使瘀热从下窍而泄。本研究结果显示,抵当汤治疗后TNF-α、IFN-γ水平及IFN-γ/IL-4比值较模型组降低,IL-4、IL-10水平及IL-10/TNF-α比值较模型组升高,且抵当汤大剂量组的作用强于小剂量组。说明抵当汤能剂量依赖性促进Th2细胞因子的分泌,抑制Th1细胞因子分泌,使Th2向Th1漂移的状态得到遏制和逆转。
综上所述,本研究观察了Th1和Th2在DVT中的比例变化及其特征性炎症因子的表达。DVT存在Th1细胞因子分泌占优势,Th2向Th1漂移的现象。抵当汤能剂量依赖性诱导Th2细胞因子的分泌,抑制Th1细胞因子表达,调节Th1/Th2平衡,减轻炎症反应,达到治疗DVT的目的。下一步我们将通过研究Th1/Th2漂移调节机制,控制其分化的细胞因子微环境,进而调节体内Th1/Th2漂移,最终实现控制炎症,达到防治DVT的目的。

