2型糖尿病患者伴慢性肾脏病和外周动脉疾病对全因死亡和心血管疾病死亡的影响
吴春燕, 余思韵, 李 觉,2, 张丽娟,2
(1. 同济大学医学院流行病学教研室,上海 200092; 2. 同济大学医学院临床流行病学与循证医学研究所,上海 200092)
慢性肾脏病(chronic kidney disease, CKD)在全世界范围内一直是人们关注的热点话题,在美国有11%~13%的成人患有CKD[1-2],中国CKD的总患病率为10.8%。外周动脉疾病(peripheral arterial disease, PAD)是一种常见病,美国70岁以上老年人群中PAD的患病率为14.5%,中国2型糖尿病(type 2 diabetes mellitus, T2DM)人群中PAD的患病率为16.7%[4-5]。此外,CKD人群有较高的PAD患病率(24%~32%)[6-7],PAD人群也有较高的CKD患病率。CKD和PAD均与心血管疾病(cardiovascular disease, CVD)事件的发生和CVD死亡密切相关[6,9-10],且均为全因死亡的独立危险因素[11]。糖尿病是一种常见的慢性病,研究表明CKD或PAD会增加糖尿病患者的死亡风险[5,12]。本项研究深入分析在糖尿病人群中伴CKD和PAD,其增加的全因死亡和CVD死亡风险。旨在为糖尿病患者早期检测肾小球滤过率(glomerular filtration rate, GFR)和踝臂指数(ankle-brachial index, ABI)水平提供科学依据。
1 资料与方法
1.1 一般资料
本项调查的研究对象来自2004年7月—2005年1月在北京及上海8所医院的心内科和内分泌科住院的患者。入选标准: 年龄≥35岁,空腹血糖≥7mmol/L或餐后2小时血糖≥11.1mmol/L或自我报告使用降糖药物或既往有糖尿病史。排除标准: 无血清肌酐数据,严重心脏、肝、肾功能不全,有重大疾病的患者。基线调查共入选1559例T2DM患者,对其进行5年随访。失访216例(13.9%),最终获得有完整随访资料的T2DM患者共1343例,平均年龄(67.52±10.28)岁,其中男性662例(49.3%),女性681例(50.7%)。本次研究通过了同济大学伦理委员会的批准,研究对象均为填写知情同意书后进行基线调查和随访研究。
1.2 ABI测定方法
ABI的测量统一使用5MHz手持超声探头(仪器型号: Elite Model 100R),血压计袖带气囊宽10cm,长40cm。测量方法: 患者采用标准仰卧位,测量上臂和踝部(胫后动脉和足背动脉)的收缩压。ABI值为胫后动脉或足背动脉收缩压与上臂收缩压的最高值之比。计算公式: 左踝臂指数=左侧踝动脉血压/较高的肱动脉血压;右踝臂指数=右侧踝动脉血压/较高的肱动脉血压,取ABI值为左右ABI中数值较小者。ABI对PAD的诊断有较好的灵敏度和特异度[13]。
1.3 PAD的诊断标准
根据2005年ACC/AHA发布的PAD治疗指南[14],将ABI≤0.9作为PAD的诊断指标,并将ABI分为3组: 重度至中度PAD组(ABI: ≤0.70)、轻度PAD组(ABI: 0.71~0.90)、无PAD组(ABI: ≥0.91)。
1.4 CKD的诊断标准
根据2012年改善全球肾脏病预后组织(kidney disease: improving global outcomes, KDIGO)发布的临床实践指南[15],将CKD定义为肾脏结构或功能异常超过3个月。CKD的诊断标准为: 出现以下任意一项指标(包括肾损伤标志和GFR下降。肾损伤标志包括以下6个方面: 白蛋白尿、尿沉渣异常、肾小管相关病变、组织学异常、影像学所见结构异常、肾移植病史;GFR下降: GFR<60mL/(min·1.73m2),持续时间超过3个月。按照KDIGO指南中的推荐的慢性肾脏病流行病学合作研究公式(chronic kidney disease epidemiology collaboration, CKD-EPI)估算GFR值,其计算公式为: 女性且血清肌酐≤0.7mg/dL: 144×血清肌酐/0.7]-0.329×0.993年龄;女性且血清肌酐>0.7mg/dL: 144×血清肌酐/0.7]-1.209×0.993年龄;男性且血清肌酐≤0.9mg/dL: 141×血清肌酐/0.9]-0.411×0.993年龄;男性且血清肌酐>0.9mg/dL: 141×血清肌酐/0.9]-1.209×0.993年龄。相比于2002年KDIGO指南推荐的肾脏病膳食改良公式(modification of diet in renal disease, MDRD),CKD-EPI对全因和CVD死亡风险具有更好的预测能力[16-17]。根据GFR对CKD进行分期: 1期[GFR≥90mL/(min·1.73m2)],2期[GFR: 60~89mL/(min·1.73m2)],3a期[GFR: 45~59mL/[JP3](min·1.73m2)],3b期[GFR:30~44mL/(min·1.73m2)],4期[GFR:15~29mL/(min·1.73m2)],研究中排除5期[GFR<15mL/(min·1.73m2)]的患者。
1.5 分组标准
按照是否患有CKD或PAD对患者进行分组: CKD合并PAD组(同时患有CKD和PAD),PAD非CKD组(仅患有PAD),CKD非PAD组(仅患有CKD),非CKD非PAD组(两种疾病均未患)。
1.6 资料收集
基线资料的收集采用问卷调查的方法,每位患者测量ABI的同时,由专业人员进行问卷调查收集一般人口学特征、相关行为生活方式影响因素、个人现病史和既往史、体格检查和实验室检查资料。随访调查采用电话随访的方式进行,并通过临床死亡病历、家属根据医院发出的死亡证明或到街道派出所等部门查阅死亡证明或死亡登记对死亡进行确认。全因死亡是指随访期间由于任何一种原因引起的死亡,CVD死亡根据国际疾病分类第10版(ICD-10)来进行确认。
1.7 统计学处理
所有的统计表均汇总至同济大学医学院流行病学教研室,进行录入和二次校验。使用Access建立数据库,SPSS 20.0进行统计分析。基线资料的分析中,计量资料的显著性检验采用方差分析(ANOVA),计数资料采用Chi-square检验。对PAD危险因素的分析采用logistic回归。在随访研究中引入Cox回归模型,在模型中调整年龄、性别、体质量指数(body mass index, BMI)、收缩压、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)、吸烟史、高血压史、冠心病史和中风史等潜在混杂因素。使用Kaplan-Meier生存曲线和Log-rank检验比较组间生存率。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料和随访情况
经过5年的随访,基线入选的1559例T2DM患者中,失访216例,失访率为13.9%,在统计学允许范围内。失访原因主要为城建动迁、联系电话变动和姓名登记有误或不合作等。最终获得有完整随访资料的T2DM患者1343例,平均年龄为(67.52±10.28)岁,其中男性662例(49.3%),女性681例(50.7%),男女比例均衡。基线调查时,CKD患者共406例(30.2%),PAD患者共435例(32.4%)。CKD合并PAD组患者195例(14.52%),PAD非CKD组患者211例(15.71%),CKD非PAD组患者240例(17.87%),非PAD非CKD组患者697例(51.90%)。随访期间,共发生全因死亡370例(27.55%),其中CVD死亡185例(13.78%)。CKD合并PAD组、PAD非CKD组、CKD非PAD组和非PAD非CKD组的全因死亡率分别为54.4%、31.3%、32.2%和17.4%(P<0.001),CVD死亡率分别为31.3%、15.0%、15.6%和7.9%(P<0.001)。
2.2 不同CKD分期PAD的患病率
CKD患者和非CKD患者中,PAD的患病率分别为48.0%和25.6%(P<0.001)。使用Logistic回归进行多因素分析,并在回归模型中调整传统的CVD危险因素如年龄、性别、BMI、高血压史、高脂血症史和吸烟史。结果显示CKD仍与PAD相关(OR: 1.96,95%CI: 1.46~2.64)。根据GFR对CKD进行分期,CKD1期、2期、3a期、3b期和4期的PAD患者例数分别为46例、194例、110例、56例和29例,各期的患病率分别为14.1%、31.8%、44.2%、52.8%和56.9%(P<0.001)。
2.3 不同CKD/PAD分组中全因及CVD死亡风险的比较
使用COX比例风险回归模型计算各组全因和CVD死亡的RR值,在模型中调整了年龄、性别、BMI、SBP、HDL-C、吸烟史、高血压史、冠心病史和中风史等变量,结果详见表2。与非PAD非CKD组相比较,CKD合并PAD组的全因和CVD死亡风险最高,RR值分别为3.12(95%CI: 2.30~4.24)和3.47(95%CI: 2.29~5.24)。PAD非CKD组的全因和CVD死亡的RR值分别为1.59(1.15~2.19)和1.65(0.82~2.48),CKD非PAD组的全因和CVD死亡的RR值分别为1.68(1.20~2.34)和1.68(1.05~2.58)。
表1不同CKD/PAD分组的基线特征

Tab.1 Baseline characteristics for different CKD/PAD groups
TC为血总胆固醇;TG为三酰甘油;HDL-C为高密度脂蛋白胆固醇;LDL-C为低密度脂蛋白胆固醇;1mmHg=0.133Pa

表2 不同CKD/PAD分组中全因和CVD
RR为以非PAD非CKD组为对照,经COX回归计算得出的相对危险度;COX回归模型中调整的变量: 年龄、性别、BMI、SBP、HDL-C、吸烟史、高血压史、冠心病史、中风史
2.4 生存分析
各分组的全因及CVD死亡的Kaplan-Meier生存曲线见图1。生存率由低到高分别为CKD合并PAD组、PAD非CKD组、CKD非PAD组和非PAD非CKD组,经Log-rank检验,差异均具有统计学意义(P<0.001)。
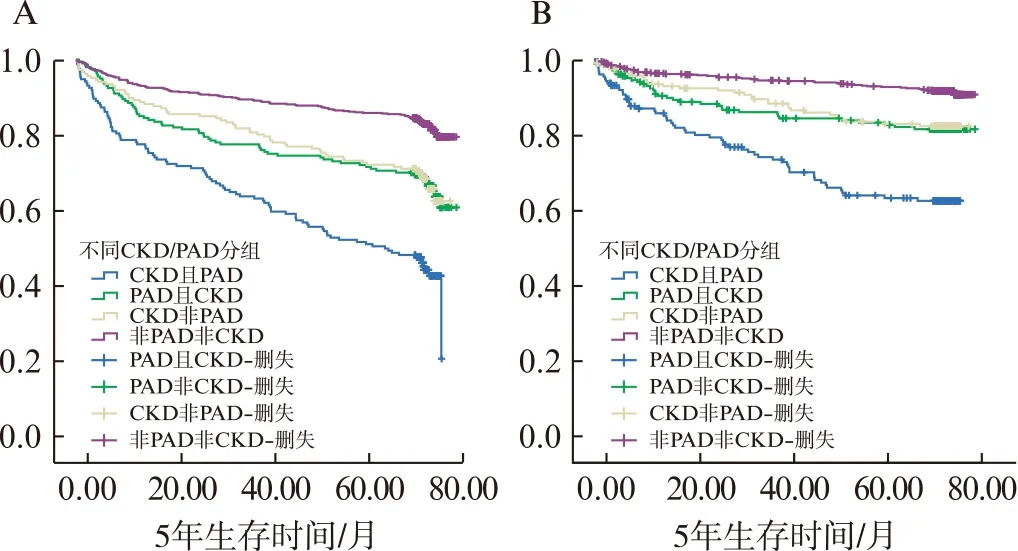
图1 不同CKD/PAD分组中全因和CVD死亡生存曲线Fig.1 Univariate Kaplan-Meier curves of the CKD/PAD groups for all-cause and CVD mortalityA: 全因死亡;B: CVD死亡
3 讨 论
PAD是系统性动脉粥样硬化疾病的一种表现。动脉粥样硬化疾病能促进肾功能恶化,同时GFR水平的下降也会通过多种致病机制加剧全身性动脉粥样硬化[18-20]。PAD与CKD可互相促进对方的发生和发展。动脉粥样硬化和肾脏病变均与糖尿病相关,以往的研究主要侧重于单一疾病对糖尿病患者的影响,仅有一项研究讨论了糖尿病人群中,ABI<1.1的患者其ABI值与GFR值的关系[12]。除此之外,并未深入研究糖尿病人群同时患CKD和PAD对全因和CVD死亡的影响。因此,本项研究着重分析了糖尿病人群中,同时患CKD和PAD增加的全因和CVD死亡风险,具有重要的流行病学意义。
在本项研究中,CKD患者PAD的患病率显著高于非CKD患者(48.0%vs25.6%,P<0.001)。即使在调整传统的CVD危险因素之后,CKD仍与PAD相关(OR: 1.96,95%CI: 1.46~2.64)。该结果与以往的研究报道相吻合: 一项全国健康与营养调查结果显示ABI<0.9与肾功能不全相关,并独立于年龄、糖尿病、高血压、冠心病、中风史等危险因素(OR: 2.5,95%CI: 1.2~5.1);另一项研究中,在调整CVD危险因素之后,CKD患者仍具有较高的PAD患病风险(OR: 1.56,95%CI: 1.13~2.14)[21]。根据GFR对CKD进行分期,结果显示PAD患病率随着GFR值的下降而升高,CKD3a期、CKD3b期及CKD4期的PAD患病率分别为44.2%、52.8%和56.9%。
经过5年的随访,1343例T2DM患者中共发生370例全因死亡,其中185例CVD死亡。CKD合并PAD组患者的全因和CVD死亡率均为最高,分别为54.4%和31.3%。在调整年龄、性别、BMI、SBP、HDL-C、吸烟史、高血压史、冠心病史和中风史等混杂因素后,CKD合并PAD组患者的全因死亡RR值约为非PAD非CKD组的3.12倍,CVD死亡RR值约为非PAD非CKD组的3.47倍。此外,CKD合并PAD组患者的全因和CVD死亡RR值均高于PAD非CKD组、CKD非PAD组。该研究结果与以往的研究结果相吻合,证实了CKD合并PAD会增加死亡风险,尤其对CVD的死亡风险存在倍增效益[22-24]。
生存分析的结果表明,无论是全因死亡还是CVD死亡,CKD合并PAD组患者的生存率显著低于非CKD非PAD组患者,并且均高于PAD非CKD组、CKD非PAD组。在T2DM人群中,较低的ABI和GFR值对全因及CVD死亡的风险具有预测价值。因此,在T2DM患者中定期检测GFR和ABI水平的变化,预防及治疗CKD和PAD,控制T2DM患者病情发展和并发症的发生,对提高患者生存状态并延长患者寿命具有重要的公共卫生学意义。
本研究的局限性主要包括以下几个方面: 本项研究的基线资料中缺乏糖尿病患者的尿微量白蛋白值,仅依据估算的GFR值对CKD进行分期具有一定的局限性;本研究为5年随访队列研究,并未深入探讨CKD合并PAD对全因和CVD死亡存在倍增效益的病理生理学机制,在今后的实验性研究中应对此结论进行验证。
综上所述,在T2DM患者中,CKD合并PAD患者具有较高的全因及CVD死亡风险。研究结论强调了在T2DM人群中定期检测GFR和ABI水平的重要性,让患者从早期干预中获益。

