YY1对肺泡Ⅰ型上皮细胞纤维化的调控研究
张楚怡, 李姝君,2, 黄小玲,3, 赵 倩,林 忻, 俞作仁
(1. 同济大学附属东方医院转化医学研究中心,上海 200120;2. 大连医科大学基础医学院,大连 116044;3. 甘肃省人民医院药剂科,兰州 730000)
特发性肺纤维化(idiopathic pulmonary fibrosis, IPF)是最常见的特发性间质性肺炎,确诊后的平均存活期不到3年,是危害人类健康的重要疾病,被称为“非肿瘤的肿瘤”,发病机制不明,无有效的治疗方法。
99%的肺表面由肺泡上皮细胞构成,肺泡上皮细胞包括肺泡Ⅰ型和Ⅱ型上皮细胞。肺泡Ⅱ型上皮细胞占肺细胞总数的16%,但仅覆盖5%的肺泡表面积,具有合成和分泌肺泡表面活性物质的功能,对于维持肺泡的功能和形态起重要作用。肺泡Ⅰ型上皮细胞覆盖95%的肺泡表面积,是气体交换的主要场所,具有维持肺泡结构的作用。传统观点认为肺泡Ⅰ型上皮细胞是终末分化细胞,受到损伤脱落后,自身不具有增殖和分化的功能,而肺泡Ⅱ型上皮细胞能通过有丝分裂、增殖、分化成肺泡Ⅰ型上皮细胞,修复受损的肺泡上皮细胞。近年来研究发现,肺泡Ⅰ型上皮细胞也具有自我更新和产生肺泡Ⅱ型上皮细胞的能力。ALI/ARDS发生时,肺泡上皮细胞受到损伤,炎症因子、细胞因子、趋化因子等进入到肺泡,引起肺泡上皮细胞死亡,促进成纤维细胞增殖,同时诱导成纤维细胞、循环纤维细胞和上皮细胞间质转型,转化为成纤维细胞,最终在肺泡中形成瘢痕,导致肺结构破坏。利用现代生物学技术,靶向肺泡上皮细胞防治其纤维化,日益成为该领域研究热点之一。但是,肺泡Ⅰ型和Ⅱ型上皮细胞在ALI/ARDS和IPF发生、发展及预后等的作用及调控机制尚不明确,还有待于进一步研究。
转录因子YY1是Polycomb家族蛋白之一,具有双重转录活性和DNA结合活性。YY1参与多种细胞生物学过程,包括胚胎形成、组织细胞增殖、分化和细胞凋亡等。大量的研究结果证实,YY1在癌症和炎症的发生发展中发挥重要的作用。本项目组成员首次发现YY1在肺纤维化的疾病发生发展中起重要的调节作用,但其分子机制尚不清楚。在前期工作基础上,本项目拟针对肺泡Ⅰ、Ⅱ型上皮细胞的功能及调控机制的不同,深入研究YY1在肺泡Ⅰ型上皮细胞炎症和纤维化发生发展中的调控作用和机制,为推动YY1在防治IPF的临床应用提供实验依据。
1 材料与方法
1.1 试剂与仪器
A549、R3/1、HEK293T、H446、H460、H1299细胞源自美国ATCC,本项目课题组所在实验室保持和存养;DMEM培养基和RPMI-1640培养基购自中科迈晨(北京)科技有限公司;Opti-MEM培养基、胎牛血清、胰蛋白酶-EDTA、TGF-β均购自美国Gibco公司;β-actin、YY1抗体购自Santa Cruz Biotechnology公司;NF-κB抗体购自Cell Signaling Technology公司;Histone抗体购自上海碧云天生物技术有限公司;α-sma抗体购自美国Abcam公司;TRIzol试剂、LipofectamineTM2000转染试剂盒购自美国Invitrogen公司;反转录试剂盒购自美国Promega公司;荧光定量PCR SYBR Green Master Mix购自南京诺唯赞生物科技有限公司;pSG5-YY1过表达质粒、pLKO-YY1shRNA载体以及相应的对照载体由美国罗彻斯特大学合作提供。
仪器6孔细胞培养板、T25培养瓶购自美国CORNING公司;荧光倒置显微镜、活细胞工作站购自徕卡显微系统(上海)贸易有限公司;双色激光ODYSSEY成像系统购自美国LI-COR公司;7900HT实时荧光定量PCR仪购自ABI Applied Biosystems公司;电泳槽和电转仪购自美国Bio-Red公司;CO2细胞培养箱、Nanodrop 2000超微量分光光度计购自美国Thermo公司。
1.2 方法
1.2.1 细胞培养 R3/1细胞培养在含10%胎牛血清的RPMI-1640培养基中;HEK293T、A549、H446、H460、H1299细胞培养在含10%胎牛血清的DMEM培养基中。双抗浓度为青霉素(100U/mL)/链霉素(100μg/mL)。细胞均置于37℃、5%CO2细胞培养箱中培养,每2d换新鲜培养基。
1.2.2 RNA提取和qRT-PCR 按试剂说明书,TRIzol法提取细胞总RNA,并采用反转录试剂盒进行反转,使用SYBR Green Master Mix进行qRT-PCR,检测指定基因的mRNA水平。以GAPDH作为标准化参照,目的基因扩增产物的相对表达量根据2-△△Ct计算。实验重复3次,QRT-PCR引物如下。α-sma上游引物: 5′-ACTGAGCGTGGCTACT-CCTT-3′,下游引物: 5′-CATCTCGTTCTCGAAGT-CCA-3′;vimentin上游引物: 5′-GTCTTGACCTTG-AACGCAAA-3′,下游引物: 5′-TGGACATGCTG-TTCCTGAAT-3′;YY1上游引物: 5′-GAGCGGCA-AGAAGAGTTACC-3′,下游引物: 5′-TCTTGATC-TGCACCTGCTTC-3′;GAPDH上游引物: 5′-TGC-ACCACCAACTGCTTAGC-3′,下游引物: 5′-GGC-ATGGACTGTGGTCATGAG-3′。
1.2.3 Western印迹法 细胞加入RIPA裂解液裂解蛋白,BCA法测定蛋白浓度。每组取50~100μg蛋白,SDS-PAGE分离蛋白,电转至PVDF膜,用一抗和相应的荧光二抗孵育后,在ODYSSEY成像系统上进行曝光并记录。
1.2.4 TGF-β1刺激 R3/1细胞以5×104/mL密度种于6孔板中,每孔2mL。待细胞长至60%~70%密度时,用无血清培养基饥饿24h,使细胞同步于静止期,利用终浓度为5ng/mL的TGF-β1刺激24h。提取细胞RNA和蛋白,检测α-sma、YY1等基因的表达。
1.2.5 细胞分组与转染 将R3/1细胞随机分为4组: 空白载体组(pSG5 vector)、过表达YY1组(pSG5 YY1)、空白载体加TGF-β1刺激组(pSG5 vector+TGF-β1)、过表达YY1加TGF-β1刺激组(pSG5 YY1+TGF-β1)。取对数生长期细胞接种至6孔板中,用LipofectamineTM2000脂质体转染质粒,操作按照LipofectamineTM2000说明书进行。转染细胞24h后;加入TGF-β1刺激24h,收集细胞,开展后续实验。
R3/1细胞YY1慢病毒稳定株(pLKO YY1-shRNA)和空白载体慢病毒稳定株(pLKO Ctrl)各随机分为两组,加或不加TGF-β1刺激24h后,收集细胞,开展后续实验。
1.2.6 CCK8细胞增殖实验 将细胞接种于6孔细胞培养板中,分别转染pSG5 vector质粒和pSG5 YY1质粒。转染48h后,消化细胞接种于3块96孔细胞培养板,每组8个复孔,2000个细胞/孔,每孔100μL细胞培养基。12h后细胞贴壁,作为0h。分别在0、24和48h检测细胞。每孔加入10μL CCK8,3h后摇床振荡10min,450nm测吸光度值(A450值)。
1.2.7 细胞质和细胞核蛋白的分离及制备 收集细胞沉淀于1.5mL EP管中。每管加入100μL细胞质裂解缓冲液,剧烈振荡,冰上静置10min。加入NP40 4μL,涡旋5s后,4℃最大转速离心10min,收集的上清即为胞质蛋白。剩余沉淀用300μL PBS冲洗,13300r/min,离心半径9.6cm,离心3min。弃去上清液,每管加入50μL细胞核裂解缓冲液。涡旋20s,冰上静置10min,重复4次。4℃最大转速离心10min,收集上清即为胞核蛋白。开展后续实验。
1.3 统计学处理
2 结 果
2.1 肺泡Ⅰ型上皮细胞R3/1的纤维化程度与YY1表达量呈现负相关性
体外培养并观察肺泡Ⅰ型上皮细胞R3/1、Ⅱ型上皮细胞A549以及肺癌细胞株H446、H460、H1299生长情况。通过形态学观察,发现与其他上皮细胞不同的是,肺泡Ⅰ型上皮细胞R3/1呈现纤维化长梭形。分别制备细胞的RNA,利用QRT-PCR检测细胞纤维化生物标志物α-sma以及vimentin的表达,发现α-sma在肺癌细胞株H446、H460、H1299的表达水平极低,在A549细胞适度表达,而在R3/1细胞特异高表达,其在R3/1细胞中mRNA水平是在A549细胞的25倍左右,见图1A,同样,vimentin mRNA在R3/1细胞中的表达也远高于A549细胞,见图1B。
本课题组以前的工作发现,转录因子YY1对急性肺损伤以及肺纤维化具有重要调控作用,YY1在肺泡Ⅰ型和Ⅱ型上皮细胞是否有相同的功能和机制尚不明确。
本研究制备了肺泡Ⅰ型上皮细胞R3/1以及Ⅱ型上皮细胞A549的蛋白,通过蛋白印迹检测YY1表达,发现YY1在R3/1的表达水平远远低于其在A549细胞的表达水平,见图1C。
可见,在肺泡Ⅰ型上皮细胞R3/1中,细胞纤维化生物标志物高表达,YY1低表达,二者呈现负相关性。

图1 肺泡Ⅰ型上皮细胞R3/1的纤维化程度与YY1表达量呈负相关Fig.1 The degree of fibrosis is negatively correlated withthe expression of YY1 in type Ⅰ AEC R3/1A-B: 利用QRT-PCR,检测R3/1、A549、H446、H460、H1299中,α-sma的mRNA水平(A)及vimentin的mRNA水平(B);C: 利用蛋白质印迹技术,检测YY1在A549和R3/1细胞中的蛋白水平
2.2 过表达YY1抑制细胞纤维化和细胞增殖
为了验证YY1在肺泡Ⅰ型上皮细胞的调控功能,本研究制备了YY1过表达质粒,转染R3/1细胞,通过荧光定量PCR以及蛋白质印迹检测技术,证实了转染后的R3/1细胞YY1表达升高3倍以上,见图2。进一步功能研究发现,R3/1细胞过表达YY1,能够抑制纤维化生物标志物α-sma的表达,QRT-PCR结果显示YY1过表达组中α-sma的表达为vector对照组的23.7%。细胞增殖实验发现,在R3/1细胞中,YY1能够显著抑制细胞增殖,见图3。
急性肺损伤患者,炎症因子和细胞因子等进入到肺泡,引起肺泡上皮细胞发生炎症、纤维化、甚至凋亡,纤维化的同时往往伴随着细胞增殖。上述研究结果表明,YY1在肺泡Ⅰ型上皮细胞R3/1抑制纤维化,抑制细胞增殖。
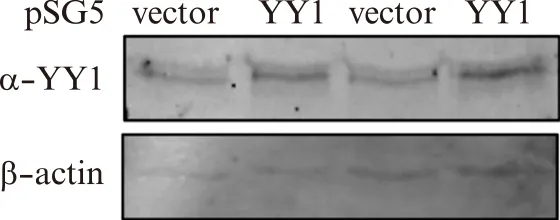
图2 Western印迹法检测R3/1细胞转染YY1过表达质粒后YY1蛋白水平变化Fig.2 The protein levels of YY1 in R3/1 cells after transfected with YY1 plasmid were analyzed by Western blotting
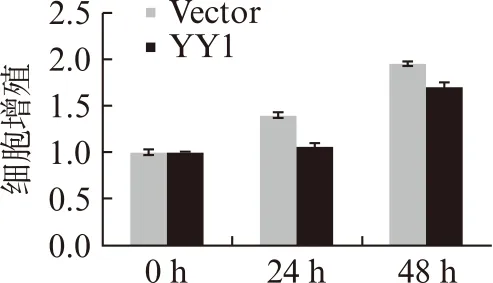
图3 过表达YY1抑制R3/1细胞增殖Fig.3 Overexpression of YY1 reduced the cellularproliferation in R3/1 cells
2.3 YY1负向调控TGF-β1诱导的肺泡Ⅰ型上皮细胞R3/1纤维化
本研究用终浓度5ng/mL的TGF-β1刺激R3/1细胞,24h后,在mRNA和蛋白水平上检测处理前后α-sma和YY1的表达变化,发现细胞纤维化生物标志物α-sma的表达升高6倍以上,而YY1表达没有显著性变化,见图4A。利用YY1过表达的细胞,通过TGF-β1刺激后,在mRNA水平以及蛋白水平,分别检测了细胞纤维化生物标志物α-sma以及vimentin的表达,发现细胞内YY1过表达能够抑制TGF-β1诱导的细胞纤维化,见图4B、4C。
为了进一步确认YY1对肺泡Ⅰ型上皮细胞纤维化的调控功能,本研究利用YY1 shRNA病毒载体,转染R3/1细胞,稳定敲低细胞内YY1的表达,进行细胞纤维化验证。发现YY1的特异敲低能够显著促进α-sma的表达,并能够协同及促进TGF-β1诱导的R3/1细胞纤维化,见图4D。
2.4 YY1抑制TGF-β1诱导的NF-κB质核移位
为了阐明YY1在R3/1细胞调控纤维化的分子机制,对TGF-β1处理前及处理后的R3/1细胞进行细胞质和细胞核蛋白的分离,并利用细胞质蛋白标志物β-actin以及细胞核蛋白标志物Histone进行细胞质核分离的验证和鉴定(图5A)。利用蛋白质印迹实验,检测NF-κB的表达,表明R3/1细胞中NF-κB主要定位于细胞质中,TGF-β1刺激后,促进野生型R3/1细胞NF-κB的质核移位(图5B第4泳道vs第2泳道),但YY1过表达抑制了该过程(图5B第5泳道vs第3泳道)。

图4 YY1负向调控TGF-β1诱导的肺泡Ⅰ型上皮细胞R3/1纤维化Fig.4 YY1 negatively regulated pulmonary fibrosis induced by TGF-β1 in type Ⅰ AEC R3/1A: TGF-β1处理前后α-sma和YY1蛋白水平变化;B: 过表达YY1对TGF-β1处理前后α-sma基因表达的影响;C: 敲低YY1对TGF-β1诱导α-sma和vimentin表达的影响;D: 过表达YY1对TGF-β1诱导α-sma和vimentin表达的影响
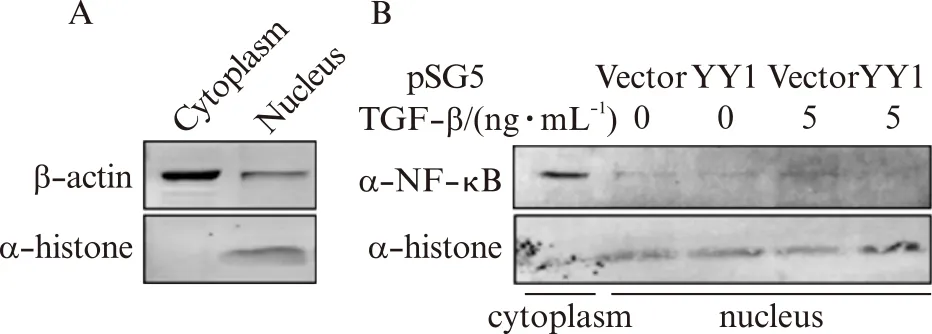
图5 YY1抑制R3/1细胞中TGF-β1诱导的NF-κB质核移位Fig.5 YY1 inhibited relocalization of the NF-κB protein from the cytoplasm to the nucleus induced by TGF-β1 in R3/1 cellsA: 蛋白质印迹法鉴定R3/1细胞的细胞质和细胞核蛋白的分离;B: 蛋白质印迹法检测YY1基因过表达影响TGF-β1诱导的NF-κB质核移位的功能
3 讨 论
急性肺损伤/急性呼吸窘迫综合征和特发性肺纤维化一直是呼吸和危重医学界研究的热点。主要表现为呼吸功能衰竭,死亡率高。由于肺器官的复杂性,手术治疗存在极大的危险性和复杂性。长期以来,糖皮质激素被作为IPF首选药物应用于临床。虽然对患者肺功能指标有所改善,但是对患者生存率没有积极作用。因此,美国及一些欧洲国家IPF临床治疗指南自2002年以后不推荐类固醇药物作为主要治疗药物[10]。虽然吡非尼酮和尼达尼布为抗纤维化治疗带来了一定的福音,但是还不能从源头阻止和逆转肺纤维过程[11-12]。基因靶向治疗被视作治疗肺疾病最有希望的方法之一。肺泡Ⅰ、Ⅱ型上皮细胞功能障碍是导致急性肺损伤和肺纤维化的重要原因,阐明疾病发生发展过程中,这两个亚型肺泡上皮细胞的独特功能及调控机制,有助于寻找治疗急性肺损伤和肺纤维化的特异靶点。
多种细胞因子参与肺泡细胞纤维化的发生,其中TGF-β1起关键性的作用[13]。TGF-β1调节细胞的生长、分化、基质产生和凋亡;在肺组织损伤或炎症时,肺泡细胞、淋巴细胞、单核细胞、巨噬细胞等都能产生及释放TGF-β1,调节细胞的生长和细胞形态学变化[14]。TGF-β1通过诱导细胞基质成分的表达而促进基质的产生,在生理条件下,细胞外基质的产生有利于组织的损伤修复,病理条件下,TGF-β1过表达有可能导致细胞外基质的过度产生而发生纤维化。体外研究中,TGF-β1刺激通常被用于细胞炎症及纤维化模型的制备。本研究发现TGF-β1刺激R3/1细胞后,成纤维细胞标志物α-sma表达也明显增高,证实TGF-β1能够诱导R3/1细胞纤维化。
转录因子YY1具有双重转录活性,发现至今已超过20年。其在基因转录调控、分子信号转导中所表现出的关键作用日益引起人们的重视。YY1最初是在研究真核细胞DNA的转录调控中发现的[15],后来研究发现YY1能够调控癌基因,以转录抑制子、增强子等潜在的转录调控角色,参与肿瘤发生发展[16]。YY1表达在TNF-α和TGF-β1刺激、IPF患者以及两种肺纤维化动物模型中均有异常,提示YY1对肺泡细胞纤维化发生、IPF的发病等有重要调控功能。本研究构建了YY1过表达R3/1细胞瞬转株和YY1基因下调的R3/1细胞慢病毒稳转株,从上调和下调两个方面探讨YY1对TGF-β1诱导肺泡上皮细胞EMT的影响和机制。结果显示过表达YY1会抑制TGF-β1诱导的R3/1细胞纤维化标志分子α-sma的表达。提示,YY1能够抑制肺泡Ⅰ型上皮细胞纤维化。
TGF-β1刺激诱导的细胞炎症及纤维化发生,通常是通过激活NF-κB,促进活化的NF-κB从细胞质转移到细胞核,在转录水平上调控炎性基因以及纤维化基因的表达[17]。本研究发现TGF-β1促进R3/1细胞核中NF-κB的表达,但YY1过表达会抑制TGF-β1诱导的NF-κB入核,提示YY1影响TGF-β1刺激诱导的细胞NF-κB质核移位。
本研究通过TGF-β1诱导的细胞纤维化模型发现,YY1能抑制肺泡Ⅰ型上皮细胞纤维化,主要作用机制可能是通过抑制TGF-β1诱导的NF-κB从细胞质到细胞核的转移,进而抑制其对下游纤维化基因的转录激活。本项目组其他工作已经证实YY1对肺泡Ⅱ型上皮细胞纤维化的特异诱导作用。本研究表明YY1对肺泡Ⅰ型及Ⅱ型上皮细胞纤维化具有不同的调控功能,为今后肺泡细胞亚型特异性的靶向研究及IPF的基因治疗提供了重要的实验基础。但仍需要通过体内实验进一步研究YY1在肺纤维化中具体的分子机制及治疗作用,为YY1作为肺疾病的诊断指标和治疗靶点提供依据。
(感谢美国罗彻斯特大学合作提供pSG5-YY1过表达质粒、pLKO-YY1shRNA载体、以及相应的对照载体)

