JQ1通过抑制Akt/mTOR通路协同阿霉素抑制人骨肉瘤细胞的实验研究
金鸿翔, 董春燕
(1. 同济大学医学院,上海 200092; 2. 上海市杨浦区控江社区卫生服务中心,上海 200093;3. 同济大学附属东方医院肿瘤科,上海 200120)
骨肉瘤是青少年最常见的恶性肿瘤之一,自20世纪70年代开始应用化疗治疗骨肉瘤以来,骨肉瘤患者的5年生存率从不足20%提高到60%。尽管近30~40年来,新的化疗药物和靶向治疗药物层出不穷,骨肉瘤的生存率却停滞不前。对骨肉瘤治疗效果最好的化疗药物仍然是传统的细胞毒性药物,如阿霉素(adriamycin, ADM),顺铂等。
组蛋白乙酰化和去乙酰化是通过染色质重塑调控基因表达的重要表观遗传过程。通过组蛋白去乙酰化酶对组蛋白的赖氨酸残基的乙酰化,减弱了组蛋白与DNA之间的极性相互作用,使基因更容易被转录。通过组蛋白去乙酰基转移酶(HDACs)除去乙酰基,能够逆转这种效应。组蛋白乙酰化读取蛋白,如布罗莫结构和超末端结构域(BET)家族蛋白,能够识别这些乙酰化标记,在特定的启动子区域招募重要转录激活剂,并帮助转录起始和延长基因。这些蛋白功能异常经常会导致疾病如肿瘤的发生,它们可能是新的抗肿瘤治疗的潜在靶点。本研究探讨BET抑制剂JQ1治疗骨肉瘤的潜在可能性,并探索JQ1联合骨肉瘤常规化疗药物ADM治疗骨肉瘤的效果。
1 材料与方法
1.1 试剂与仪器
CCK-8试剂盒购自日本Dojindo公司;FITC Annexin V Apoptosis Detection Kit购自美国BD公司;JQ1购自美国Sigma公司;阿霉素购自中国斯莱克公司;Caspase3抗体、Akt抗体、p-Akt抗体、mTOR抗体、p-mTOR抗体购自美国CST公司;DAB显色试剂盒购自上海碧云天生物技术有限公司。
1.2 方法
1.2.1 CCK8细胞增殖实验 本实验采用的骨肉瘤细胞系143b由骨肿瘤研究所提供。CCK-8试剂盒进行细胞增殖检测。在96孔板每孔中加入0.5×104个骨肉瘤细胞,调整DMEM细胞培养液体积至每孔100μL,设置ADM和JQ1不同浓度处理组,ADM: 0、0.0625、0.126、0.25、0.5、1μmol/L组;JQ1: 0、1.25、2.5、5、10、20μmol/L组。每组细胞接种5个复孔,待细胞贴壁后加入不同浓度的ADM或JQ1干预,培养72h后进行检测;检测当天,向每孔加入10μL的CCK-8溶液,将96板在37℃培养箱内孵育3h后,用酶标仪测定450nm波长处的吸光度(A450)值,取未加药组的值为抑制率0%。
1.2.2 平板克隆形成实验 取对数生长期的各组细胞,分别用0.25%胰蛋白酶消化并吹打成单个细胞,在6孔板中每孔铺500个细胞,分别设置对照组、ADM组(0.2μmol/L)、JQ1组(8μmol/L)和ADM+JQ1组,使细胞分散均匀,置37℃,5% CO2的细胞培养箱中培养2周,弃去上清液,用PBS小心浸洗2次。加4%多聚甲醛5mL固定细胞15min;然后去固定液,加入适量0.1%结晶紫染色液染30min,然后用流水缓慢洗去染色液,空气干燥。在显微镜(低倍镜)下计数大于10个细胞的克隆数。
1.2.3 流式细胞术测定细胞凋亡 采用BD公司(美国)的FITC Annexin V Apoptosis Detection Kit进行细胞凋亡检测。接种适量骨肉瘤细胞于6孔板中,培养过夜后分别设置对照组、ADM组(0.2μmol/L)、JQ1组(8μmol/L)和ADM+JQ1组,处理72h后收集每组细胞,PBS洗涤2次;用1× Binding Buffer重悬细胞,调整细胞密度为1×106/mL;5mL离心管中加入100μL细胞悬液;加入5μL Annexin Ⅴ-FITC混匀,室温下避光放置15min,上机前加入5μL DAPI,采用CytExpert软件进行细胞凋亡分析。Annexin V-FITC阳性、DAPI阴性的细胞被视为早期凋亡细胞,Annexin V-FITC和DAPI都阳性的细胞被视为晚期凋亡细胞。
1.2.4 动物饲养和骨肉瘤细胞143B裸鼠皮下成瘤实验 所有实验动物为BALB/c nu裸鼠,雄性,体质量16~20g,SPF级。裸鼠的饲养操作严格按照同济大学实验动物规定进行。根据裸鼠分笼置于IVC超净层流笼中,每笼小于5只;动物自由进食水,饮用水及饲料均经高压灭菌处理,实验前做适应性喂养。
取状态良好的143b细胞用胰酶消化离心并用PBS悬浮制成3×106个/mL密度的细胞悬液;取6周龄裸鼠背部为成瘤部位穿刺点,消毒穿剌部位,轻轻提起裸鼠皮肤,以0.5mL TB微量注射器于每只成瘤部位皮下迅速注入上述配制的新鲜细胞悬浮液200μL;一共接种24只裸鼠;随机分为对照组、ADM组、JQ1组和ADM+JQ1组。在接种肿瘤体积达到100mm3后开始给药,ADM为腹腔注射(3mg/kg,每3d注射1次),JQ1为腹腔注射(50mg/kg,每日注射),共给药3周,并根据肿瘤体积绘制移植瘤的生长曲线。
1.2.5 免疫组化染色 通过颈椎脱位法处死小鼠,取出新鲜肿瘤标本,依次进行固定、脱水、石蜡包埋,肿瘤组织石蜡标本切片后依次进行脱蜡、热抗原修复、阻断内源性过氧化物酶、Caspase3抗体孵育、DAB显色、苏木精染色、脱水透明、封片、拍照等处理。
1.2.6 蛋白质印迹法检测 对于贴壁细胞,先用4℃预冷的PBS洗3次,然后加入细胞裂解液,在冰上用细胞刮刀将裂解液刮到培养皿一侧,然后将裂解液吸到离心管中,置于100℃干浴仪10min,进行SDS-PAGE凝胶电泳并转膜,分别孵育Akt,p-Akt,mTOR,p-mTOR一抗和相应二抗,在LAS 4000显色系统中进行显影并拍照。
1.3 统计学处理
2 结 果
2.1 阿霉素(ADM)和JQ1能够在体外抑制骨肉瘤细胞的增殖和克隆形成能力
CCK8法检测ADM和JQ1对骨肉瘤细胞的活性抑制,发现ADM和JQ1可以明显抑制骨肉瘤细胞143b的增殖并且呈浓度梯度依赖关系(图1),ADM的IC50为0.23μmol/L,JQ1的IC50为9.47μmol/L。

图1 ADM及JQ1体外对骨肉瘤细胞143b的抑制率Fig.1 Inhibition of Adriamycin and JQ1 on osteosarcoma cell line 143b in vitroA: 不同剂量ADM对骨肉瘤细胞143b的抑制率;B: 不同剂量JQ1对骨肉瘤细胞143b的抑制率
选择低于IC50的药物浓度对143b细胞进行平板克隆形成实验,发现单独应用ADM或JQ1都可以抑制骨肉瘤细胞的克隆形成能力,联合ADM和JQ1则可以显著抑制骨肉瘤细胞的克隆形成能力,见图2A;抑制效果显著优于单独应用ADM或JQ1(P<0.05),见图2B。
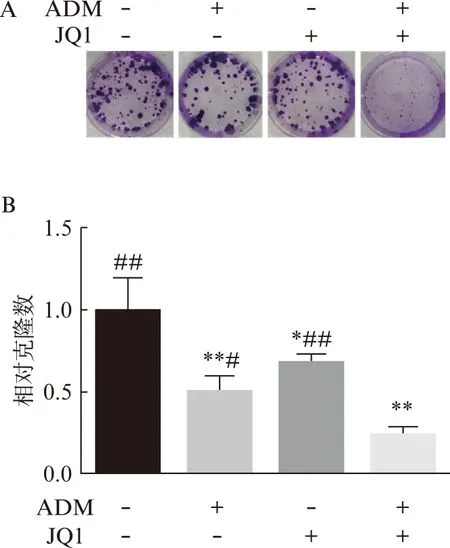
图2 JQ1协同ADM在体外抑制骨肉瘤细胞的平板克隆形成能力Fig.2 Synergistic effect of JQ1 with adriamycin in inhibitingflat plate clone formation of osteosarcoma cells in vitroA: 不同药物浓度对143b细胞平板克隆形成能力的抑制;B: 不同药物浓度对143b细胞平板克隆形成能力抑制的比较;与对照组相比,*P<0.05,**P<0.01;与ADM和JQ1联合组相比,#P<0.05,##P<0.01
2.2 ADM和JQ1能够在体外诱导骨肉瘤细胞凋亡
由于ADM带有红色荧光,因此在进行流式细胞术凋亡检测时,选择了带有蓝色荧光的DAPI而不是红色荧光的PI。将早期凋亡和晚期凋亡一起纳入进行统计分析。通过流式细胞术分析发现,单独应用ADM或JQ1都可以在体外诱导人骨肉瘤细胞系143b的凋亡,单独应用ADM效果优于JQ1。联合ADM和JQ1对骨肉瘤细胞凋亡的诱导,效果显著优于单独应用ADM或JQ1(P<0.05),见图3。
2.3 ADM和JQ1能够在体内抑制肿瘤的生长并诱导骨肉瘤细胞凋亡
为了进一步评价ADM联合JQ1治疗骨肉瘤的疗效,构建了骨肉瘤细胞株143b来源的骨肉瘤裸鼠皮下肿瘤模型。当小鼠皮下肿瘤超过100mm3时开始给药,并每4d观察记录一次小鼠的肿瘤体积。单独应用ADM或JQ1都可以抑制体内骨肉瘤的生长,联合应用ADM和JQ1对体内肿瘤生长的抑制要明显优于单独用药(图4),差异具有统计学意义(P<0.05),见图5。

图3 JQ1协同ADM在体外促进骨肉瘤细胞的凋亡Fig.3 Synergistic effect of JQ1 with ADM on apoptosis of osteosarcoma cells in vitroA: 不同药物浓度对143b细胞凋亡的诱导;B: 不同药物浓度对143b细胞凋亡诱导的比较;与对照组相比,**P<0.01;与ADM组相比,ΔP<0.05;与ADM和JQ1联合组相比,#P<0.05,##P<0.01

图4 JQ1协同ADM在体内抑制肿瘤的生长Fig.4 Synergistic effect of JQ1 with ADM on tumor growth of osteosarcoma cells in vivo and apoptosis

图5 JQ1协同ADM在体内抑制肿瘤的生长Fig.5 Analytic figure of synergistic effect of JQ1 with ADM inhibiting osteosarcoma cells growth in vivo单独应用ADM或JQ1能够抑制肿瘤的生长,联合ADM和JQ1显著抑制肿瘤在小鼠体内的生长;与对照组相比,**P<0.01
对肿瘤组织进行Caspase 3的免疫组化染色,单独应用ADM或JQ1都可以在体内诱导人骨肉瘤细胞143b的凋亡,联合ADM和JQ1显著增强了对骨肉瘤细胞凋亡的诱导,见图6。

图6 JQ1协同ADM在体内诱导骨肉瘤细胞的凋亡Fig.6 Synergistic effect of JQ1 with ADM on tumor apoptosis of osteosarcoma cells in vivo各组肿瘤组织中Caspase 3的免疫组化染色情况;图中标尺为100μm。
2.4 JQ1通过抑制Akt/mTOR通路协同ADM发挥抑制人骨肉瘤细胞的作用
Western印迹法发现骨肉瘤细胞在单独应用ADM后,磷酸化的Akt(p-Akt)和磷酸化的mTOR(p-mTOR)蛋白的表达都上调,见图7,而JQ1能够抑制p-Akt和p-mTOR的表达,而同时应用ADM和JQ1处理过的骨肉瘤细胞中p-Akt和p-mTOR的表达显著低于单独应用ADM组,且联合应用ADM和JQ1后p-mTOR的表达还显著低于对照组,见图7。认为JQ1能够通过抑制Akt/mTOR通路协同ADM发挥抑制人骨肉瘤细胞的作用。
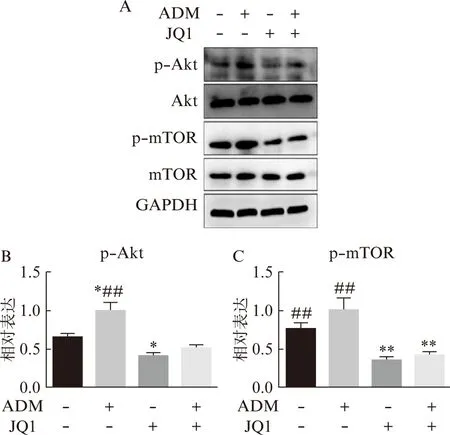
图7 JQ1通过抑制Akt/mTOR通路协同促进ADM对骨肉瘤的抑制作用Fig.7 Synergistic effect of JQ1 with adriamycinin inhibiting human osteosarcoma cells by inhibiting Akt/mTOR pathwayA: 不同处理组骨肉瘤细胞143b的Western印迹法结果;B: 不同处理组骨肉瘤细胞中p-Akt的表达;C: 不同处理组骨肉瘤细胞中p-mTOR的表达;与对照组相比,*P<0.05,**P<0.01;与联合组相比,##P<0.01
3 讨 论
骨肉瘤是比较少见的儿童恶性肿瘤。尽管传统化疗联合手术的综合治疗显著提高了骨肉瘤5年生存率,但近30年来骨肉瘤的生存率却停滞不前,而且越来越多的文献报道了传统化疗的副作用,因此,需要寻找更有效的治疗方式。目前研究发现,儿童少见的恶性肿瘤发病机制中驱动事件仍然是转录因子的突变,例如尤文肉瘤中EWS/FLI基因重排,或者抑癌基因如骨肉瘤P53或RB表达缺失,然而这些驱动事件很难成为药物的作用靶点。因此目前迫切需要在儿童少见的恶性肿瘤中寻找更多的药物作用靶点。
在表观基因组研究中,抗肿瘤药物的目标以去乙酰基转移酶(HDACs)居多,并越来越多集中在参与乙酰化识别的蛋白质。到目前为止,I-BET762和JQ1是两个能够抑制BET家族蛋白的小分子抑制剂。JQ1是包含布罗莫结构蛋白4(BRD4)的抑制剂,BRD4能够招募正转录延伸因子B(P-TEFb)复合体到染色质,并通过磷酸化RNA聚合酶Ⅱ促进转录。JQ1能够竞争结合到BRD4识别赖氨酸乙酰化的口袋结构中,阻止BRD4和染色质的结合,从而抑制基因的转录。JQ1对多种血液肿瘤具有治疗效果,包括急性髓细胞性白血病、多发性骨髓瘤和急性淋巴细胞白血病。在这些癌症中,JQ1的抗肿瘤作用主要是通过抑制过度表达的癌基因c-myc而发挥作用的[5-6]。JQ1还具有对多种实体肿瘤,如肺腺癌,神经母细胞瘤和成神经管细胞瘤的抑制作用。而越来越多的研究表明,抑制c-myc基因并不是JQ1发挥抗肿瘤作用的主要原因,JQ1能通过调控其他基因(如抑制白细胞介素7受体和影响自噬基因)来治疗急性淋巴细胞白血病[4,9],以及抑制FOS样相关抗原和eIF4E从而治疗肺癌[10]。考虑到不同癌症类型的组蛋白乙酰化模式的巨大差异,JQ1在治疗不同肿瘤时所发挥的功能可能和不同肿瘤中依赖组蛋白乙酰化而过表达的基因相关,因此,JQ1能被用于多种肿瘤的治疗,也可能成为化疗方案选择较少的骨肉瘤(OS)的治疗选择之一。
本研究发现,体外单独应用ADM或JQ1都能够抑制骨肉瘤细胞系143b的平板克隆能力并促进其凋亡,而联合ADM和JQ1对骨肉瘤细胞平板克隆能力的抑制和凋亡的诱导都明显优于单独用药。体内实验也证明联合ADM和JQ1能够显著抑制肿瘤的生长,并诱导骨肉瘤细胞的凋亡,联合用药明显优于单独用药。因此,认为ADM联合JQ1可能可以更加有效地治疗骨肉瘤。
一项包含59例骨肉瘤病例的全外显子测序研究发现,除了传统的TP53突变几乎存在于所有骨肉瘤病例中,还发现24%左右的病例存在PI3K/mTOR通路的突变[11]。研究[12]提示mTOR通路和肿瘤发生发展密切相关。近年来,mTOR抑制剂针对骨肉瘤的Ⅰ-Ⅱ临床实验结果显示,在一些骨肉瘤病例中,mTOR抑制剂有较好的治疗效果[13],同时使用组合的多激酶抑制剂能够在体外和体内通过抑制mTORC1和mTORC2的活性,抑制骨肉瘤细胞株的生长[14]。而在本研究中发现单独应用ADM能够激活骨肉瘤细胞中的Akt/mTOR通路,而JQ1能够抑制骨肉瘤细胞中的Akt/mTOR通路。
综上认为,ADM联合JQ1能够在体外和体内有效抑制骨肉瘤细胞的生长,并诱导骨肉瘤细胞的凋亡。ADM联合JQ1可能能够更加有效地治疗骨肉瘤。此外,JQ1可能是通过抑制Akt/mTOR通路协同ADM发挥抑制人骨肉瘤细胞作用的。

