黑枸杞花青素微胶囊溶液抗氧化功能的评价
常应九,束彤,高庆超,王树林,*
(1.青海大学农牧学院,青海西宁810016;2.青海省食品检验检测院,青海西宁810001)
抗氧化(anti-oxidant)是通过减少机体内自由基的含量,或者消耗机体内容易产生自由基的物质,防止自由基进一步生成,从而达到延缓机体衰老,减少机体疾病和提高机体抗疲劳能力等目的。抗氧化物质可以自身合成,也可以从食物摄取。所以,具有抗氧化功能的保健品、食品的市场需求越来越大,已成为保健品食品主要的研发方向。
青稞是青藏高原上特有的粮食作物,用青稞提取出的多酚物质喂食小鼠,发现小鼠体内总胆固醇、动脉粥样硬化指数水平均有不同程度的降低,小鼠体内抗氧化基因的表达也明显改善[1]。
关于黑果枸杞及其花青素的抗氧化功效的研究,近年来也越来越受到国内外学者的关注。段雅彬等人通过对辐射损伤小鼠进行灌胃黑果枸杞提取液,发现黑果枸杞提取液能够促进辐射损伤小鼠的体重、血象、脾脏等恢复,增强抗氧化酶活力,减少机体内细胞的凋亡[2]。张玲艳等通过进行体外试验,确定黑果枸杞中的花青素可以有效地对·OH和DPPH·等自由基进行清除,花青素浓度越高,清除自由基的能力越强[3]。陶大勇等通过对黑果枸杞色素抗氧化效果的研究,得出黑果枸杞色素能够提高实验小鼠的全血谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)活性、红细胞超氧化物歧化酶(superoxide dismutase,SOD)活性,降低小鼠体内的丙二醛含量,证明黑果枸杞色素确实具有抗氧化活性[4]。
本研究是在成功制备改性青稞β-葡聚糖荷载黑枸杞花青素微胶囊的基础上,参考保健食品检验与评价技术规范(2003版)中的抗氧化试验指导[5],进行的改性青稞β-葡聚糖荷载黑枸杞花青素微胶囊抗氧化功能性试验。
1 材料与方法
1.1 材料与仪器
1.1.1 主要材料与试剂
黑果枸杞花青素提取物:青海省康元药用资源开发有限公司;改性青稞β-葡聚糖:杭州众芝康菇生物技术有限公司;抗坏血酸(维生素C):上海广诺化学科技有限公司(分析纯);SPF级BALB/c纯系小白鼠:中国农业科学院兰州兽医研究所;总超氧化物歧化酶(total superoxide dismutase,T-SOD)测试盒、谷胱甘肽过氧化物酶(GSH-Px)测试盒:南京建成生物有限公司。
1.1.2 主要仪器设备
LDZM-60KCS立式压力蒸汽灭菌器:上海申安医疗器械厂;UV-2600分光光度计:上海精密仪器厂;H/T16MM台式高速离心机:湖南赫西装备仪器有限公司。
1.2 受试样品的制备
1.2.1 低剂量受试样品的制备
取2 g改性青稞β-葡聚糖,800 mg黑果枸杞花青素提取物,制备微胶囊溶液,溶液黑果枸杞花青素提取物浓度为1 mg/mL,调节pH值至3.5,4℃避光保存。
1.2.2 中剂量受试样品的制备
取浓度为1.0 mg/mL的样品溶液480 mL,旋转蒸发至120 mL,得到浓度为4 mg/mL的样品溶液,4℃避光保存。
1.2.3 高剂量受试样品的制备
取浓度为1.0 mg/mL的样品溶液960 mL,旋转蒸发至120 mL,得到浓度为8 mg/mL的样品溶液,4℃避光保存。
1.2.4 阳性对照组受试物的制备
取100 mg抗坏血酸(维生素C)溶于50 mL的灭菌水中,制备成2mg/mL的抗坏血酸溶液,4℃避光保存。
1.3 试验方法
1.3.1 剂量分组与灌胃
正常人体黑枸杞干果推荐摄入量为5 g/(60 kg·d),根据动物与人体间的等效剂量换算[6],依据其花青素含量换算[7],得出小鼠每日所推荐摄入黑枸杞花青素的量为0.16 mg/20 g。由于受试样品中花青素纯度为20%,故小鼠每日推荐摄入受试样0.8 mg/20 g,在此基础上减小和增大倍数,设置低、中、高3个剂量组,对应黑果枸杞花青素提取物浓度为1、4、8 mg/mL,因受试样品黏稠度限制,故剂量组之间倍数差异较小。另设1个阳性对照组(根据抗坏血酸的人体推荐量[8]换算得2 mg/mL抗坏血酸)和1个空白对照组(0.9%生理盐水),对小鼠进行灌胃。
小鼠在实验条件下进行7 d适应期后,随机分为上述5组,每组各30只。每日定时经口灌胃,灌胃量为0.2 mL(/只·d),连续灌胃30 d,灌胃期间小鼠自由采食取水。
1.3.2 试验测定指标
取血清测定抗氧化酶活力(SOD活力水平、GSHPx活力水平),取肝组织匀浆测定抗氧化酶活力(SOD活力水平、GSH-Px活力水平)和过氧化脂质含量[丙二醛(malondialdehyde,MDA)含量、褐脂质含量],另测小鼠体重及脏器湿重。
1.3.3 数据处理
采用SPSS 21.0和Excel 2007对数据进行统计分析,统计结果为±s,采用方差分析比较各组结果差异。
2 结果与分析
2.1 改性青稞β-葡聚糖荷载黑枸杞花青素微胶囊溶液对小鼠脏器湿重的影响
改性青稞β-葡聚糖荷载黑枸杞花青素微胶囊溶液对小鼠脏器湿重的影响试验结果见表1。

表1 改性青稞β-葡聚糖荷载黑枸杞花青素微胶囊溶液对小鼠脏器湿重的影响Table 1 The effect of the solution of microencapsulation loading anthocyanins of Lycium ruthenicum Murr by modified β-glucan from highland barley on wet heavy of mouse viscera
由表1可知,对小鼠灌胃不同浓度的黑枸杞花青素微胶囊溶液30天后,各剂量组小鼠脏器湿重与空白对照组均无明显差异(p>0.05)。表明用不同浓度受试样品灌胃小鼠,并没有引起小鼠脏器的异常变化。
2.2 改性青稞β-葡聚糖荷载黑枸杞花青素微胶囊溶液对小鼠血清和肝组织中SOD酶活力的影响
改性青稞β-葡聚糖荷载黑枸杞花青素微胶囊溶液对小鼠血清/组织中SOD酶活力的影响见表2。
由表2可知,阳性对照组和低、中、高剂量组的小鼠肝组织的SOD活力均极显著高于空白对照组,其中高剂量组(8 mg/mL)酶活性最高。在测定试验小鼠血清中的超氧化物歧化酶(SOD)活力的指标中,阳性对照组极显著高于空白对照组(p<0.01);低、高剂量组显著高于空白对照组(p<0.05)。
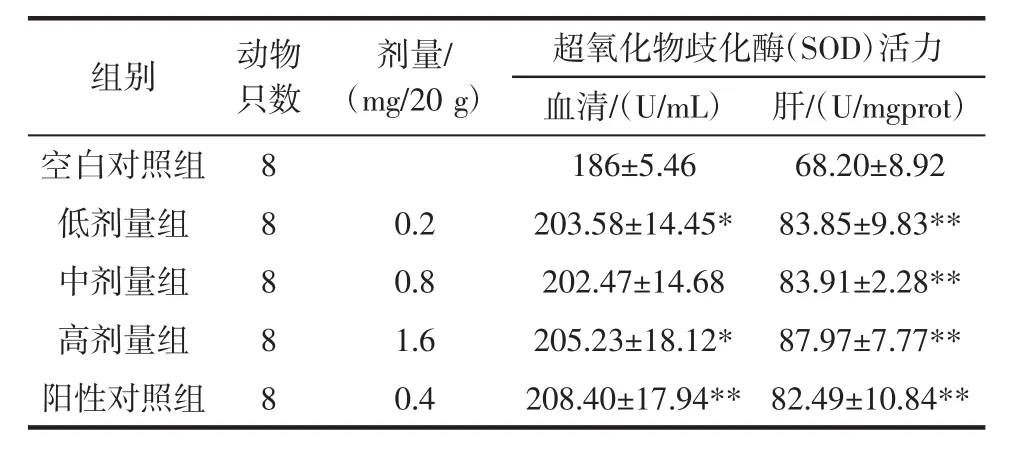
表2 改性青稞β-葡聚糖荷载黑枸杞花青素微胶囊溶液对小鼠血清/组织中SOD酶活力的影响Table 2 The effect of the solution of microencapsulation loading anthocyanins of Lycium ruthenicum Murr by modified β-glucan from highland barley on SOD activity in serum/tissue of mice
2.3 改性青稞β-葡聚糖荷载黑枸杞花青素微胶囊溶液对小鼠血清和肝组织中GSH-Px酶活力的影响
改性青稞β-葡聚糖荷载黑枸杞花青素微胶囊溶液对小鼠血清/肝组织中GSH-Px酶活力的影响试验结果见表3。
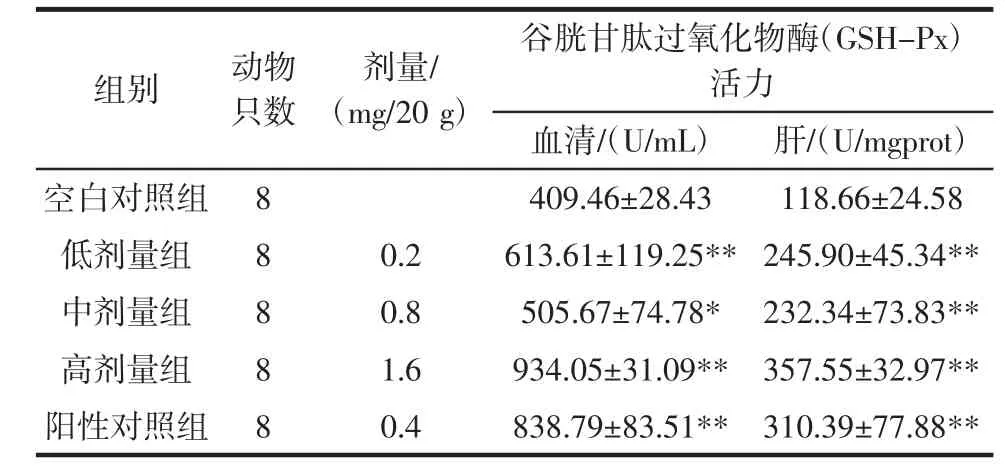
表3 改性青稞β-葡聚糖荷载黑枸杞花青素微胶囊溶液对小鼠血清/组织中GSH-Px酶活力的影响Table 3 The effect of the solution of microencapsulation loading anthocyanins of Lycium ruthenicum Murr by modified β-glucan from highland barley on GSH-Px activity in serum/tissue
由表3可知,阳性对照组和低、中、高剂量组小鼠肝组织的GSH-Px活力均极显著高于空白对照组(p<0.01),其中高剂量组(8 mg/mL)组织中 GSH-Px活力最高。阳性对照组和低、高剂量组小鼠血清中谷胱甘肽过氧化物酶(GSH-Px)活力均极显著高于空白对照组(p<0.01),其中高剂量组(8 mg/mL)组织中 GSH-Px活力最高。
2.4 改性青稞β-葡聚糖荷载黑枸杞花青素微胶囊溶液对小鼠肝组织中过氧化脂质降解产物MDA含量的影响
改性青稞β-葡聚糖荷载黑枸杞花青素微胶囊溶液对小鼠肝组织中过氧化脂质降解产物丙二醛(MDA)含量的影响试验结果见表4。

表4 改性青稞β-葡聚糖荷载黑枸杞花青素微胶囊溶液对小鼠肝组织中MDA含量的影响Table 4 The effect of the solution of microencapsulation loading anthocyanins of Lycium ruthenicum Murr by modified β-glucan from highland barley on MDA in tissue of mice
由表4可知,3种不同剂量浓度的受试样品对小鼠组织中MDA含量的降低均有影响(p<0.05),且效果好于阳性对照组,但3种不同剂量浓度测得结果间差异不明显(p>0.05)。
2.5 改性青稞β-葡聚糖荷载黑枸杞花青素微胶囊溶液对小鼠肝组织中脂褐质含量的影响
改性青稞β-葡聚糖荷载黑枸杞花青素微胶囊溶液对小鼠肝组织中脂褐质含量的影响试验结果见表5。

表5 改性青稞β-葡聚糖荷载黑枸杞花青素微胶囊溶液对小鼠肝组织中脂褐质含量的影响Table 5 The effect of the solution of microencapsulation loading anthocyanins of Lycium ruthenicum Murr by modified β-glucan from highland barley on Lipofuscin in tissue of mice
由表5可知,3种不同剂量浓度的受试样品对小鼠组织中脂褐质含量的降低有不同程度的效果,其中阳性对照组和高剂量组小鼠组织中脂褐质含量极显著低于空白对照组(p<0.01),且试验组剂量越大,脂褐质含量降低越明显。
3 讨论
SOD在清除活性氧的过程中,是首个参与催化的酶,有着最为显著的抗氧化效果。它可以将超氧根阴离子自由基歧化生成分子氧和过氧化氢[9]。因此通过比较SOD活力水平的高低可以直接反映机体抗氧化能力的强弱。机体内的GSH-Px可以提供氢,催化发生还原作用,将大多数有机氢过氧化物(ROOH)还原生成有机氢氧化物(ROH),从而降低了ROOH对机体造成的损伤[10]。本试验表明改性青稞β-葡聚糖荷载黑枸杞花青素微胶囊溶液能够不同程度地提高试验小鼠血清和肝脏组织中SOD活力和GSH-Px活力。
在生物机体内,自由基的存在,会使脂质发生过氧化,其产物是MDA。MDA的积累可能引发蛋白质、核酸等发生聚合,使细胞产生毒性,加剧膜损伤[11]。MDA的水平能够间接反映脂质过氧化的程度。MDA的形成会进一步损害细胞,进而产生脂褐素。脂褐素在细胞内积累,损伤细胞的同时,影响细胞新陈代谢,使细胞活性下降,导致机体衰老[12]。所以脂褐素的含量可反映机体被氧化的程度。本实验表明改性青稞β-葡聚糖荷载黑枸杞花青素微胶囊溶液能够不同程度地降低试验小鼠组织中过氧化脂质(MDA、脂褐质)的含量。
研究发现桑椹果、荔枝壳的提取物中含有丰富花青素,在抗氧化活性方面效果突出,具有强清除超氧阴离子能力,可明显降低血脂[13]。另外,黑果枸杞花青素可提高机体内GSH酶含量,降低丙二醛含量,具有良好的抗氧化能力[14]。本次试验结果与近些年来关于花青素的研究结果相符合。但试验中3个剂量组抗氧化效果差异不明显,分析主要原因是由于实际溶液粘稠度的限制,所设置的3组剂量浓度的浓缩比例差别不够大,可能导致各剂量组间的差异不明显。
由于花青素本身性质不稳定,在光照、高温、碱性等条件下会发生不同程度变性,使其抗氧化活性降低,而在酸性和低温下较稳定[15],所以维持并提高花青素稳定性是花青素类产品开发的关键。本试验采用改性青稞β-葡聚糖对黑果枸杞花青素进行包埋,制成微胶囊溶液,并进行调节pH值,从而达到提高黑果枸杞花青素稳定性、维持黑果枸杞花青素抗氧化活性的目的。
同时有研究表明青稞β-葡聚糖可以显著降低机体内血脂含量,无毒性,有一定的抗氧化能力[16],所以不排除改性青稞β-葡聚糖起到了提高微胶囊产品溶液的部分抗氧化功效。
4 结论
综上所述,改性青稞β-葡聚糖荷载黑枸杞花青素微胶囊溶液可以显著提高试验小鼠机体抗氧化能力。

