不同采收期乌天麻中多糖的提取及含量测定
马风伟,李莹,潘成,曹森,张光文,王瑞,杨兴成,邓青芳
(1.贵阳学院食品与制药工程学院,贵州贵阳550005;2.贵州乌蒙腾菌业有限公司,贵州毕节551601;3.贵州师范大学贵州省山地环境信息系统与生态环境保护重点实验室,贵州贵阳550001)
天麻(Rhizoma Gastrodiae)为兰科植物天麻(Gastrodia elata Bl.,G.elata)的干燥块茎。具有息风止痉、平抑肝阳、祛风通络的功效,临床多用于治疗小儿惊风、癫痫抽搐、破伤风、头痛眩晕、手足不遂、肢体麻木、风湿痹痛等症[1-3]。多糖是由醛糖或酮糖通过糖苷键聚合连接组成的生物大分子化合物。其功能除具有骨架结构(如纤维素、壳聚糖)和储存养分(如淀粉、糖原)外,有些多糖还具有特殊的生物活性[4-9]。天麻多糖是天麻的活性成分之一,不仅含量高,且具有增强免疫力、改善记忆、清除自由基、抗病毒、抗血压等药理作用[10-14]。随着卫生部将天麻列为药食两用品种,天麻保健功能方面的开发利用前景广阔,因此加速天麻多糖的开发尤为重要[15-16]。
本试验采用单因素试验研究提取时间、提取温度、液固比对多糖得率的影响,并结合响应面法优化提取工艺参数。最后应用优化的提取方案对不同采收期的贵州大方乌天麻中的多糖进行提取并进行含量测定。
1 材料与方法
1.1 材料与试剂
D-无水葡萄糖对照品:中国食品药品检定研究院,批号110833-201707;氯仿、浓硫酸、丙酮、无水乙醇、正丁醇、苯酚均为国产分析纯:天津市科密欧化学试剂有限公司。
天麻药材:购自贵州乌蒙腾菌业有限公司,并经贵州师范大学陈华国教授鉴定为兰科植物天麻的块茎,样本保存在贵阳学院食品与制药工程学院,贮存编号分别为:20180010、20180011、20180012。
1.2 仪器与设备
UV-2700紫外-可见分光光度计:日本岛津制作所;FA1004电子分析天平:上海良平仪器仪表有限公司;HH-8数显恒温循环水浴锅:上海梅香仪器有限公司;FD-1C-80真空冷冻干燥机:北京博医康试验仪器有限公司;GZX-9146MBE电热鼓风干燥箱:上海博讯医疗生物仪器股份有限公司;SK7200H高频台式超声波清洗器:上海科导超声仪器有限公司。
1.3 方法
1.3.1 天麻粗多糖的制备
称取干燥至恒重的天麻粉末(过60目筛)10.0 g,依次经石油醚、无水乙醇50 mL回流脱脂、脱色素处理2次,每次60 min,药渣挥干至无醇味,加水300 mL在80℃下提取2小时后过滤,滤液减压浓缩至20 mL,加入Sevag试剂(氯仿∶正丁醇=5∶1,体积比)10 mL以除去游离蛋白质,重复7次,滤液加入无水乙醇使乙醇浓度达80%,静置过夜,离心(3 000 r/min)过滤,滤渣用少量无水乙醇、丙酮洗涤,然后加蒸馏水溶解,冷冻干燥,即得天麻粗多糖。
1.3.2 天麻粗多糖中糖含量的测定
改良的硫酸-苯酚法[17-18]进行测定。
1.3.2.1 标准曲线的建立
取干燥至恒重(105℃,6 h)的D-无水葡萄糖标准品10 mg,精密称定,置于100 mL容量瓶中,加水溶解并稀释至刻度。分别精密吸取 200、300、400、500、600、700 μL标准品溶液置于具塞试管中,分别加入蒸馏水使体积为1.0 mL,然后加入5%的苯酚溶液1.0 mL并迅速加入浓硫酸5.0 mL,摇匀后在室温放置5 min后置沸水中加热10 min,取出后流水冷却至室温;另取蒸馏水1.0 mL加入苯酚和硫酸,同上操作为空白对照。于490 nm波长下测定吸光度。以葡萄糖浓度c为横坐标(X),吸光度值A为纵坐标(Y)绘制标准曲线。
1.3.2.2 样品中多糖含量的测定
称取天麻粗多糖10 mg,精密称定,置于100 mL容量瓶中,加水稀释定容。吸取天麻粗多糖溶液1.0mL,然后按标准曲线制备项下方法操作,测定吸光度,用回归方程计算天麻粗多糖中的糖浓度,并计算多糖含量。
1.3.3 天麻多糖得率的计算
天麻多糖得率的计算公式如下:
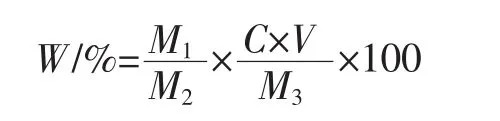
式中:W为天麻多糖得率,%;C为从回归曲线中计算得出的糖浓度,mg/mL;V 为定容体积,mL;M1为天麻粗多糖质量,mg;M2为天麻原料质量,mg;M3为配制天麻粗多糖溶液时称取的质量,mg。
1.4 天麻多糖提取的单因素考察
1.4.1 液固比对天麻多糖得率的影响
称取干燥的天麻粉末10.0 g,经脱脂、脱色素处理后,按照液固比分别为 10∶1、20 ∶1、30 ∶1、40 ∶1、50∶1(mL/g)加水提取,提取温度为80℃,提取时间75 min,然后按照1.3.1试验方法处理,并用硫酸-苯酚法测定糖含量,计算多糖得率。
1.4.2 提取温度对天麻多糖得率的影响
称取干燥的天麻粉末10.0 g,经脱脂、脱色素处理后,液固比 30 ∶1(mL/g),提取温度分别为 50、60、70、80、90℃,提取时间75 min,然后按照1.3.1操作,计算多糖得率。
1.4.3 提取时间对天麻多糖得率的影响
称取干燥的天麻粉末10.0 g,经脱脂、脱色素处理后,液固比 30∶1(mL/g),提取温度 80℃,提取时间分别为 30、45、60、75、90 min,然后按照 1.3.1 操作,计算多糖得率。
1.5 响应面法优化试验
根据响应面Box-Behnken的设计原理,称取干燥的天麻粉末10.0 g,在单因素考察的基础上,以液固比(A)、提取温度(B)、提取时间(C)为自变量,以天麻多糖得率为响应值,进行响应面法优化试验,其因素与水平见表1。

表1 响应面法试验的因素及水平Table 1 Factors and levels of the independent variables for response surface methodology
1.6 不同采收期乌天麻中多糖含量的测定
取不同采收期(立冬、冬至、立春)的大方乌天麻,干燥后粉碎过筛,然后按照1.5优化的提取工艺参数制备天麻粗多糖,然后称取天麻粗多糖粉末,按照1.3.2方法测定多糖含量,计算多糖得率。
1.7 统计分析
采用SPAW 18.0对数据进行统计分析,结果以平均值±标准差表示。其中P<0.05为统计性显著差异,P<0.01为统计性差异极为显著。
2 结果与分析
2.1 标准曲线与线性范围
以葡萄糖浓度c为横坐标(X),吸光度A为纵坐标(Y),绘制标准曲线,如图1所示,回归方程为:Y=10.838X-0.006 2,R2=0.998 5,说明葡萄糖标准品溶液在浓度为0.020 6 mg/mL~0.072 1 mg/mL的范围内线性关系良好。

图1 葡萄糖标准曲线Fig.1 Calibration curve obtained by glucose
2.2 单因素考察结果
2.2.1 液固比对天麻多糖得率的影响
在提取温度为80℃,提取时间为75 min的条件下,不同液固比对天麻多糖得率的影响如图2所示。

图2 液固比对天麻多糖得率的影响Fig.2 Effect of liquid-solid ratio on polysaccharide extraction rate
由图 2 可知,液固比在 10 ∶1(mL/g)~30 ∶1(mL/g)范围内,天麻多糖得率从17.46%快速增加到28.44%,而液固比在 30 ∶1(mL/g)~40 ∶1(mL/g)范围内时,多糖得率增加趋势明显放缓,这可能是随着液固比的增加,天麻组织中的多糖被浸提完全,而在液固比为50 ∶1(mL/g),多糖得率为 28.23%,呈现下降趋势,可能是液固比的增加,导致提取溶剂的体积增加,同时无水乙醇用量增加,在水提醇沉及纯化过程中出现多糖损失增加,导致天麻多糖的得率出现下降。因此选择液固比选为 30 ∶1(mL/g)。
2.2.2 提取温度对天麻多糖得率的影响
在液固比为 30∶1(mL/g),提取时间为 75 min的条件下,不同提取温度对天麻多糖得率的影响如图3所示。

图3 提取温度对天麻多糖得率的影响Fig.3 Effect of temperature on polysaccharide extraction rate
由图3可知,在温度50℃~70℃范围内,随着温度的升高,多糖得率增加显著,当温度为80℃时,天麻多糖得率达到最大值,继续升高温度,多糖得率开始下降,这可能是因为适当的温度增加有助于多糖分子的热力学运动,促进其溶出,但过高的温度会引起多糖分析的聚合或降解,使其溶解度改变。因此提取温度选为80℃。
2.2.3 提取时间对天麻多糖得率的影响
在液固比为 30∶1(mL/g),提取温度为 80 ℃时,研究不同提取时间对天麻多糖得率的影响,结果如图4所示。
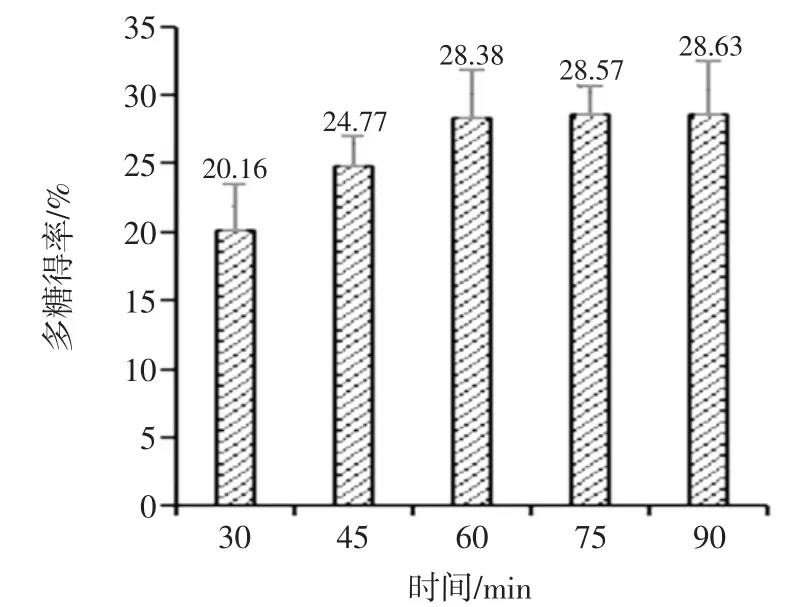
图4 提取时间对天麻多糖得率的影响Fig.4 Effect of time on polysaccharide extraction rate
由图4可知,在30 min~60 min范围内,随着提取时间的延长,多糖得率不断增加;当提取时间在75 min时,多糖得率趋于稳定,达到28.57%,继续延长提取时间,多糖得率基本稳定,这可能是在75 min后,提取液与天麻细胞内的多糖浓度达到平衡。因此提取时间选为75 min。
2.3 响应面法优化试验结果
2.3.1 响应面法试验设计
在单因素考察结果的基础上,采用Design-Expert 8.06软件对试验数据进行多元回归拟合,响应面法试验设计见表2,通过响应面法拟合得到天麻多糖得率的二次多元回归方程:Y=30.20+3.15×A-2.54×B-0.21×C+1.40×AB+3.55×AC-0.18×BC-4.41×A2-3.79×B2-3.19×C2,R2=0.975 0。

表2 响应面法试验设计与结果Table 2 Experimental design and the results for response surface methodology

续表2 响应面法试验设计与结果Continue table 2 Experimental design and the results for response surface methodology
方差分析结果如表3所示。

表3 方差分析Table 3 Data of variance analysis
由表3可知,失拟项不显著,表明所得方程的模拟成功,试验值与预测值有很好的拟合度,可以采用该模拟方程对天麻多糖得率的提取工艺进行预测和优化分析。液固比(A)和提取温度(B)对天麻多糖得率的影响极为显著(P<0.01),二次项对多糖得率都呈现极显著影响;液固比(A)与提取时间(C)对多糖得率具有极显著影响。
2.3.2 响应面结果分析
液固比、提取温度和提取时间3个因素的两两交互作用对天麻多糖得率影响的响应面图如图5所示。

图5 响应面图Fig.5 The response surface map
响应面图可以显示各试验因素的不同水平之间与响应值的函数关系,同时可以较直观的获取试验设计中的最优工艺参数。由图5可以看出,液固比的坡面比提取时间要陡峭(图5b),说明液固比对天麻多糖得率影响较大;提取温度的坡面比提取时间要陡(图5c),说明提取温度对天麻多糖得率影响较大。通过对响应面图的陡峭程度分析,发现液固比与提取温度对天麻多糖得率的影响最大,而提取时间对其影响较小,这与前述方差分析结果一致。由响应面得出最佳提取工艺为:液固比 34∶1(mL/g)、提取温度 77℃、提取时间78 min,在此提取条件下,天麻多糖的预测得率为31.14%。
2.3.3 验证试验
在响应面法优化的最佳工艺条件下,进行3次验证试验,为使现实中更加便捷地进行试验,将提取温度设定为75℃,提取时间设定为80 min,结果显示,天麻多糖得率为:30.88%,相对标准偏差为0.67%,实际值和预测值相差仅为0.26%,说明响应面法优化的提取工艺参数准确可行。
2.4 不同采收期贵州大方乌天麻中多糖含量的测定
采用优化的最佳提取工艺条件,对不同采收期贵州大方乌天麻中的多糖进行提取,并进行含量测定,计算多糖得率,结果见表4。

表4 不同采收期乌天麻中的多糖得率(n=3)Table 4 Results of polysaccharides content determination of G.elata samples obtained from different harvest periods(n=3)
由表4可知,不同采收期乌天麻中多糖的得率差异显著,其中冬至采收的乌天麻中多糖得率最高,最高达到32.2%,其次为立冬采收,而立春采收的乌天麻中多糖得率最低,最低为20.6%。同时发现,不同采收期乌天麻中的多糖得率均大于20%,表明在这一段时间内采收均能保证天麻多糖的含量。
3 结论
本文采用响应面法对天麻多糖的提取工艺进行优化,确定最佳提取工艺为:液固比34∶1(mL/g)、提取温度77°C、提取时间78 min,在此提取条件下,天麻多糖的预测得率为31.14%。通过验证试验发现天麻多糖得率为:30.88%,相对标准偏差为0.67%,实际值和预测值相差仅为0.26%,说明响应面法优化的提取工艺参数准确可行。最后采用优化的多糖提取工艺对不同采收期的贵州大方乌天麻中的多糖进行提取及含量测定,发现不同采收期乌天麻中的多糖得率差异显著,其中冬至采收的乌天麻中多糖得率最高,最高可达32.2%。本研究对天麻多糖的工业化提取及深度开发利用具有一定的参考价值。

