玫瑰花多糖提取工艺优化及其抗氧化活性研究
梁启超,邹玉龙,张秀萍,吴宜艳,*,张朝立
(1.牡丹江医学院 药学院,黑龙江牡丹江157011;2.牡丹江医学院附属红旗医院 药学部,黑龙江牡丹江157011)
玫瑰花是蔷薇科植物玫瑰Rosa rugosa Thunb.的初开放的花或干燥花蕾[1],在全球范围内广泛种植,但多数分布于北半球,以中西欧,亚洲等国家为主;在我国的栽培历史悠久,目前在全国各地均有种植。玫瑰花甘温、微苦、无毒,具有利胆、预防心脏病、降血脂、抗菌等功效[2-6],是一种良好的食药两用及观赏花卉,在化妆品、酿酒、制糖、糕点、制茶和饮料等行业广泛应用[7-9],这些工业生产过程中,产生了大量含有多糖的玫瑰花渣。多糖为玫瑰花的重要活性成分之一,具有抗氧化、清除自由基、降血糖等作用[10-12]。以往玫瑰花多糖提取工艺常采用单因素试验和正交试验,但是这些方法预测性不佳[13-14]。本研究以玫瑰多糖得率为指标,在单因素试验考察基础上,应用星点设计-响应面法建立玫瑰花多糖得率与提取温度、提取时间和料液比3个因素的数学模型,优化玫瑰花多糖提取工艺。采用紫外-可见光谱、红外光谱扫描初步分析玫瑰花多糖结构,并进一步考察其体内抗氧化活性,为玫瑰花资源充分利用提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
玫瑰花:安徽汉枫中药饮片公司;超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px) 和丙二醛(malondialdehyde,MDA)试剂盒:南京建成生物工程研究所;D-无水葡萄糖、D-半乳糖:阿拉丁试剂公司;其他试剂国产分析纯;昆明小白鼠(雌性,20 g~24 g):牡丹江医学院实验动物中心。
旋转蒸发器(R-250型):上海申胜生物技术有限公司;高速冷冻离心机(L03GH型):盐城市凯特实验仪器有限公司;真空冷冻干燥机(FDS-1000型):东京理化器械株式会社;紫外可见分光光度计(Cary 300型)、红外光谱仪(Scimitor 800型):美国瓦里安技术中国有限公司。
1.2 试验方法
1.2.1 玫瑰花多糖的提取工艺流程
玫瑰花→粉碎(过40目筛)→石油醚脱脂(索氏提取,无水乙醇,各回流4 h)→真空室温干燥→准确称取经处理的玫瑰花粉末2.0 g,置于锥形瓶中→在选定的不同条件下热水提取玫瑰花多糖→提取液离心(3 500 r/min,10 min)→上清液经除蛋白、脱色→醇沉→离心(3 500 r/min,10 min)得沉淀→冷冻干燥→得玫瑰花多糖。
1.2.2 玫瑰花多糖含量测定
采用苯酚-硫酸法测量玫瑰花多糖含量。精密称取无水葡萄糖标准品20 mg,加水至250 mL容量瓶,摇匀,得标准品溶液。分别吸取 0、10、20、30、40、50 mL葡萄糖标准品溶液,加水稀释至50 mL容量瓶。分别量取不同浓度葡萄糖溶液各2 mL置于具塞试管中,加入5%苯酚1 mL,5 mL浓硫酸,摇匀,90℃下20 min,冷却至室温,以0号管为参比,在490 nm处测定其吸光值。以葡萄糖浓度C(g/L)为横坐标,吸光度A为纵坐标,得回归方程为A=0.108 8C+0.006 4,R2=0.999 3。将
1.2.1制得的玫瑰花多糖用双蒸水至500 mL容量瓶,得玫瑰花多糖提取液。准确吸取玫瑰花多糖溶液2mL,测定玫瑰花多糖样品吸光度,根据回归方程求出多糖溶液浓度,计算玫瑰花多糖得率。
1.2.3 玫瑰花多糖提取单因素试验
取预处理的玫瑰花粉末2.0 g,以双蒸水为溶剂,考察提取温度、提取时间和料液比对玫瑰花多糖提取率影响。按液料比 30 ∶1(mL/g),在温度分别为 50、60、70、80、90、100 ℃提取 240 min,考察提取温度对玫瑰花多糖提取率影响;在液料比30∶1(mL/g),提取温度90 ℃水浴下,分别提取 60、120、180、240、300、360 min,考察提取时间对玫瑰花多糖提取率影响;提取温度90 ℃,提取时间 240 min,分别考察液料比 15∶1、20∶1、25 ∶1、30 ∶1、35 ∶1、40 ∶1(mL/g)时对玫瑰花多糖提取率的影响[15-16]。
1.2.4 响应面法优化提取工艺试验
根据星点试验设计原理,在单因素试验结果基础上,设计三因素五水平试验[17-18],以玫瑰花多糖得率为指标作响应面图,优化玫瑰花多糖最佳提取工艺,并对结果验证。其因素水平编码表见表1。
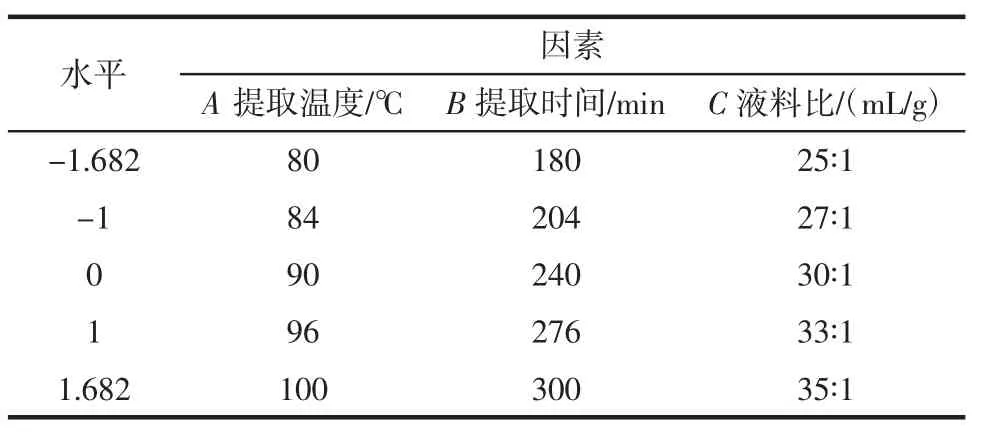
表1 因素水平表Table 1 Table of factors and levels
1.2.5 玫瑰花多糖结构分析
紫外光谱分析:将多糖样品配成0.5 mg/mL的溶液,以蒸馏水为空白,用紫外分光光度计在200 nm~800 nm波长范围扫描。
红外光谱分析:取1 mg~2 mg玫瑰花多糖,与一定量溴化钾混合均匀,压片后,上红外光谱仪在波数为4 000 cm-1~400 cm-1波数下进行红外扫描。
1.2.6 玫瑰花多糖体内抗氧化活性
60只雌性小鼠,经1周环境适应性饲养,随机分为6组:空白对照组,衰老模型组,VC阳性对照组,玫瑰花多糖高、中、低剂量组。除对空白对照组小鼠每天颈背部皮下注射等体积的生理盐水外,其他5组均按每日颈背部皮下注射120 mg/kg剂量的D-半乳糖。与此同时,玫瑰多糖高、中、低剂量组分别以600、300、150 mg(/kg·d) 多糖灌胃给药,VC阳性对照组以150 mg(/kg·d)灌胃给药,空白对照组和衰老模型组小鼠灌胃相应体积生理盐水[19]。
实验第42天,所有小鼠停止药物干预,小鼠禁食不禁水24 h,以眼眶后静脉丛采集血样,4℃放置2 h后,离心(3 500 r/min,10 min)得血清,颈椎脱臼处死小鼠,取出肝脏清洗后用预冷pH 7.4的磷酸缓冲溶液组织匀浆,3 000 r/min离心10 min上清备用。按照试剂盒说明书分别测定血清及肝组织中SOD、GSH-Px活性及MDA水平。
1.3 数据处理
优化试验均重复3次,数据结果表示为平均值±标准误差,试验数据处理及分析采用Design-Expert 8.0.6软件;抗氧化试验采用SPSS13.0软件进行单因素方差分析,数据以平均值±标准误差表示,P<0.05为显著性差异,P<0.01为极显著性差异。
2 结果与分析
2.1 玫瑰花多糖提取单因素试验
提取温度、提取时间、液料比对玫瑰多糖提取率影响见图1。
从图1a结果可知,在50℃~90℃随提取温度上升,玫瑰花多糖得率显著增加,多糖得率最大值为90℃,温度从90℃提高到100℃,多糖得率有所降低,所以较合适的提取温度为90℃。图1b给出不同提取时间对多糖提取率影响。由图可知,随着提取时间的增加,玫瑰花多糖得率不断增加,在提取240 min达到了最大值,之后随着提取时间增加多糖得率轻微下降,因此,提取时间最终选择240 min为宜。由图1c可知,液料比从 15 ∶1(mL/g)到 30 ∶1(mL/g)玫瑰花多糖得率随液料比的增加而增加,30∶1(mL/g)时提取率最高,此条件下多糖基本提取完全,增大料液比对多糖得率增加较小,提取液料比选择 30 ∶1(mL/g)。
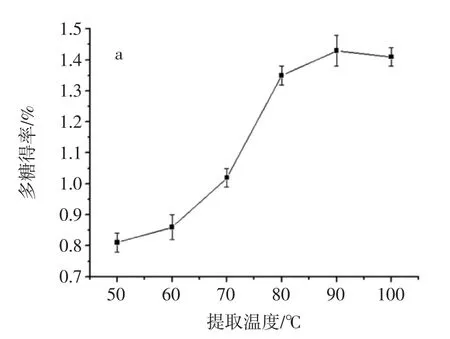
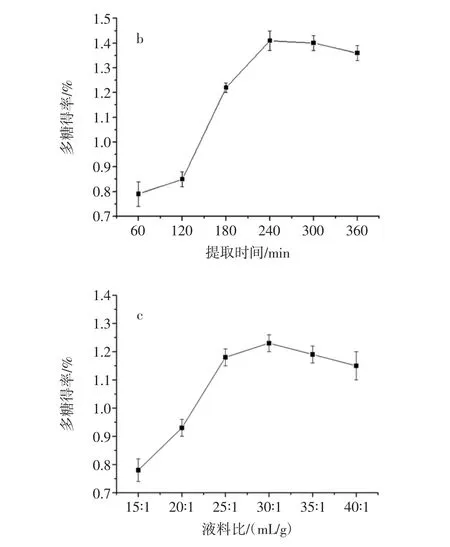
图1 提取温度、提取时间、液料比对玫瑰多糖提取率的影响Fig.1 Extraction temperature,time and liquid to solid ratio on extraction yield of RRPP
2.2 瑰花多糖提取单因素试验
2.2.1 响应面试验方案及结果
玫瑰花多糖得率用Design-Expert软件响应面处理,以玫瑰花多糖提取得率为响应值,对各影响因素进行二次回归分析,得到回归方程Y=1.37+0.14A+0.10B+0.057C+0.017 5AB-0.005AC-0.032 5BC-0.083A2-0.122B2-0.111C2。响应面试验方案及结果见表2。方差分析结果见表3。
方差分析显示,F值=15.888,回归模型显著性P<0.000 1,表示回归方差模型极显著的,说明模型有意义。A、B、A2、B2、C2均有显著差异(P<0.01),表明 3 个因素对玫瑰多糖的影响不是简单线性关系,同时,失拟项P>0.05,即模型与试验比较吻合。R2adj=0.875 6表明该模型能解释87.56%的变化,相关系数R2=0.934 6,说明试验实际值与预测值有很好的相关性,可以用方程对提取结果进行预测。

表2 响应面试验设计及结果Table 2 Response surface design and results

表3 设计方差分析表Table 3 Analysis of variance of experimental results
2.2.2 因素间相互作用
因素相互作用对提取率影响的响应面图见图2。
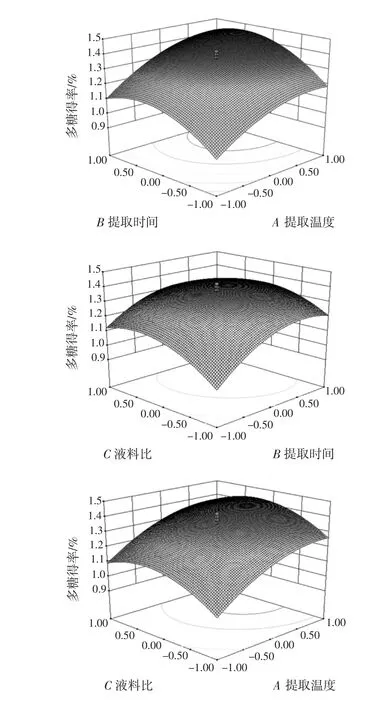
图2 因素相互作用对提取率影响的响应面图Fig.2 The mutual effects of different factors on the extraction yield of RRPP
各因素的响应面分析图,可直观地反映各因素的交互作用对响应值的影响,当A、B、C 3个因素取值较小时,响应面曲线较陡,等高线密度较大,此时各因素对玫瑰花多糖提取率影响较为明显,但A、B、C取值较大时,响应面曲线较平缓,等高线密度较小,说明此时3个因素对多糖提取率影响较小,等高线反应了各因素的相互作用,等高线越近乎于圆形表示因素相互作用越小,椭圆形表示相互作用较大,从等高线图可以看出 BC>AB>AC。
2.2.3 最佳工艺的验证试验
通过Design Expert 8.0.6优化,确定玫瑰花多糖提取的最佳工艺为:提取温95.41℃,提取时间256.35min,液料比30.51∶1(mL/g),该条件下多糖预测提取率1.46%。考虑试验的实际条件,确定实际最佳工艺为:提取温度95℃,提取时间256 min,液料比 30∶1(mL/g),进行3组验证性试验,实际提取得率分别为1.43%、1.45%、1.42%,平均值为1.43%,与理论预测值相差很小,试验证明预测值与实际值吻合性良好,说明星点设计响应面法对多糖提取工艺的优化方案可行。
2.3 玫瑰花多糖结构初步分析
多糖溶液在200 nm~800 nm波长范围内的吸收曲线如图3所示。

图3 玫瑰花多糖紫外吸收光图谱图Fig.3 Ultraviolet spectrum of Rosa rugosa petals polysaccharides
由图3可知,在260 nm和280 nm处未出现吸收峰,无其他杂质峰,表明玫瑰花多糖不含核酸和蛋白质等。玫瑰花多糖红外光图谱图见图4。

图4 玫瑰花多糖红外光图谱图Fig.4 Infrared spectrum of Rosa rugosa petals polysaccharides
由图4可知,3 433 cm-1处左右出现宽而强的吸收峰是多糖的O-H伸缩振动,在2 928 cm-1处左右出现的强吸收峰是多糖的C-H伸缩振动,1 345 cm-1处的收峰为多糖的C-H弯曲振动,这些峰是多糖物质的特征峰[20]。在1 748 cm-1和1 609 cm-1出现的吸收峰为C=O伸缩振动,表明多糖中含有糖醛酸[21]。在895 cm-1和878 cm-1处有吸收峰,表明玫瑰花多糖的糖苷键结构为β-D型吡喃糖。
2.4 玫瑰花多糖体内抗氧化活性
玫瑰花多糖对小鼠血清和肝脏SOD、GSH-Px活性和MDA含量的影响见表4。

表4 玫瑰花多糖对小鼠血清和肝脏SOD、GSH-Px活性和MDA含量的影响Table 4 Effect of RRPS on the activities of SOD,GSH-Px and the level of MDA in serums and livers in aging mice
由表4可知,与正常对照组比较,模型小鼠血清和肝脏中 SOD 及 GSH-Px活性明显下降(P<0.01),MDA含量明显增高,存在显著性差异(P<0.01),表明D-半乳糖致衰老模型成功。与D-半乳糖致衰老模型组相比不同剂量玫瑰花多糖组,小鼠血清和肝脏SOD和GSH-Px酶的活性均显著增加,MDA含量降低(P<0.01)。多糖高剂量组的小鼠血清中SOD、GSH-Px酶的活性和 MDA 含量为(220.41±18.23)U/mL、(276.74±22.14)U/mL 和(7.30±0.50)nmol/mL;多糖高剂量组的小鼠肝脏抗氧化酶(SOD、GSH-Px)的影响和MDA含量为 (244.43±16.12)U/mg、(281.23±21.06)U/mg 和(10.56±0.84)nmol/mg。与衰老模型组相比多糖高剂量组血清和肝组织的SOD活性分别提高了18.17%、20.30%;GSH-Px活性分别提高了33.89%、33.32%;MDA含量降低45.77%、39.72%。这些结果表明,玫瑰多糖可显著提高小鼠血清和肝脏中抗氧化酶(SOD、GSH-Px)活性,明显抑制小鼠血清和肝组织中MDA含量的增加,有效减轻氧化损伤,表现出很强的体内抗氧化活性。
3 结论
采用响应面法优化的玫瑰花多糖的最佳提取工艺为:提取温度95℃,提取时间256 min,液料比30∶1(mL/g),在此工艺条件下,多糖提取得率为1.46%。此优化提取工艺参数准确、可行,在试验范围内能较准确地预测玫瑰花多糖的得率,为玫瑰花多糖的提取工艺提供参考,为玫瑰花资源充分利用提供试验依据。
玫瑰多糖可以显著提高小鼠血清和肝组织中内源性抗氧化酶活性(SOD、GSH-Px),明显抑制小鼠血清和肝组织中MDA含量的增加,有效减轻氧化损伤,表现出很强的抗氧化活性,是一种具有开发潜力的天然抗氧化剂。

