超声波-微波协同辅助法提取核桃蛋白工艺优化及特性研究
余永婷,房磊,史万礼,郭焰,谢琼
(1.新疆轻工职业技术学院,新疆乌鲁木齐830000;2.吉林大学,吉林长春130000;3.新疆大学,新疆乌鲁木齐830000)
核桃(Juglans regia L.)又名胡桃、羌桃,属胡桃科胡桃属植物[1],同扁桃、腰果、榛子并列称为世界四大干果[2],新疆的主要林果之一,主产区集中在新疆、甘肃、陕西等中西部地区[3-5],亩产量最高可达400 kg[6]。核桃中除了富含大量的油脂、糖类化合物、矿物质、维生素、磷脂等成分[7]外,还含有15%~25%[8-9]的蛋白质,且氨基酸组成种类齐全,必需氨基酸配备合理[10-11],符合联合国粮农组织(Food and Agriculture Organization of the United Nations)和世界卫生组织(World Health Organization)规定的要求,核桃蛋白能够补血、润肺、养神等,具有重要的生理保健作用[12]。
核桃蛋白不仅氨基酸的种类丰富而且具有生理功能等特性,被视为是一种价值较高的蛋白质资源,所以备受人们关注,目前核桃主要用来提取油脂或以干果形式进行销售食用[13-14],加工产品简单,对核桃蛋白的提取主要有碱溶酸沉法、酶解法、超声波辅助等方法,超声波-微波辅助方法是将超声波技术和微波技术相结合进行提取的一种新型方法,不仅能够缩短提取时间而且极大地提高了蛋白提取率[15],广泛的应用在油脂、蛋白、多糖等物质的提取与制备方面[16-17]。因此本文采用超声波-微波协同辅助法对核桃蛋白进行提取,并采用正交试验进一步优化出最佳提取工艺,对其等电点进行测定,为核桃蛋白的精深加工奠定了良好的理论基础。
1 材料与方法
1.1 材料、试剂、仪器
核桃:市售;浓硫酸、盐酸、乙酸、固体氢氧化钠、对硝基苯酚、溴化钾、甲醛、乙酰丙酮、硫酸铵、硫酸铜(均为分析纯):北京化工厂。
HYP-320型智能消化炉:上海纤检仪器有限公司;FA1004A型电子天平:上海精天电子仪器有限公司;UWave-1000型微波-紫外-超声波三位一体合成萃取反应仪:上海新仪微波化学科技有限公司;RHP-350型高速多功能粉碎机:浙江容浩工贸有限公司;PHS-3D型PH计:上海精密科学仪器有限公司;CT15RT型台式高速冷冻离心机:上海天美科学仪器有限公司;Alpha1-4LP Plus型冻干机:德国有限公司;TU-1901型紫外分光光度计:北京普希通用仪器有限责任公司;HSC-3型差示扫描量热仪:北京恒久科学仪器厂。
1.2 方法
1.2.1 工艺流程及核桃蛋白提取率的计算

核桃蛋白含量及纯度的测定参考GB 5009.5-2010《食品安全国家标准食品中蛋白质的测定》中的分光光度法,提取率及蛋白纯度计算见公式所示[18]。

1.2.2 核桃蛋白提取单因素试验
选取料液比(g/mL)、pH 值、超声功率(W)、微波功率(W)4个单因素进行考察[19-20],设定料液比 1∶10、1 ∶15、1∶20、1∶25、1∶30(g/mL),pH 值8.5、9.0、9.5、10.0、10.5,超声波功率 300、350、400、450、500 W,微波功率100、150、200、250、300 W,3 次平行试验取均值[21-22]。固定的单因素:核桃仁粉 100.00 g、料液比 1 ∶15(g/mL)、pH9.0、超声波功率400 W、微波功率200 W。以核桃蛋白质的提取率作为评价指标。
1.2.3 核桃蛋白提取正交试验
核桃蛋白提取正交试验见表1。
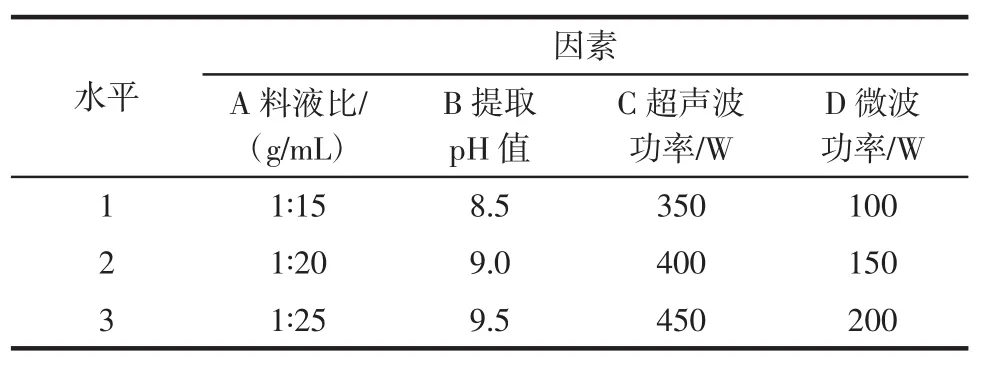
表1 正交因素水平表Table 1 Orthogonal factor level table
1.3 核桃蛋白功能特性的测定
1.3.1 等电点的测定
将3.0 g冻干后的核桃蛋白粉末,溶解在200 mL的蒸馏水中,调至pH10.0,核桃蛋白充分溶解,0.1 mol/L的 HCl溶液调节 pH 值至 3.5、4.0、4.5、5.0、5.5、6.0,边加HCl溶液边搅拌,静置30 min,使溶液中的蛋白沉淀完全,3 800 r/min离心15 min,弃沉淀取上清2 mL,用移液管吸取8 mL双缩脲试剂,混合均匀,30 min后540 nm波长处测吸光度,吸光值的大小反应了蛋白沉淀量多少,蛋白沉淀越多吸光值越小,即此时pH值就为核桃蛋白质的等电点[23-24]。
1.3.2 溶解度的测定
分别在不同蛋白浓度、不同pH值、不同温度条件下对核桃蛋白溶解度进行测定,配制浓度:10、15、20、25、30 mg/mL 的蛋白溶液;pH 值:3.0、5.0、7.0、9.0、11.0的蛋白溶液;温度:40、50、60、70、80 ℃;搅拌 30 min,核桃蛋白充分溶解,3 800 r/min离心20 min,采用双缩脲法测离心后溶液中的蛋白含量[25]。
1.3.3 核桃蛋白变性温度的测定
电子天平称取10 mg核桃蛋白,放入坩埚中,对照组:空白,温度:30℃~500℃,以速度10℃/min升温,记录吸热曲线,绘制差式扫描量热扫描曲线[26-28(]differential scanning calorimetry,DSC)。图像最低点即为蛋白的变性温度。
2 结果分析
2.1 核桃蛋白提取单因素结果
2.1.1 料液比对蛋白提取率的影响
料液比对蛋白提取率的影响见图1。
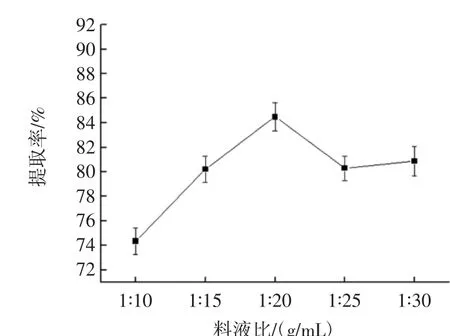
图1 料液比与提取率之间的关系Fig.1 The relationship between the ratio of material to liquid and extraction rate
由图 1 可知,料液比在 1 ∶10(g/mL)~1 ∶20(g/mL)范围内变化时,提取率不断增大,料液比在1∶20(g/mL)~1∶35(g/mL)范围内变化,提取率下降并保持平稳状态,料液比在1∶20(g/mL)时,提取率最大。提取液用量增加有助于蛋白质从内部溶出从而提取率变大。当蛋白质溶出饱和,增加提取液而提取率不在上升。因此选取料液比 1 ∶15、1 ∶20、1 ∶25(g/mL)进行正交试验。
2.1.2 pH值对蛋白提取率的影响
pH值对蛋白提取率的影响见图2。
由图2可知,当提取液pH值在8.5~10.5范围内变化时,核桃蛋白提取率随着提取液pH值的不断增大先上升后下降,pH 9.0时提取率出现峰值。蛋白是碱溶性的,适当的pH值有助于蛋白质溶出,pH值过大,导致蛋白质内部的可解离基团因受强烈的静电排斥作用造成分子伸展,蛋白质变性沉淀,提取率降低。因此选pH 8.5、9.0、9.5进行正交试验。
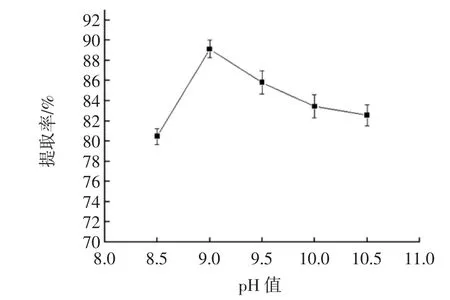
图2 pH值与提取率之间的关系Fig.2 Relationship between pH and extraction rate
2.1.3 超声波功率对蛋白提取的影响
超声波功率对蛋白提取的影响见图3。
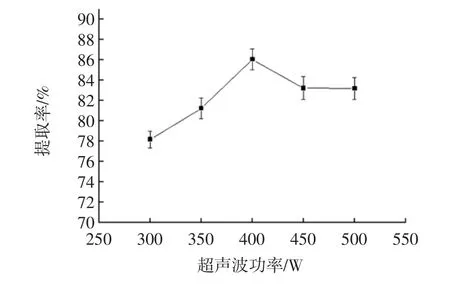
图3 超声功率与提取率之间的关系Fig.3 Relationship between ultrasonic power and extraction rate
由图3可知,超声功率在300 W~500 W范围内变化时,提取率随着超声波功率增大呈现先上升后下降趋势,功率400 W时提取率最大,超声波的空化效应会使细胞壁破坏完全在提取中具有辅助作用,提高蛋白质溶出率,提取率上升,但是功率过大,会破坏蛋白中氢键,破坏蛋白结构,蛋白沉淀在细胞内,从而提取率下降。因此选350、400、450 W进行正交试验。
2.1.4 微波功率对蛋白提取率的影响
微波功率对蛋白提取率的影响见图4。
微波功率在100 W~300 W之间内变化时,提取率曲线呈先上升后下降趋势,150 W时提取效果最佳。微波具有破坏细胞壁加速蛋白质溶出的作用,从而提高了提取率,微波提取过程中会产生大量热量,微波功率过大,温度上升会使蛋白中的氢键断开,蛋白因高温变性,沉淀在细胞内无法溶出,从而提取率下降。所以选微波功率100、150、200 W进行正交试验。
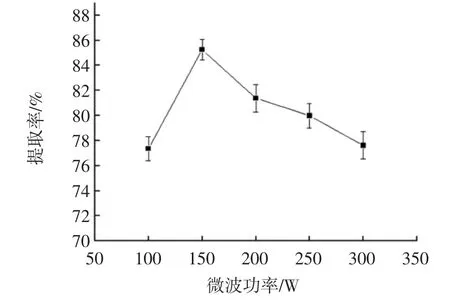
图4 微波功率对提取率的影响Fig.4 The effect of microwave power on the extraction rate
2.1.5 核桃蛋白提取工艺优化
在单因素试验基础上,按L9(34)设计正交试验,优化最佳提取参数,试验结果见表2,正交试验的方差分析见表3。
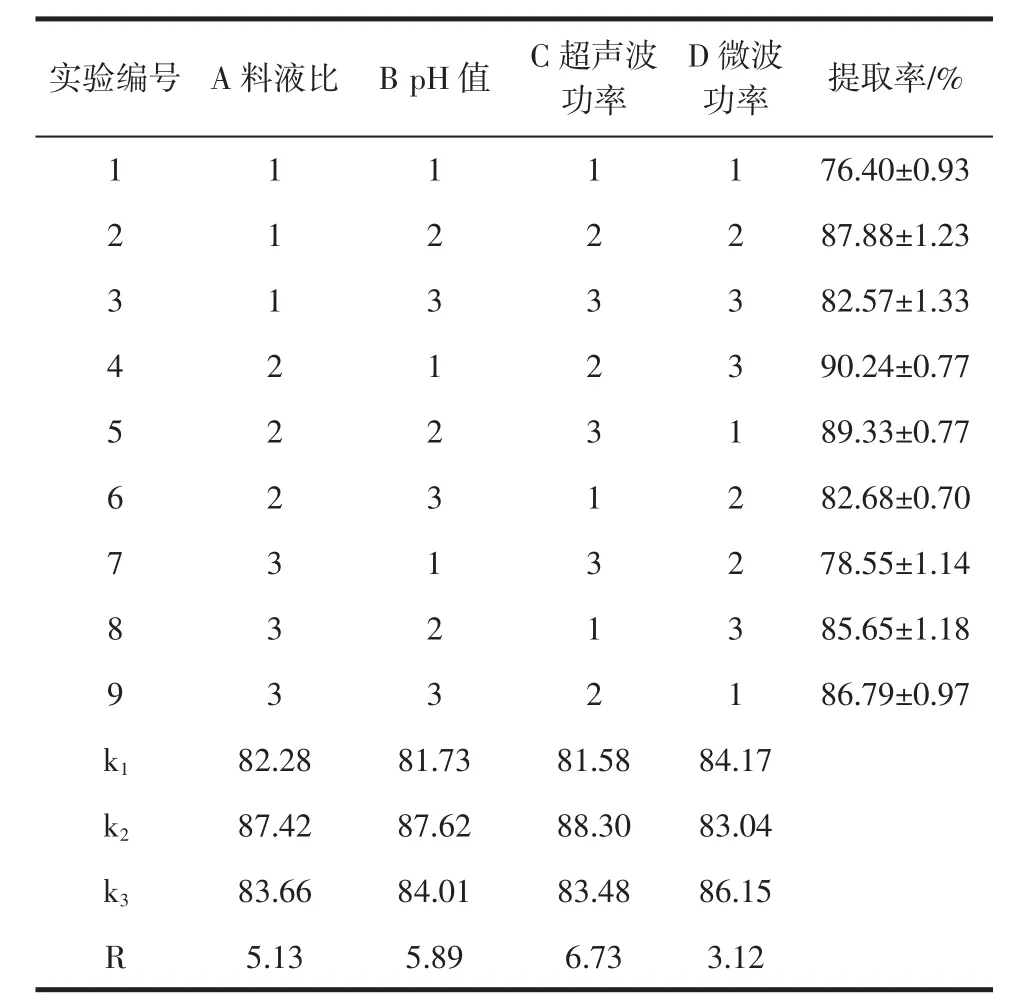
表2 正交试验设计及结果Table 2 Orthogonal array design matrix and results
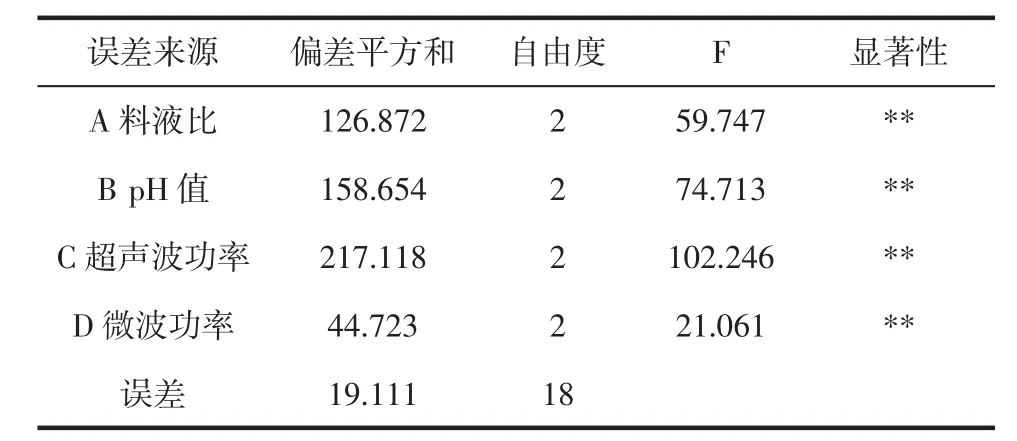
表3 正交试验的方差分析Table 3 Analysis of variance for the experimental results of orthogonal array design
由表2正交试验显示结果可知,超声波-微波辅助提取对核桃蛋白提取率的影响程度分别为超声波功率>pH值>料液比>微波功率,最佳提取工艺为A2B2C2D3,即料液比 1∶20(g/mL)、pH9.0、超声波功率400 W、微波功率200 W,该试验组不在正交试表中,需进行验证试验,验证结果为:最大提取率(93.48±1.02)%。
由表3 spss软件结果显示,校正模型具有显著性,A、B、C、D 各因素的影响值 P<0.01,表明上述 4个因素在提取过程中可作为影响提取率的首要考虑因素。
2.2 核桃蛋白功能特性测定结果
2.2.1 核桃蛋白等电点测定
等电点示意图见图5。
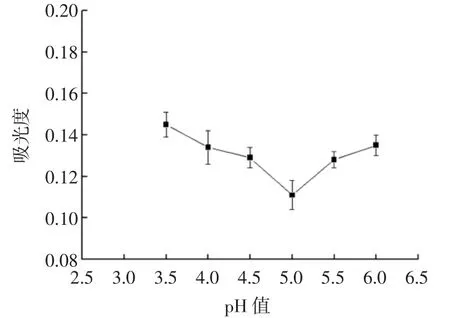
图5 等电点示意图Fig.5 Schematic view of the isoelectric point
由图5可知,pH值在3.5~6.0之间变化,吸光值先下降后上升,pH 5.0时吸光度最小。说明在pH 5.0时溶液中的蛋白质沉淀量最大,此时处于等电点,分子所带的静电荷为0,溶解性最差。
2.2.2 核桃蛋白浓度对溶解度影响
核桃蛋白浓度对溶解度影响见图6。
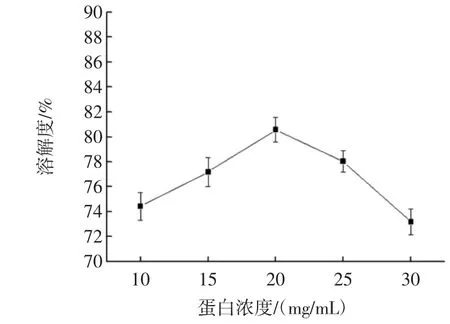
图6 蛋白浓度对溶解度的影响Fig.6 Effect of protein concentrations on solubility
由图6可知,核桃蛋白在由10 mg/mL增加到30 mg/mL,蛋白的溶解度先上升出现最大值,然后呈现下降趋势,在20 mg/mL时出现最大值,由于适当的增加蛋白浓度有助于蛋白的充分溶解,蛋白浓度过大,水分子被蛋白吸收形成过饱和溶液,导致溶解不完全,所以溶解度下降。
2.2.3 pH值对核桃蛋白溶解度的影响
pH值对核桃蛋白溶解度的影响见图7。
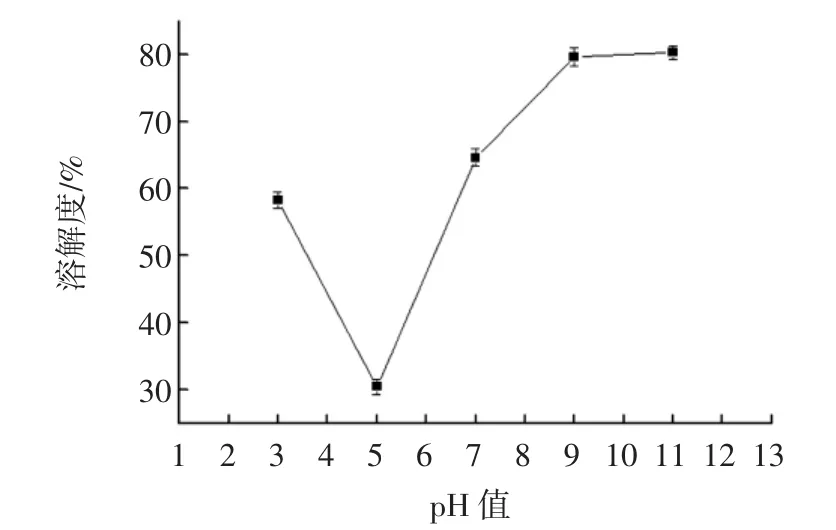
图7 pH值对溶解度影响Fig.7 Effect of pH on solubility
由图7可知,溶液pH值由3.0到11.0范围内变化,溶解度在pH 5.0时最低,由于处于核桃蛋白的等电点,随着pH值的继续增大,溶解度逐渐上升出现最大值并趋于平稳,因为蛋白质易溶于碱性环境,且有最佳溶解pH值,而难溶于酸性环境。
2.2.4 温度对核桃蛋白溶解度的影响
温度对核桃蛋白溶解度的影响见图8。
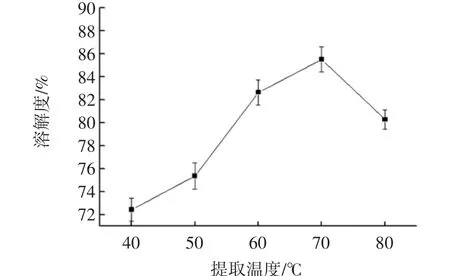
图8 温度对溶解度影响Fig.8 Effect of temperature on solubility
由图8的试验结果可知,溶解度随着温度变化,呈现先上升后下降的趋势,在温度70℃时,溶解性最好,温度适当增加有利于蛋白分子伸展,吸收更多水分形成水合分子,故而溶解性较好,但温度过高导致蛋白分子的天然结构破坏,分子松散,吸水性下降,溶解性降低。
2.2.5 核桃蛋白变性温度测定
核桃蛋白DSC扫描结果见图9。
由图9可知,核桃蛋白在加热过程中呈现先吸热后放热的状态,在DSC曲上有一个明显的最低峰,即核桃蛋白的最大热量吸收峰,峰顶所对应的温度83.80℃即为蛋白的变性温度,温度高于83.80℃后,蛋白质天然结构逐渐破坏崩塌,蛋白变性[29]。蛋白的对热稳性较好,这也解释了在接近80℃溶解度下降的原因。
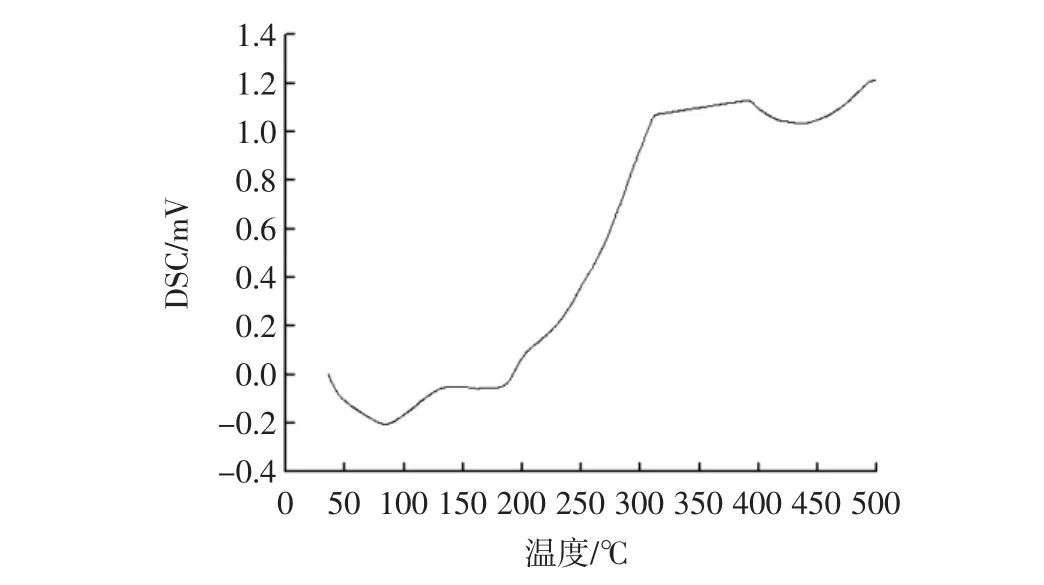
图9DSC扫描结果Fig.9 The results of differential scanning calorimeter scanning
3 结论
本试验采用超声波-微波辅助法提取核桃蛋白,选取料液比、pH值、超声波功率、微波功率为考察因素,通过单因素试验结合正交试验,得到出最佳提取工艺参数:料液比 1 ∶20(g/mL)、pH 9.0、超声波功率400 W、微波功率200 W,此条件下蛋白提取率最大为(93.48±1.02)%。
对核桃蛋白等电点测定结果显示核桃蛋白等电点为pH 5.0,浓度在20 mg/mL时溶解度最大,最佳溶解温度为70℃,在蛋白等电点附近溶解度最差,且随着pH值的不断增大溶解度不断升高,差示热量测量结果显示,核桃蛋白的在83.80℃时有一个明显的向下吸收峰,即核桃蛋白的变性温度。

