GRB7 mRNA在口腔鳞癌中的表达及临床意义
李姣 段晓峰
据报道每年新增口腔癌约2.75 万例,其发病率约占全部恶性肿瘤的25%[1],其中口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是头颈部最常见的的恶性肿瘤之一,约占头颈部癌的90%。5 年生存率仅50%~60%[2],其对患者的生活健康有着巨大的影响,早期即可发生颈部淋巴结转移,转移率达到37%~58%[3]。肿瘤的增殖侵袭和转移特性是造成患者死亡的最重要原因。GRB7作为一种信号联结蛋白,主要介导某些细胞表面受体和特异性下游信号的耦联,与细胞增殖及肿瘤表达有着重要的影响。目前研究已经证实GRB7在一些恶性肿瘤组织中,如乳腺癌,食管癌,胃癌等,尤其是高转移性肿瘤中处于高表达状态[4]。然而,目前有关GRB7在OSCC中的表达情况,国内外研究较少。本文旨在通过qPCR技术检测OSCC和正常口腔黏膜组织中GRB7的表达情况,分析其表达水平与OSCC临床特征的关系。
1 资料与方法
1.1 组织标本
选取2016-06~2017-06我院收治的65 例患者收集标本,其中OSCC 44 例(均经病理诊断明确,术前均未行化疗、放疗),男28 例,女16 例,年龄37~81 岁(61.77±10.64);其中高分化20 例,中分化13 例,低分化11 例,TNM分期显示:I期和II期患者共12 例,III例和IV期患者共32 例,淋巴结转移21 例。正常口腔黏膜标本21 例,男12 例,女9 例(20.95±13.90) 岁,正常口腔组织主要取自阻生齿拔除术中多余的牙龈或黏膜组织,所取患者均无全身系统疾病史。组织标本均必须在手术切除术后立即完成采集,并放入RNA later液保存,4 ℃过夜后,-80 ℃冰箱保存。
1.2 引物合成
所用引物均委托生工生物工程(上海)股份有限公司设计并合成。GRB7,上游:TCTGTGTCAAGCCCAACAAG;下游:CGTACTTGAAGAGGCGGAAG。内参基因β-action,上游:ACCGAGCGCGGCTACAGC;下游:CTCATTGCCAATGGTGAT。
1.3 试剂及PCR技术
切取1~2 mm3大小组织,利用Dynabeads mRNA DIRECTTM试剂盒(Roche公司,美国),使用磁珠法提取组织mRNA:取切取好的组织溶解于LB裂解液(含蛋白溶解酶K),可置于55 ℃水浴锅促进组织消化。加入Dynabeads磁珠摇床10 min,使之与mRNA结合,立即放入磁力架中。移除上清液,用Washing Buffer A液洗涤2 次,B液洗涤1 次,去除上清液。加入Tris-HCl(pH 7.5)溶液,80 ℃恒温2 min得到mRNA。用Transcriptor First Strand cDNA Synthesis Kit 试剂盒(Roche公司)逆转录成cDNA(-20 ℃储存;SYBR Green I Master备用)。再用Light Cycler R480 SYBR Green I Master(Roche公司)进行扩增。采用10 μl反应体系: SYBR Green I Master 5 μl,上下游引物各2.0 μl,模板1 μl。在进行PCR检测时完成布板的96 孔板放入CFX connect Real Time System PCR扩增仪(BIO-RAD,美国)将加样进行 PCR 反应,设置反应条件。反应条件为:95 ℃,5 min,变性95 ℃,10 s,退火65 ℃,6 s,共63 个循环,于每次循环最后一步采集荧光信号。每个样品设置1 个复孔,取CT平均值,采用2-△CT分别记录OSCC组内和正常口腔黏膜组内GRB7相对于β-action的表达量。
1.4 统计学处理
检测结果结合临床资料数据,采用SPSS 19.0统计学软件进行处理。P<0.05差异有统计学意义。
2 结 果
GRB7 mRNA在OSCC中的表达明显高于口腔正常黏膜组织(图 1)。其在44 例OSCC及21 例口腔正常组织中的表达分别为(1.067±0.607),(0.466±0.315),Z=-3.836,P<0.01。
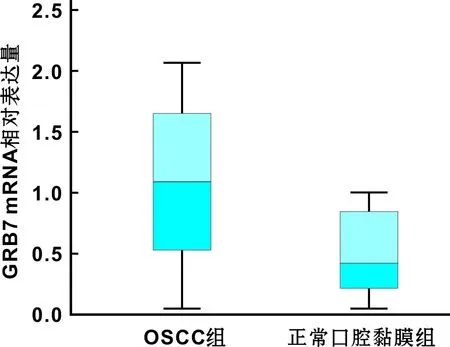
图 1 不同样本中GRB7 mRNA的表达
OSCC组中不同临床特征间的比较结果如表 1所示,不同性别、年龄的患者GRB7 mRNA表达之间没有明显差异(P>0.05),但是肿瘤不同的分化程度,TNM临床分期及是否有淋巴结转移的数据中的两组患者GRB7 mRNA表达有差异(P<0.05)。经统计学分析,高分化组患者GRB7表达显著高于中低分化组患者。临床I、II期患者GRB7表达高于临床III、IV期患者,临床上发生淋巴结转移的患者GRB7表达高于未发生淋巴结转移的患者。
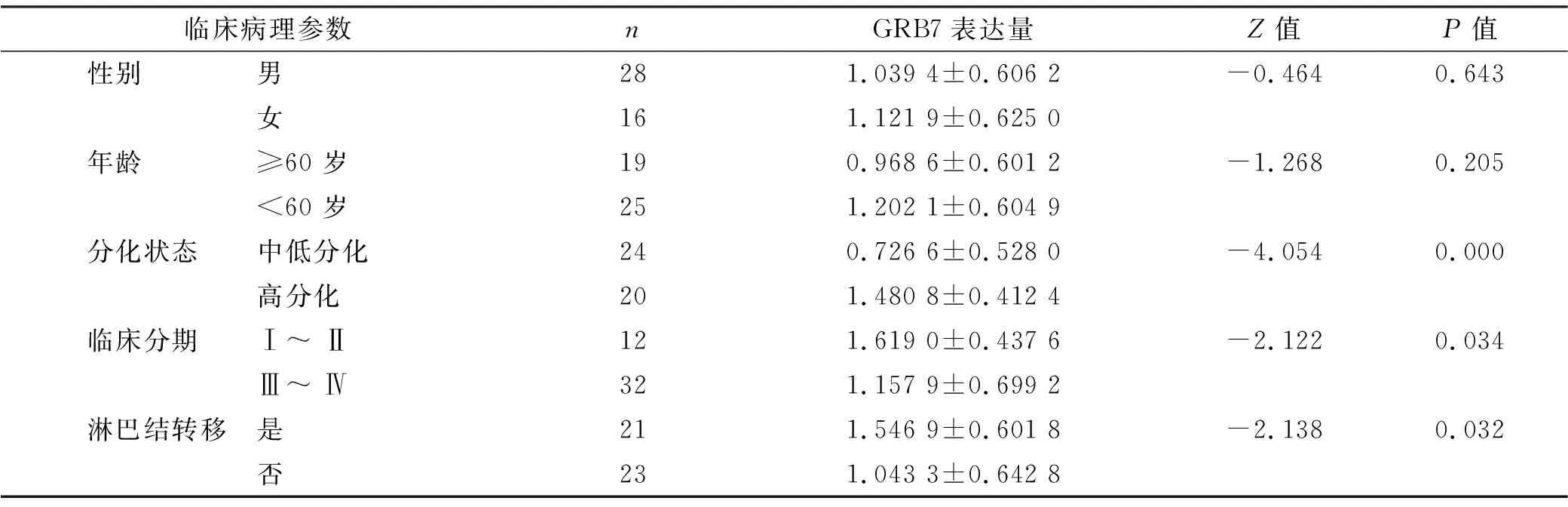
表 1 GRB7 mRNA表达与OSCC临床特征的相关性
3 讨 论
近年来,针对肿瘤的增殖侵袭和转移这一特点,国内外学者投入了大量研究,以期探索肿瘤发展过程中其增殖侵袭和转移的相关机制。其中,GRB7由Margolis等[5]1992年首次提出就立即引发了科研工作者对于其功能及机制的探索。GRB7是GRB7蛋白家族的成员之一,这个家族还包括GRB10和GRB14两种蛋白。GRB7作为一种重要的没有内源性酶活性的衔接蛋白,主要通过其SH2结构域与许多酪氨酸激酶和其他信号分子连接,介导某些细胞表面受体和特异性下游信号的偶联,参与调节肿瘤的侵袭与转移[6],因此近年来逐渐成为研究热点。人们首先通过研究发现,GRB7的酪氨酸磷酸化状态是其发挥调节和功能的重要状态。表皮生长因子[7],EphB1[8]、细胞外基质[9]和粘着斑激酶(focal adhesion kinase,FAK)[10-11]都被证实可以影响肿瘤的酪氨酸磷酸化状态,进而调节细胞迁移、细胞增殖以及肿瘤化[7,11]。一方面,GRB7可以影响细胞的迁移过程:GRB7和FAK通过其SH2结构域来定位其与病灶的连接及调节细胞的迁移。我们也发现GRB7作为FAK的直接底物,FAK与GRB7的结合可以增加整合素介导的细胞粘附过程,其酪氨酸磷酸化状态对于其加速细胞的迁移起着至关重要的作用[10]。EphB1可以刺激细胞外基质依赖性激酶中成纤维细胞的能动性,这与GRB7是密切相关的。GRB7和EphB1的共同表达可以进一步增强细胞的活性,然而EphB1与GRB7 SH2结构域的共表达却可以阻断EphB1调节的细胞迁移过程[8]。另一方面,GRB7在细胞增殖方面也有着重要的作用[11-13],包括:FAK介导的GRB7特异性酪氨酸残基磷酸化可以通过激活MAPK级联反应促进细胞的增殖[11]。相反,慢病毒编码GRB7的小发夹结构的RNAs会减少细胞增殖及减缓细胞的生长[7,11]。相关研究表明[14-15]:c-Jun氨基末端激酶介导的Pin1/GRB7可以通过一系列复杂的机制影响cyclin/CDKs对于细胞周期的调节。GRB7的失调可以加快细胞G2/M的转化过程,从而达到促进细胞增殖的目的。
目前,有学者利用免疫印迹技术和免疫组织化学方法对两株卵巢癌细胞A2780cp和OVCA433中GRB7的表达进行研究,结果证实了GRB7在卵巢癌中的高表达[16]。另外,也有学者对58例胃肠道间质瘤进行免疫组织化学分析,结果发现GRB7在肿瘤组织中的阳性率为83.3%,并随着胃肠间质瘤恶性分级的增高,其表达出现递增趋势,差异有显著性意义[17]。在乳腺癌研究中,也已经通过免疫组织化学法证实了GRB7在乳腺癌中的高表达[13]。本研究结果显示GRB7 mRNA在OSCC中表达较正常口腔黏膜组高,两者差异有统计学意义,这与过往报道中GRB7在肿瘤组织中的高表达具有一致性。同时,本实验探索GRB7与临床特征相关性时发现GRB7与OSCC中淋巴结转移情况及临床分期具有显著相关性。这与有学者通过体外实验证明沉默GRB7可以抑制癌细胞的迁移和转移,证实了GRB7高表达会引起其侵袭和转移的活性改善[18]的结论具有一致性。推测其可能机制在于:①GRB7可以依靠羧基端SH2结构域参与介导FAK受体和EPHB1受体的信号通路,调控细胞迁移,与肿瘤转移有一定关系,促进肿瘤的发展[19]。②激活ERK/FOXM1信号通路,活化的ERK使AP-1磷酸化,最终使促肿瘤细胞侵袭物质含量增加,如Ezrin、组织蛋白酶L、基质金属蛋白酶-1、基质金属蛋白酶-3、基质金属蛋白酶-9等[20]。针对GRB7在OSCC中的表达情况及其通过何种路径被激活,有待进一步实验研究,GRB7及其下游相关信号分子在口腔鳞癌中的表达情况的研究也将成为下一阶段的研究方向,从分子水平对OSCC进行全面地了解[21]。

