消退素D1对牙周炎大鼠龈沟液中炎症因子影响的研究
马飞 唐彩金 方梅飞 陈怡
消退素(Resolvin)是由ω-3 多不饱和脂肪酸衍生的新的一种内源性促炎症消退介质,具有抑制白细胞浸润,下调促炎介质等生物学效应[1]。人工合成消退素可能具有促进牙周炎炎症消退,从而达到治疗牙周炎的目的[2]。本实验研究消退素D1(Resolvin D1,RvD1)对牙周炎大鼠牙周状况及龈沟液炎症因子(IL-1β、TNF-α、IL-6等)的影响。
1 材料与方法
1.1 主要试剂及材料
RvD1(Sigma公司,美国);滤纸条、4#缝线(博士德公司);蜡块(博仁生物);切片机(Leica公司,德国);牙周探针(豪孚迪器材公司);ELISA试剂盒(武汉华美)。
1.2 实验动物模型建立
清洁级SD雄性大鼠30 只,4 周龄,体质量100~150 g(广西医科大学动物实验中心提供)。大鼠牙周炎模型的建立:30 只大鼠用10%水合氯醛全麻后,使用牙科探针对大鼠右上颌第二磨牙牙龈进行分离,分离牙龈后使用缝线4#(直径0.040 mm)放入龈沟内并结扎固定,在结扎固定过程中缝线尽量放入大鼠的龈沟内,将结扎端转至颊侧作为口腔微生物的滞留装置诱导牙周炎的产生,术后按牙周炎食谱喂养2 周[3-4]。
1.3 分组与检测
建模成功后将30 只清洁级SD大鼠随机分为5 组(n=6)。A组为牙周炎对照组,B、C、D、E组为治疗组。检测各组大鼠牙周探诊深度(PD)、松动度,并收集和检测各组大鼠龈沟液中IL-1β、TNF-α、IL-6 的表达情况。然后通过尾静脉注射一次性给药的方法对B、C、D、E组分别给予1、10、50、100 ng/ml不同浓度的RvD1进行干预。用药后7 d再次检测各组相应指标。
龈沟液收集和检测方法如下:将烘烤干燥的滤纸条置于大鼠第二磨牙腭侧近远中采集龈沟液,每牙8 根,每根15 s,置于-80 ℃冰箱保存。采用ELISA方法检测龈沟液IL-1β、TNF-α、IL-6 浓度。
1.4 统计学处理
2 结 果
2.1 牙周状况变化
建模第2周,大鼠第二磨牙有牙周袋形成,均有Ⅰ~Ⅲ度松动。B、C、D、E组经不同浓度的消退素治疗7 d后,牙龈红肿明显好转,松动度减轻,牙周探诊深度变浅,差异具有统计学意义(P<0.001)(图 1)。
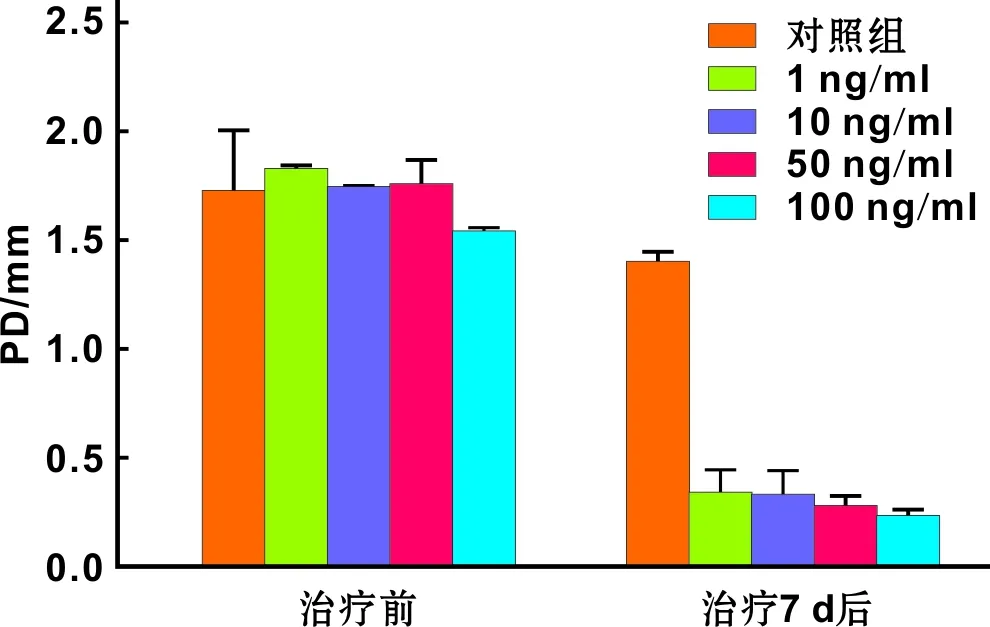
图 1 各组大鼠PD值
2.2 大鼠龈沟液中IL-1β、TNF-α、IL-6水平变化
ELISA结果显示,治疗前各组间比较IL-1β、TNF-α、IL-6差别无统计学意义;治疗前后比较,IL-1β在各组中(包括对照组)表达差别均有统计学差异(P<0.05),但对照组水平最高,E组(100 ng/ml组)最低,各治疗组间比较差别无统计学意义(图 2);TNF-α的表达,对照组前后差别无统计学意义,各治疗组前后比较差异均有统计学意义(P<0.05),其中D组(50 ng/ml)、E组(100 ng/ml)差别具有显著性(P<0.001),各治疗组间比较差别无统计学意义(图 3);IL-6的表达,对照组前后差别无统计学意义,各治疗组前后差别也均具有统计学差异(P<0.05),各治疗组间比较差别无统计学意义, IL-6的表达随着RvD1浓度的升高而降低,具有一定的RvD1浓度依赖性(图 4)。
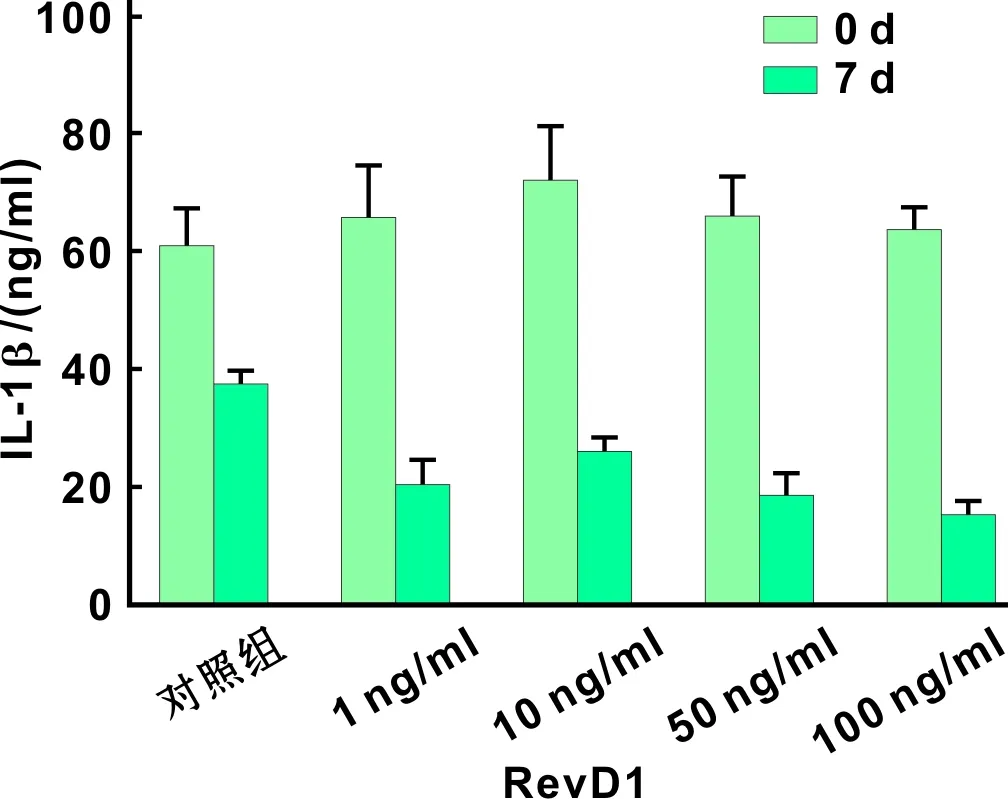
图 2 治疗前后各组大鼠龈沟液中IL-1β水平
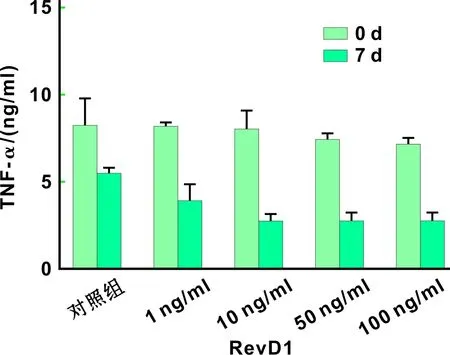
图 3 各组大鼠龈沟液中TNF-α水平
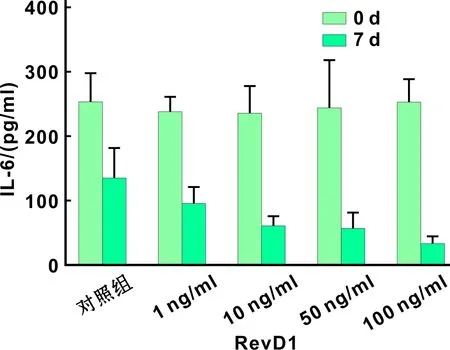
图 4 各组大鼠龈沟液中IL-6水平
3 讨 论
RvD1是一种新型内源性抗炎促消退介质,通过阻碍白细胞浸润、下调炎症介质、促进凋亡的中性粒细胞及细胞碎片的吞噬摄取等方式,在炎症早期发挥促进炎症消退的作用[2]。有研究报道,消退素对于炎性疾病如:牙周病、哮喘、脓毒症及视网膜病变等,显示出了良好的抗炎促消退作用[5]。Garcia等[6]发现RvD1不仅能显著降低关节炎模型大鼠的痛觉过敏,同时还检测到炎症因子TNF-α和 IL-1β的释放减少了。一项关于慢性胰腺炎所致痛觉过敏的研究中,RvD1不仅降低了炎症因子IL-1β、TNF-α和IL-6的释放,而且发挥了显著的抑制痛觉过敏的效应[7]。
消退素的功能主要是抑制白细胞浸润可降低中性粒细胞表面CD18分子的表达、抑制白细胞在血管壁的滚动、减少白细胞向炎症部位渗出和聚集[8-9]。D类消退素可在在盲肠结扎穿孔诱导的小鼠脓毒症中显著降低TNF-α、IL-6、IL-1β、IL-23、IL-17等促炎细胞因子的水平[10]。本研究成功建立了大鼠牙周炎模型,经过给大鼠牙齿绑线的方法,并按照牙周炎食谱喂食,2 周后即可形成牙周炎。在建模两周内,大鼠活动轻度减少,出现少食、掉毛、体重减轻等症状。2周后发现绑线的牙齿的牙龈红肿明显,线周围有较多食物残渣滞留,探诊极易出血,有深牙周袋形成,牙齿松动明显。本实验经取患牙龈沟液行ELISA检测发现大鼠经注射消退素后发现,大鼠牙周炎症状明显改善,PD明显减少,松动度也恢复正常。龈沟液内的TNF-α、IL-1β、IL-6明显低于用药前(对照组),这提示RvD1是通过抑制炎症因子的释放从而减轻大鼠牙周炎的症状。实验中对照组TNF-α、IL-1β、IL-6水平也均出现不同程度降低,而且IL-1β前后差异也有统计学意义,但均值均高于治疗组,可能因为本研究牙周炎模型为人为创伤辅助食物喂养引起,各炎症因子在炎症早期水平较高,转为慢性后逐渐降低,呈现由启动到消退的高度有序化过程,在炎症消退阶段,炎症的终止受到机体内源性促炎症消退介质(pro-resolving mediator)的调控[11]。本实验提示辅以人工合成消退素,可能促进炎症的消退。
有研究提示,RvD1可能是通过抑制了嗜中性粒细胞招募炎性因子的再聚集,以及激活吞噬细胞清除病原体的作用[12]。另外,RvD1可抑制多形核中性白细胞的浸润,从而促进牙周组织的再生,保护牙槽骨的破坏,促进组织愈合以及重建破坏的牙槽骨[13]。
本研究还发现,较小浓度的RvD1即可抑制IL-1β、TNF-α、IL-6的释放。在1 ng/ml的RvD1作用下,IL-1β、TNF-α、IL-6与对照组比较,均有明显的抑制作用,且IL-6具有RvD1的浓度梯度依赖性,随着RvD1浓度的升高而升高。近期有研究发现,RvD1能有效减轻关节炎大鼠机械痛敏,并减少炎症因子IL-1β、TNF-α、IL-6的释放,可能是通过对p-ERK通路的抑制来发挥作用的,且NF-κB/p65也被显著激活,这提示RvD1下调炎症因子的表达,与这2 个通路相关且相互作用,发挥强有力的促炎消退的作用[14-15]。综上所述,RvD1可有效地减轻牙周炎的症状,促进牙周组织的愈合,促进骨组织的重建和牙周组织的再生,这可能与RvD1下调炎症因子,激活吞噬细胞或抑制中性粒细胞对炎症因子的募集作用有关,但其中确切的机制作用需更多的实验加以验证。

