人脐带Wharton’s Jelly来源间充质干细胞和人牙周膜干细胞复合PHBHHx、 PHBV支架成骨分化能力的体外研究
黄银莉 周洪 卢晓云 苏晓霞 钟天宇
口腔颌面部骨组织工程技术的研究主要集中在种子细胞、支架材料和调控因素等方面。hPDLSCs因其来源受限、细胞产量较低、存在混杂细胞等缺点,寻找新的替代种子细胞成为研究热点。hUCWJMSCs因其在细胞增殖、多向分化、免疫特性以及旁分泌等方面更具优势,引起广泛的关注[1];其成骨能力已被许多学者证实并应用于骨组织工程[2-3]。本课题组前期已在体外对2 种干细胞成骨分化能力进行研究,但结合支架材料的成骨分化能力的研究尚缺乏。PHBV、PHBHHx是PHAs家族中研究比较多的成员,因其具有良好的无毒性、生物相容性、可降解性目前广泛应用于再生医学和组织工程技术中。本实验通过体外hUCWJMSCs、hPDLSCs复合PHBV、PHBHHx支架,研究hUCWJMSCs成为牙周骨组织工程种子细胞的可行性。
1 材料与方法
1.1 材料
PHBHHx、PHBV支架(西安交通大学生命科学学院实验中心)DMEM/F12培养基、胎牛血清、胰酶(Gibco,美国);L-抗坏血酸2-磷酸盐、地塞米松、β-甘油磷酸钠(Sigma,美国);ALP半定量试剂盒(南京建成生物技术公司);茜素红、倒置相差显微镜(Nikon,日本);荧光显微镜(Leica DM4000B,德国)。
1.2 实验方法
1.2.1 细胞与支架粘附率测定 支架预备:将PHBHHx和PHBV膜裁剪成1 cm2大小,75%酒精浸泡过夜。然后置于无菌的24 孔培养板中,超净台内紫外线正反面各照射1 h,每孔加入1 ml细胞培养液,直到培养液全部渗透进支架中,然后PBS 清洗支架3 次,自然晾干,备用。
取24 孔培养板,在孔内植入备用的无菌PHBHHx和PHBV支架,取生长良好的P3代hUCWJMSCs、hPDLSCs细胞,调整细胞浓度为3×105/孔接种到制备好的支架上,置于37 ℃、5% CO2条件下进行培养。分别在4、8、12、24 h后取出支架复合体,PBS液冲洗,去除未粘附细胞、消化收集并计数,得出流失的细胞数;
再将细胞支架复合体于新的24孔板培养24 h后,将其轻轻振荡并收集培养液中细胞并计数,为未粘附细胞数。每个样本3 个复孔。
细胞粘附率=(接种细胞数-流失细胞数-未粘附细胞数)/(接种细胞数-流失细胞数)×100%
1.2.2 MTT法检测细胞与支架结合后细胞增殖情况
取PHBHHx和PHBV 2 种膜,每组平行对照3 个,每孔置1 块材料,置于24 孔培养板上预湿,不加膜组作为阴性对照;将hUCWJMSCs和hPDLSCs 2 种细胞分别接种于材料及阴性对照孔中,每孔加0.5 ml培养液培养。培养3 d后,酶标仪上测定各孔光吸收值,波长为570 nm,收集数据并进行分析。
1.2.3 细胞与支架结合后成骨分化能力测定
1.2.3.1 细胞接种与诱导 将hUCWJMSCs和hPDLSCs接种于放置支架的 24 孔板中,接种密度为每个孔103个细胞,加入普通培养基培养;当细胞生长达到 70%~80%的时候,将培养基换为成骨分化培养液,成骨诱导培养液:DMDM/F12培养基,100 U/ml链霉素、100 U/ml青霉素,0.25 μg/ml两性霉素B、终浓度10%FBS,10 nmol/L地塞米松、10 mmol/L β-磷酸甘油及50 μmol /L的L-抗坏血酸-2-磷酸。3 d换1 次培养液,连续培养21 d;用普通培养基同时培养细胞,其它培养条件与成骨分化组相同,做为阴性对照。
1.2.3.2 碱性磷酸酶(ALP)半定量检测 hUCWJMSCs和hPDLSCs分别和PHBHHx、PHBV膜接种于24 孔板中,细胞总量为103个,进行成骨诱导,分别在培养1、3、5、7、14、21 d收集细胞进行ALP定量检测。检测步骤按ALP半定量试剂盒进行。
1.2.3.3 茜素红染色 hUCWJMSCs和hPDLSCs分别和PHBHHx、PHBV膜接种于24 孔板中,细胞总量为103个,进行成骨诱导,连续诱导21 d。对照组为细胞和支架结合常规培养基进行培养,21 d后分别进行茜素红染色。
1.2.4 细胞与支架结合后扫描电镜观察 无菌条件下,收集生长良好的hUCWJMSCs和hPDLSCs, 胰酶消化、离心,调整细胞数量为1.0×105/ml,分别均匀接种在预先处理置于24 孔板的2 种膜上,形成细胞材料复合体,将其在37 ℃ 、5% CO2饱和湿度培养箱内培养。1 d后将培养基换为成骨诱导剂继续培养,21 d后扫描电镜观察。
2 结 果
2.1 hUCWJMSCs、hPDLSCs与PHBHHx、 PHBV支架结合后细胞粘附率测定
hUCWJMSCs和hPDLSCs与PHBHHx、PHBV接种后,2 种细胞在PHBV膜上的粘附率高于其他各组,其中hUCWJMSCs接种于PHBV膜的粘附率最高;而hPDLSCs与PHBHHx粘附率最低。从数据可以看出,随着接种时间的增长,粘附率成递增趋势,24 h时各组粘附率均最大(表 1)。
2.2 MTT法测定hUCWJMSCs、hPDLSCs与PHBHHx、PHBV支架结合后细胞增殖能力
结果表明hUCWJMSCs在PHBHHx、PHBV膜上增殖明显增快(P<0.05),同时在PHBV膜上A值明显高于PHBHHx(P<0.05);hPDLSCs在PHBV膜上增殖明显增快(P<0.05),而在PHBHHx增殖不明显(P>0.05)(图 1)。
2.3 hUCWJMSCs、hPDLSCs与PHBHHx、PHBV支架结合后细胞成骨分化能力测定
2.3.1 ALP半定量检测 hUCWJMSCs和hPDLSCs分别与PHBHHx、PHBV支架结合后进行成骨诱导,ALP检测成骨诱导情况。结果表明hUCWJMSCs和hPDLSCs与PHBV膜ALP的表达明显高于与PHBHHx膜;hUCWJMSCs与两种膜的ALP表达高于hPDLSCs(图 2)。
2.3.2 茜素红染色 hUCWJMSCs和hPDLSCs分别于PHBHHx、PHBV支架结合成骨诱导21 d后进行茜素红染色。对照组染色均未见红色颗粒形成;诱导组中hUCWJMSCs和hPDLSCs与PHBV支架组可明显的红色被染钙化基质,hUCWJMSCs与PHBHHx支架可见到红色被染基质,hPDLSCs与PHBHHx支架被染红色钙化基质较少(图 3)。
表 1 hUCWJMSCs、hPDLSCs分别接种于PHBHHx、PHBV的粘附率
图 1 hUCWJMSCs、hPDLSCs分别与接种于PHBHHx、PHBV后第3天的增殖情况
图 2 hUCWJMSCs、hPDLSCs分别接种于PHBHHx、PHBV成骨诱导后ALP活性
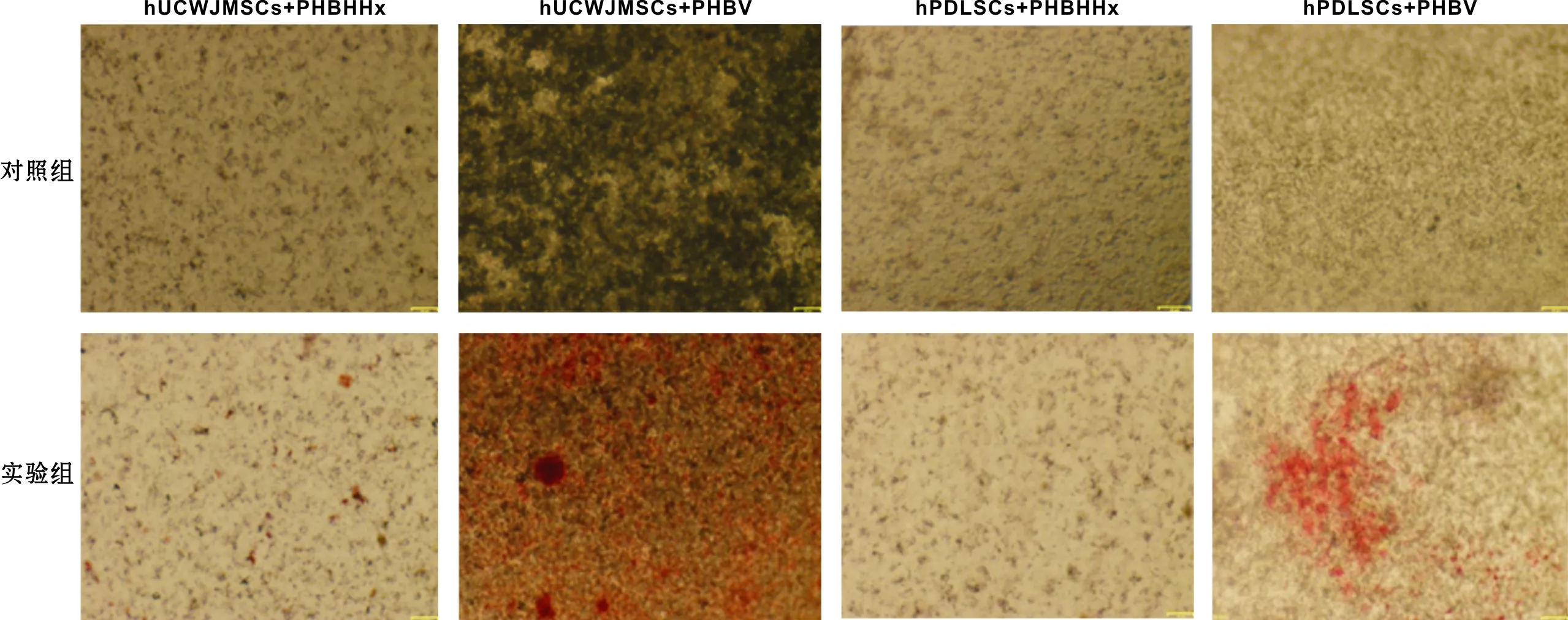
图 3 hUCWJMSCs、hPDLSCs分别接种于PHBHHx、PHBV成骨诱导后的矿化检测(茜素红染色, ×30)
2.3.3 hUCWJMSCs和hPDLSCs与PHBHHx、 PHBV支架结合后扫描电镜观察 hUCWJMSCs和hPDLSCs分别于PHBHHx、 PHBV支架结合成骨诱导21 d后进行扫描电镜。电镜下PHBHHx、 PHBV膜表面较粗糙,其中PHBHHx为球状突起,中间形成有孔结构;PHBV膜含有大量的有孔结构且彼此相通。成骨诱导后,诱导组中hUCWJMSCs和hPDLSCs与PHBV支架组可见明显的细胞附着,在细胞周围可见大量钙结节和矿化基质形成; hUCWJMSCs和hPDLSCs与PHBHHx支架细胞附着较少,形成的矿化基质也较少(图 4)。
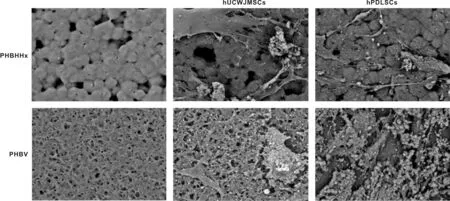
图 4 hUCWJMSCs、hPDLSCs分别接种于PHBHHx、PHBV成骨诱导后表面形态观察(SEM, ×2 000)
3 讨 论
牙周骨组织再生是临床治疗和研究的难点,快速发展的骨组织工程为牙周骨再生提出了新的思路[4-5]。大量的研究集中在种子细胞的选择、支架材料的生物性能及相关的调控因素的研究[6-7]。关于hUCWJMSCs应用于牙周组织修复等方面的研究也成为热点[8],其和hPDLSCs的成骨分化能力分别被诸多实验证明[9-10],同时也分别比较与其他成体干细胞成骨分化能力[11-12],但是关于hUCWJMSCs和hPDLSCs 2 种干细胞成骨分化能力的研究尚缺乏,与支架材料结合后的成骨能力方面的研究也较少。
种子细胞与支架结合后的良好的生物相容性及成骨分化能力是应用于骨组织工程的前提。Wang等[13]将hPDLSCs与牙骨质来源间充质干细胞分别与静电纺丝PHBV共聚体支架结合,结果显示支架复合体表现出良好的细胞黏附率和增殖能力。研究表明hUCWJMSCs与PHBHHx和 PHBVHHx支架具有很好的生物相容性,能够促进hUCWJMSCs的生长和支持hUCWJMSCs向成骨细胞的分化。在本课题组前期的研究中,体外比较了2 种干细胞的成骨分化能力,但未复合支架材料。PHBV、PHBHHx是PHAs家族中研究比较多的成员[14],因其具有良好的生物相容性、可降解性以及无毒性目前广泛应用于组织工程技术中[15-16]。本实验通过将hUCWJMSCs和hPDLSCs与支架材料PHBV、PHBHHx结合并进行成骨诱导,探讨哪种支架复合体更适合于牙周骨组织工程研究。
本实验结果显示随着接种时间的增加,细胞的粘附率增加,此结果提示在研究过程中细胞至少接种24 h后方可进行其他方面研究。hUCWJMSCs和hPDLSCs在PHBV膜上A值明显高于对照组(P<0.05),及PHBHHx组(P<0.05),表明hUCWJMSCs和hPDLSCs与PHBV膜有良好的生物相容性,这与其他研究得出类似的结论[17]。扫描电镜观察到PHBV相对于PHBHHx膜具有更大的孔隙率及连通情况,为细胞黏附提供了良好的空间,这也就解释了2 种细胞与其生物相容性更好的原因。研究显示在保证材料机械强度的情况下应尽可能的增加孔隙率及连通率以利于细胞的营养供应[7]。目前多数学者认为材料孔径的大小应该在220 μm左右以适应人体自身骨单位同时保证相关成骨物质ALP及骨钙素等的表达,故成骨诱导后于PHBV支架可看到大量细胞外基质的分泌。
本实验对细胞支架复合体成骨诱导后ALP检测、茜素红结果说明2 种干细胞与PHBV膜结合后在成骨诱导剂的作用下均可向成骨方向分化且优于PHBHHx,同时hUCWJMSCs较hPDLSCs在PHBV膜上表现除更强的成骨能力。Cheng等[18]将骨髓基质干细胞与PHBV膜结合植入备犬胫骨骨缺损模型,结果显示PHBV膜无明显毒性,术后12 周骨缺损基本被新骨填充,证明PHBV为一种较理想的引导骨组织再生的天然材料。hUCWJMSCs与PHBV支架复合物可作为牙周骨组织工程的种子细胞和支架材料进行进一步研究。
综上,hUCWJMSCs与PHBV支架的生物相容性和成骨分化能力较hPDLSCs更有优势,同时2 种干细胞与PHBV较PHBHHx具有更好的生物相容性和成骨分化能力,说明hUCWJMSCs与支架材料PHBV在牙周骨组织工程应用方面具有明显的优势。同时在后期的实验中,需通过体内实验进一步研究此细胞支架复合体体内成骨情况以及临床应用的免疫特性和安全性。

