绿脓杆菌致急性肺损伤小鼠的ATF3表达规律及意义
吴秀琳 陈光春 李明霞 郭亮 吴学玲
急性肺损伤(acute lung injury, ALI)/急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)是由各种肺内外致病因素导致炎症失控,以急性呼吸困难,低氧血症和非心源性肺水肿为特征的急性临床综合征,是脓毒血症、爆发性流感、严重急性呼吸综合征(severe acute respiratory syndrome, SARS)、重症肺炎等疾病的主要死亡原因[1-4]。重度细菌感染造成的脓毒血症是ALI最常见死亡原因之一,而绿脓杆菌(Pseudomonasaeruginosa, PA)则是引发脓毒症的常见致病菌之一。虽然通过有效抗生素及机械通气等手段,临床治疗已取得了很大进展,但疗效欠佳,其发病率及死亡率仍居高不下,病死率高达40%左右[5]。因此,进一步深入研究ALI/ARDS发病机制及防治则具有重大的临床意义。
近年来研究证实,炎症反应失控是ALI/ARDS本质,但其发病机制十分复杂,尚不完全明确。激活的巨噬细胞(activated macrophages, AMs)通常是早期肺部炎症反应的导火索[6-7],而激活的中性粒细胞(polymorphonuclearleukocyte, PMN)引起的炎症失衡则被认为是ALI/ARDS的关键环节[8],其在肺内过度募集、激活是启动绝大多数ARDS的早期和重要事件,是造成过激炎症反应的“元凶”[9]。而最新研究表明,巨噬细胞产生的活化转录因子3(activating transcription factor 3, ATF3)可抑制PMN在肺内的迁移[10]。很多研究均证实了ATF3对炎症反应有“刹车”作用,是TLR4/NF-κB信号通路的重要的负性调控基因[10-14]。我们前期预实验结果发现LPS腹腔注射后,ATF3 mRNA及蛋白表达 在2 h其mRNA水平出现明显一过性升高。由此,基于文献报道和前期实验结果,我们推测ATF3可能通过负性调控炎症损伤而参与调节ALI的发生发展。我们有理由相信上调ATF3的表达对急性肺损伤小鼠有保护作用,对于其在绿脓杆菌诱发的ALI肺部炎症性损伤的保护作用仍需进一步证实。
本文旨在进一步明确ATF3在绿脓杆菌致急性肺损伤中的作用,继续构建绿脓杆菌致急性肺损伤小鼠肺模,探讨ATF3在绿脓杆菌致急性肺损伤中的表达规律及意义。
材料与方法
一、实验材料
实验细菌及实验动物: ①绿脓杆菌: 系荧光标记绿脓杆菌,由复旦大学附属中山医院呼吸科宋元林教授赠予;②实验动物: C57BL/6(17.8~26.25 g)小鼠,SPF级,购买于陆军军医大实验动物中心。
二、研究方法
1. ATF3在绿脓杆菌致ALI中的作用: 用经鼻滴注的方法,以荧光标记的浓度绿脓杆菌菌液(1.5×108PFU/ml,50 μl)建立小鼠绿脓杆菌诱导急性肺损伤小鼠模型,同时用生理盐水作为阴性对照。采用组织切片和HE染色观察肺组织病理变化;通过肺泡灌洗液(BALF)中的蛋白含量、肺组织干湿比测定肺微血管通透性和肺水肿程度变化;qRT-PCR检测ATF3在野生型急性肺损伤小鼠肺组织中的表达规律。
2. 实验设计和急性肺损伤小鼠模型的建立
(1)观察ATF3在WT小鼠中绿脓杆菌诱导的ALI中的表达规律: 按照随机数字表法随机分组。首先将小鼠随机分为2组,分别为:野生型小鼠对照组(WC组,即给予野生型小鼠生理盐水)、野生型小鼠急性肺损伤组(WA组,即给予野生型小鼠经鼻滴入绿脓杆菌)。PA给予后0、3、6、12 h及24 h(每个时相点5只小鼠) 处理小鼠。
配制绿脓杆菌菌液: 将原始菌种从-80 ℃冰箱取出解冻后接种于哥伦比亚血平板,普通三区划线后放置于37 ℃孵箱中24 h后长出大量菌落。用接种环取适量1~2个菌落至于无菌生理盐水中,用DL-ZD1浊度计调至0.5个麦氏单位,相当于1.5×108cfu/ml(方法来源:引自卫生部规范教材《微生物学和微生物检验》第二版)。
将小鼠置于秤盘中称重。
麻醉小鼠: 取一朵医用棉球沾少许乙醚,并置于密闭的烧瓶内,然后将小鼠放入烧瓶内约20 s左右,见小鼠被麻醉后即取出小鼠,进行后续滴鼻操作。在用乙醚麻醉的过程中需掌握好麻醉时间,若麻醉时间过短则在后续操作过程中小鼠较活跃不易滴鼻操作,若麻醉时间过长则小鼠容易死亡。
绿脓杆菌/生理盐水滴鼻: 用左手抓住被乙醚麻醉后的小鼠背颈部,头部垂直向上,右手用10 μl移液器将绿脓杆菌菌液(以1.5×108cfu/ml的浓度)或生理盐水共50 μl滴鼻以吸入至肺内,滴注过程中可见小鼠鼻孔处有气泡产生,但嘴内无液体流出,表明绿脓杆菌经过呼吸道到达小鼠肺内。为利于吸入液体肺内分布,滴完后小鼠垂直放置约5 min,并用白炽灯加热保暖。
麻醉小鼠: 按绿脓杆菌作用时间设置处理时间点,左手抓住背颈部皮肤,固定小鼠头部,小指夹住尾巴,以45 ℃方向进针按戊巴比妥250 mg/kg剂量进行腹腔注射以麻醉小鼠。
肺泡灌洗: 待麻醉成功后,将小鼠固定于处理板上,解剖颈部,暴露气管,在气管上端剪一小口,置入自制气管导管,用1 ml生理盐水反复灌洗 3次,留取灌洗液约0.7~0.8 ml左右于EP管中,做好标记,置于-80 ℃冰箱备用。
收集标本: 固定小鼠于处理板上,打开胸腔,暴露肺脏组织,小心取下肺脏组织,右上肺用于提取蛋白,左肺用于提取RNA。
(2)检测肺泡灌洗液中总蛋白含量: 用微量白蛋白测定试剂盒(邻苯三酚红比色法)测定肺泡灌洗液中总蛋白含量。
(3)肺组织干湿比: ①将移除的左肺立即用电子天平称重为湿重;②烘烤箱内60 ℃下放置72 h至重量不在变化称重为干重。
(4)小鼠肺组织病理检测: 小鼠处理及实验分组同前。
肺组织石蜡包埋及切片:①酒精脱水:将肺组织从4%PFA中取出进行梯度酒精脱水:75%乙醇、80%乙醇、90%乙醇分别脱水30 min,100%乙醇脱水两次,每次30 min;②脱水透明:将肺组织置于透明剂二甲苯中进行透明两次,每次30 min,以脱出组织中酒精;③浸蜡与包埋:将已透明的肺组织置于已溶化的石蜡中,随之放入60 ℃烤箱中。待肺组织完全浸于石蜡后,用石蜡包埋机进行包埋。放置于4 ℃冰箱过夜,待冷却凝固成块;④切片:将包埋好的蜡块固定于切片机上,用切片机切成薄片,切片厚度约为5 μm。
HE染色: ①将切下的薄片贴到载玻片上,置于45 ℃恒温箱中烘干;②脱蜡:染色前使用二甲苯脱蜡2次,每次10 min;③由高到低浓度酒精梯度水化:分别于100%酒精,100%酒精,95%酒精,95%酒精水化各10 min,最后用ddH2O冲洗;④苏木素水溶液中染色3 min,用ddH2O冲洗3 min;⑤用0.5%盐酸酒精分色20 s,ddH2O冲洗1 min;⑥用0.5%伊红染色3 min,ddH2O冲洗2 min;⑦60 ℃恒温箱中将切片烘干,过夜; ⑧经纯酒精脱水、二甲苯透明后的切片,滴上中性树胶,盖上盖玻片封片,显微镜观察切片。
肺损伤评分按照以下三项标准进行: ①肺泡和间质水肿;②肺泡出血;③中性粒细胞浸润或聚集。每项标准又分四个等级:0=正常,1=轻度变化,2=中度变化,3=重度变化。最终的肺损伤得分为:三项标准评分的总和(总分为9)。
三、统计学方法
结 果
一、镜下荧光标记的绿脓杆菌
镜下荧光标记的绿脓杆菌,见图1。
二、肺泡灌洗液总蛋白含量结果
1. WT小鼠吸入绿脓杆菌后肺泡灌洗液总蛋白含量: 为了证实ALI造模是否成功,我们用微量总蛋白试剂盒(邻苯三酚红比色法)测定肺泡灌洗液中总蛋白含量。用WT小鼠吸入绿脓杆菌后3 h肺泡灌洗液中总蛋白开始升高,于6 h出现高峰,与空白组存在显著差异(P<0.05),提示肺微血管通透性增加,见图2。
2. ATF3对绿脓杆菌致急性肺损伤小鼠肺泡灌洗液总蛋白含量的影响: 本实验提示WT小鼠(WA组)吸入绿脓杆菌后肺泡灌洗液中总蛋白明显增加,较空白组、WC组重,说明WT小鼠吸入绿脓杆菌后肺微血管通透性增加,肺水肿程度加重。WA组较对照组及其他各组的结果存在显著差异(P<0.05),见图3。

图1 荧光标记的绿脓杆菌(100×);图2 WT小鼠吸入绿脓杆菌肺泡灌洗液总蛋白含量的时间梯度(a,b,c,P<0.05);图3 WT小鼠肺泡灌洗液总蛋白含量对比(a,b,c,P<0.05)
3. 肺组织干湿比结果: 为了进一步明确ATF3对绿脓杆菌诱导的ALI中肺水肿程度的影响,我们对肺组织干湿比进行了检测,结果显示,空白组的湿干比为11.76±0.404, WC组为11.615±0.414,WA组为13.25±0.216。本实验提示吸入绿脓杆菌的的WA组肺组织干湿比增加,较空白组、WC组均重,说明WT小鼠吸入绿脓杆菌后肺水肿程度加重。WA组较对照组及其他各组的结果有显著差异(P<0.05)。肺组织干湿结果与肺泡灌洗液中蛋白浓度结果相一致。
4. HE染色: 肺组织病理切片HE染色结果显示,在WT小鼠吸入生理盐水组(WC组)的肺泡间隔无明显增厚,肺泡腔无明显渗出,无明显炎性细胞浸润,与正常小鼠肺组织病理切片相比无明显差异,图4A。在吸入绿脓杆菌后6 h后,WT小鼠吸入绿脓杆菌组(WA组)肺泡结构破坏、肺泡间隔增厚、中性粒细胞浸润、肺泡出血以及肺间质水肿,呈现为典型的急性肺损伤病理变化。按照实验方法部分的标准进行肺组织损伤病理评分,结果显示WA组的得分高于WC组,见图4B。
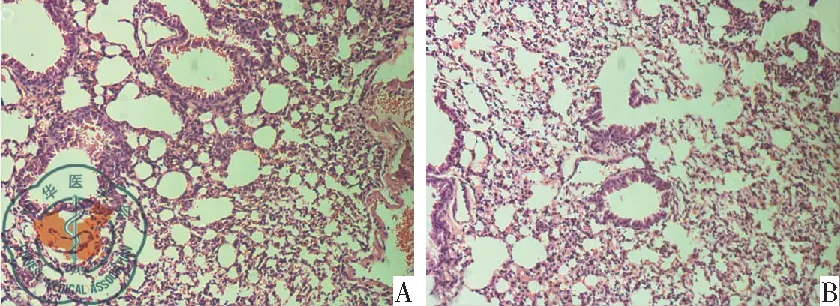
图4 小鼠肺病理学检查(HE×100);注:A:为WT小鼠滴入生理盐水(WC组);B:为WT小鼠滴入绿脓杆菌(WA组)
5. WT小鼠吸入绿脓杆菌后肺组织ATF3 相对表达时间梯度: 为明确ATF3在WT小鼠急性肺损伤肺组织中的表达规律,用qRT-PCR检测WT小鼠吸入绿脓杆菌后肺组织ATF3 mRNA表达,于0、3 h、6 h、12 h及24 h时相点分别为1.006±0.136,9.954±0.624,4.578±1.463,2.342±0.122,3.249±0.680,结果显示ATF3 mRNA于3 h达高峰,较0,6 h、12 h、24 h存在显著差异(P<0.05),见图5。
讨 论
ALI/ARDS是由炎症失控而引起顽固性低氧血症和严重呼吸困难为突出表现的临床危急重症[1]。绿脓杆菌是引发脓毒血症常见致病菌之一,亦是引发ALI的常见病因。多年研究表明ALI/ARDS本质是炎症反应失控,最终导致炎症级联反应而促发ALI/ARDS,但其发病机制十分复杂,至今尚不完全明确。故需深入探索ALI机制并针对炎症信号通路以寻找一个新的基因治疗靶点。
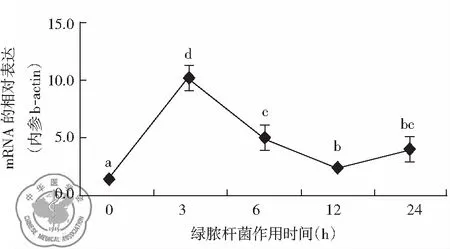
图5 WT小鼠吸入绿脓杆菌肺组织中ATF3mRNA相对表达规律(a,b,c,d,P<0.05)
ATF3是新近发现的TLR4信号通路中的一个具有负性调控作用的炎症调控因子。ATF3属ATF/CRB(the activating transcription factor, ATF/cyclic AMP response element-binding, CREB)家族成员,它属于应激早期快反应基因,在正常情况下于细胞内低水平稳定表达,但在各种应激信号(如炎症、氧化应激、缺血缺氧等)刺激后其表达水平能迅速显著提高。文献报道,ATF3广泛参与多种细胞活动的调控,许多疾病的发生发展均存在ATF3表达上调的适应性反应[13-19]。关于ATF3在绿脓杆菌诱导的ALI作用及机制的研究中,鲜有报道。
既往文献报道,在脓毒血症免疫抑制阶段,ROS可诱导ATF3表达增加,从而抑制IL-6等细胞因子生成,导致继发感染的敏感性增加[20]。在小鼠巨噬细胞中,ATF3能与巨噬细胞炎症蛋白-1β(CCL4)启动子ATF/CRE位点结合抑制巨噬细胞CCL4的表达和分泌,控制过度的炎症反应[21]。ATF3对呼吸机相关性肺损伤(ventilator induced lung injury, VILI)亦有保护作用,ATF3通过降低机械通气产生的环切力(CS)诱导的炎症反应对肺损伤有保护作用,能抗衡环切力和高通气带来的炎症[22]。上述结果均提示ATF3可降低炎症反应,证实了ATF3对炎症反应有“刹车” 作用,是TLR4信号通路中重要的负性调控基因。由此,我们有理由相信上调ATF3的表达对急性肺损伤小鼠具有保护作用。
为了评价ATF3的表达对绿脓杆菌致ALI小鼠的影响,我们先比较了WT小鼠吸入绿脓杆菌(WA组)、生理盐水(WC组)后与对照组的肺泡灌洗液中总蛋白、肺组织干湿比和肺组织病理改变。实验结果显示,吸入绿脓杆菌的WT小鼠(WA组)肺泡灌洗液中,于6 h时相点肺泡灌洗液总蛋白出现高峰,肺泡灌洗液总蛋白含量较WC组、对照组明显增加,肺组织干湿比明显加重,肺组织炎症病理改变明显(大量中性粒细胞浸润、肺泡结构破坏、肺泡出血及肺间质水肿)。上述研究结果说明WT小鼠吸入绿脓杆菌后肺微血管通透性增加,肺水肿程度加重,均提示经鼻滴入绿脓杆菌致急性肺损伤模型构建成功。PA菌液感染滴度为:1.5×108CFU/ml(相当于0.5个麦氏单位),符合实验要求。上述研究结果与文献报道相一致[23-24]。
本研究以往Western blot试验揭示[25],WT小鼠吸入生理盐水及绿脓杆菌均能诱导ATF3蛋白表达明显增加,其中生理盐水组在3 h时相点达最高峰,绿脓杆菌组在3 h、24 h时相点达最高峰,其中24 h较3 h峰值还高,均较空白组存在显著差异。为再次印证ATF3的表达规律,本实验结果显示,吸入绿脓杆菌后可诱导ATF3 mRNA表达增加,在3 h时相点达最高峰,24 h时相点基本回到正常水平,结果与前期预实验及文献报道相一致[26-27],与Western blot试验[25]结果基本一致。再次证实了ATF3在应激信号出现后其mRNA水平能迅速提高这一现象,即存在ATF3表达上调的适应性反应[13-19]。本研究既往实验已证实[28],吸入绿脓杆菌的ATF3敲基因小鼠巨噬细胞释放多种炎症因子如IL-1β、IL-6、TNF-α的量出现明显增加,于3 h达高峰,且明显高于WT小鼠及对照组的表达,这一结果与文献报道的LPS所致肺部炎症反应时相点相一致[23-24,27,29-30]。本实验中ATF3mRNA表达高峰在WT小鼠吸入绿脓杆菌后的3 h,与ATF3敲基因小鼠炎症因子释放高峰时相点相一致,并随之逐渐下降,且各种炎症因子表达高峰在吸入绿脓杆菌后的敲基因小鼠中表达明显高于WT小鼠,提示ATF3在绿脓杆菌诱导的ALI小鼠中能够抑制炎症因子的表达,是一个具有负性调控的适应性基因。为研究ATF3调控ALI的机制,我们既往采用了Western blot方法检测了NF-κB在小鼠肺组织的活性表达,实验结果已证实了TLR4/NF-κB信号通路可能是ATF3负性调控ALI的信号通路之一[25],与文献报道一致[23-24,27,29-30]。
综上所述,本实验通过分析绿脓杆菌致急性肺损伤中ATF3的表达规律,提示上调ATF3能负性调控绿脓杆菌诱导的ALI的肺组织炎症损伤,即ATF3对过激炎症反应有负性调控作用,再次证实了ATF3作为负性调控基因对绿脓杆菌致ALI小鼠可能有一定保护作用。故上调ATF3的表达可能为治疗ALI提供了新的治疗靶点。

