氮硫共掺杂碳点为荧光探针检测姜黄素的研究
弓 辉, 李雪冰, 吕俊杰, 王茹林, 卞 伟*
(山西医科大学基础医学院,山西太原 030001)
碳点(Carbon Dots,CDs)是一种粒径分布在10 nm以下的新型荧光碳纳米材料,形状近乎准球型。CDs因其良好的光学性能、表面的易于修饰、制备的成本低、良好的生物相容性以及较低的细胞毒性等优良性能,在荧光探针、生物成像和药物分析等领域得到了广泛的应用[1 - 3]。但一些CDs存在量子产率低和背景干扰性较大等缺点,极大地影响了其在生物成像方面的应用。研究者为了提高CDs的量子产率,提出了非金属杂原子或金属元素掺杂、表面功能化、官能团的修饰等多种方法。其中,非金属杂原子的掺杂简便绿色,备受人们的关注。如Zhang等[4]以四种具有代表性的微生物作为绿色碳前体,合成了N、P、S共掺杂CDs,并成功用于细胞内Cr(Ⅵ)和抗坏血酸(AA)的检测;ZENG等[5]以甲硫氨酸为原料,通过一步水热法合成了具有良好发光性能的N掺杂CDs,并成功用于细胞成像。
姜黄素的分子式为C21H20O6,它是一种二酮类化合物,具有抗炎[6]、抗氧化[7]、调脂、抗病毒、抗感染、抗肿瘤[8]等重要的生理和药理作用,因此,姜黄素在心脑血管疾病、消化系统疾病上有非常广泛的应用价值,引起国内外学者的广泛关注。目前检测姜黄素的方法有反相液相色谱法[6 - 8]、分光光度法[9]、高效液相色谱法[10]。本文以一水合柠檬酸和L-半胱氨酸为原材料,经微波加热合成了N、S共掺杂碳点(NSCDs)。采用透射电子显微镜(TEM)、傅里叶变换红外(FT-IR)光谱、紫外-可见(UV-Vis)吸收光谱对合成的掺杂CDs进行了表征。在最佳的实验条件下,根据姜黄素对NSCDs的荧光猝灭现象,建立了一种检测姜黄素含量的方法,并应用于检测实际尿样和血样中的微量姜黄素。初步探究了NSCDs与姜黄素的作用机理。
1 实验部分
1.1 仪器与试剂
JEM-1011型透射电子显微镜(TEM)(日本,JEOL);Paragon 1000型红外光谱仪(美国,Perkin-Elmer公司);TU-3900型双光束紫外-可见分光光度计(北京普析通用仪器有限责任公司);FB124型电子分析天平(北京普析通用仪器有限责任公司);pHSJ-3F型酸度计(上海垒固仪器有限公司)。
姜黄素(上海化学试剂总厂);NaH2PO4·2H2O(天津博迪化工厂);Na2HPO4·2H2O(天津博迪化工厂);Na3PO4·12H2O(天津博迪化工厂);无水乙醇(天津市天新精细化工开发中心);实验所用试剂均为分析纯。实验用水为去离子水。
1.2 氮硫共掺杂碳点(NSCDs)的制备
取0.5 g一水合柠檬酸和0.5004 g半胱氨酸,溶解于含有20 mL去离子水的小烧杯中,将小烧杯置于微波炉中反应2.5 min,得到黄色固体。将固体置于室温下冷却,加入20 mL去离子水搅拌溶解,过滤,再将得到的滤液用0.22 μm微孔滤膜过滤。然后把所得滤液用透析膜(MWCO=1 000 Da)透析12 h,得到浅黄色NSCDs的溶液,在4 ℃的冰箱中保存,备用。
1.3 姜黄素的检测方法
在5 mL的比色管中,加入10 mmoL/L的磷酸盐缓冲溶液(PBS,pH=7.8),浓度为3.0 mg/mL的NSCDs溶液和不同浓度的姜黄素标准溶液,混合摇匀。室温下反应7 min后,测定体系的荧光强度,记录荧光光谱。荧光光谱仪参数设置为:发射波长为345 nm,激发和发射狭缝宽度均为5 nm。
2 结果与讨论
2.1 NSCDs的表征
通过透射电子显微镜(TEM)、傅里叶变换红外(FT-IR)光谱、紫外-可见(UV-Vis)吸收光谱和荧光光谱对NSCDs进行了表征。从TEM图(图1)中可以看到NSCDs形状近似球形,单分散,粒径分布在3.5~4.5 nm之间。在NSCDs的傅里叶变换红外(FT-IR)光谱图中(图2),644 cm-1处的吸收峰是C-S键的伸缩振动;C-S键的弯曲振动的吸收峰位于986 cm-1处;C-O键与C-N键的弯曲振动峰分别为1 232 cm-1、1 392 cm-1;1 714 cm-1和1 538 cm-1处的吸收峰分别对应的是C=O、C=C的伸缩振动;2 934 cm-1处的吸收峰是C-H 键的伸缩振动引起的;同时可以明显看到3 434~3 350 cm-1处有较宽的吸收峰,说明此处有O-H与N-H键的伸缩振动。
图3为NSCDs的紫外-可见吸收光谱及荧光激发和发射光谱。由图可知,NSCDs的最大紫外吸收峰为320 nm,这是由于CDs中C-OH键的n-π*跃迁产生的[11]。当激发波长为345 nm,NSCDs在420 nm有最大的荧光发射峰。图4为NSCDs放置48 h后荧光强度的变化,由图可知NSCDs的荧光强度基本不改变,表明制备的NSCDs较为稳定。

图1 NSCDs的透射电镜(TEM)图(内插图为NSCDs的粒径分布图)Fig.1 TEM image of NSCDs(The inset is the particle size distribution of NSCDs)

图2 NSCDs的红外(FT-IR)光谱图Fig.2 FT-IR spectrum of NSCDs
综合TEM、FT-IR光谱和UV-Vis吸收光谱的实验结果,表明NSCDs已成功制备。
2.2 实验条件的优化
2.2.1pH的影响实验探究了不同pH值的PBS对NSCDs以及NSCDs-姜黄素体系荧光强度的影响,结果如图5。由图可知pH在4.0~7.8范围内,随着pH的增大,NSCDs的荧光强度增大且在pH=7.8时达到最大值,pH在7.8~11.0范围内,NSCDs的荧光强度迅速降低。加入姜黄素后,NSCDs-姜黄素体系的荧光强度变化趋势与NSCDs荧光强度的增减趋势相似,在pH值为7.8时荧光强度达到最大。因此,选择pH=7.8的PBS进行后续实验。
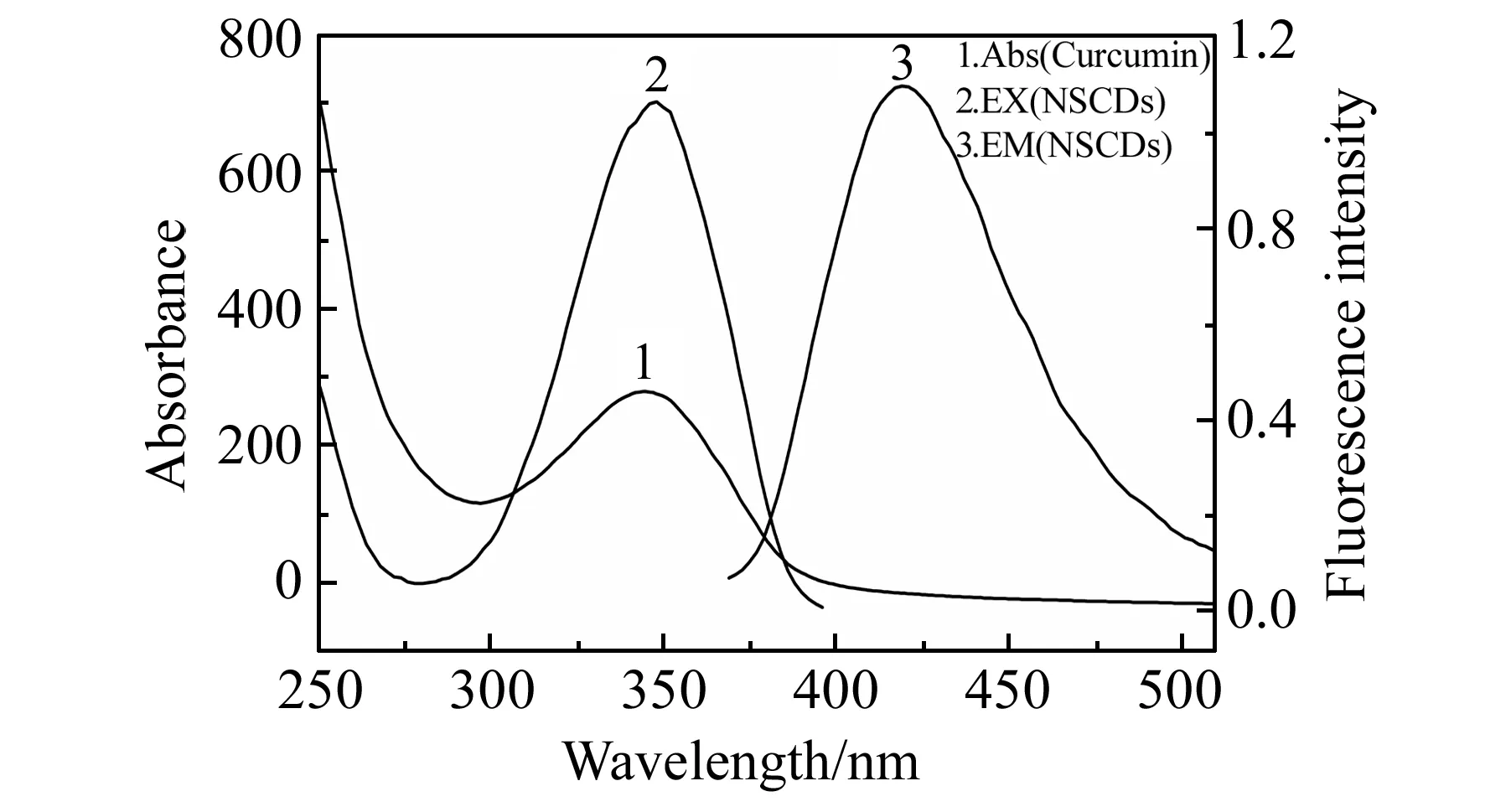
图3 NSCDs的紫外-可见(UV-Vis)吸收光谱(1)与荧光激发(2)和发射光谱(3)Fig.3 UV-Vis absorption spectra(1),fluorescence excitation (2) and emission (3) spectra of NSCDs

图4 NSCDs的稳定性实验(放置48 h)Fig.4 The stability experiment of NSCDs(48 h)
2.2.2NSCDs浓度的影响在pH=7.8的条件下,探究了不同浓度的NSCDs对姜黄素检测的影响,见图6。由图6可知,在2.0~3.0 mg/L范围内,NSCDs的荧光强度变化(F0/F)与姜黄素浓度(c)的线性关系符合Stern-Volmer方程,方程的斜率随着NSCDs浓度的升高逐渐变大,在NSCDs的浓度为3.0 mg/L时方程的斜率达到最大。继续增大NSCDs的浓度,方程的斜率逐渐减小。因此,选择浓度为3.0 mg/L的NSCDs作为实验最佳浓度。

图5 pH对NSCDs以及NSCDs-姜黄素体系荧光强度的影响(姜黄素的浓度为3.33×10-7 moL/L)Fig.5 Effect of pH on fluorescencec intensity of NSCDs and NSCDs-curcumin system(the concentration of curcumin is 3.33×10-7 moL/L)
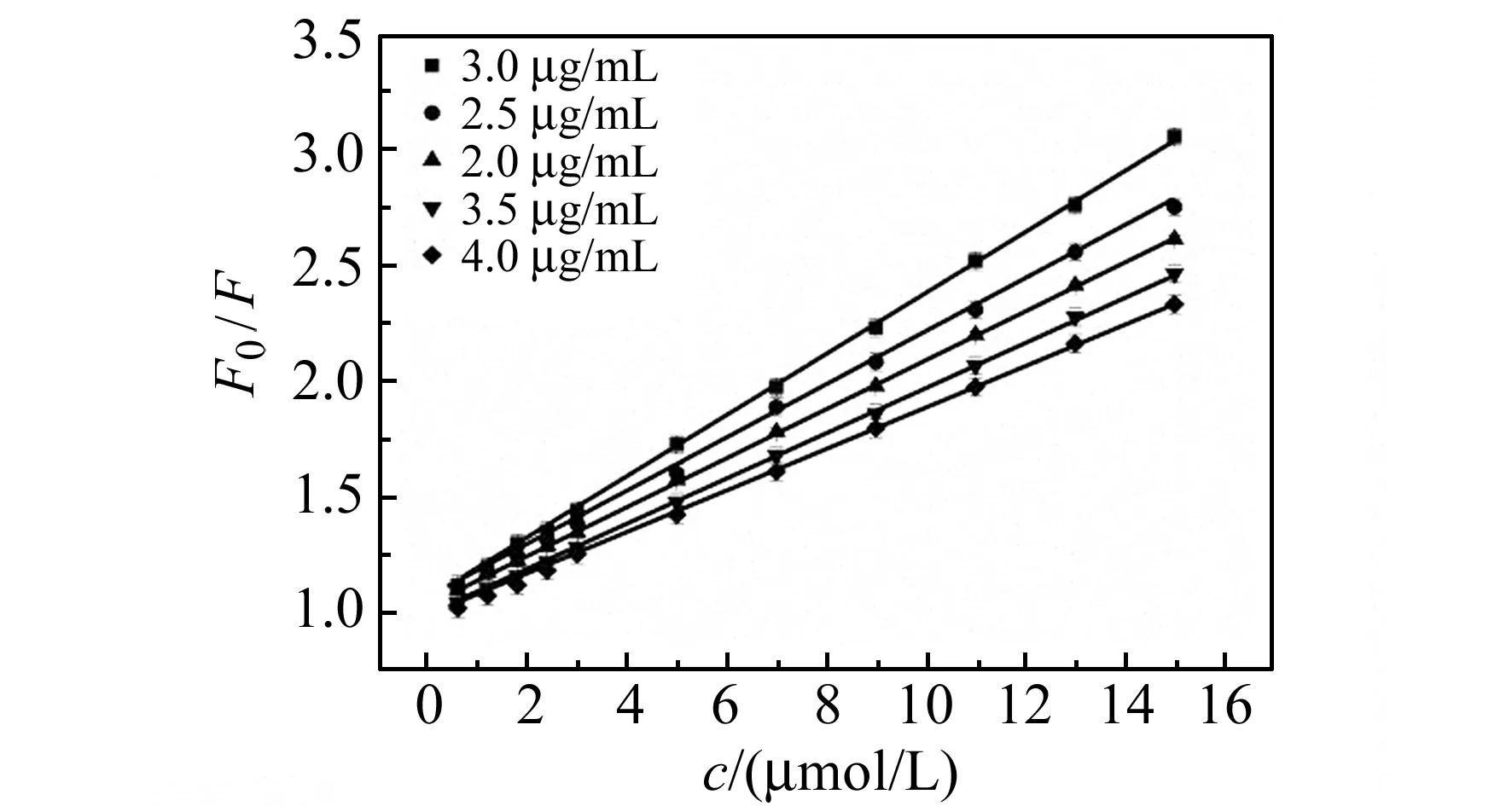
图6 NSCDS的浓度对NSCDs-姜黄素体系F0/F的影响Fig.6 Effect of the concentration of NSCDs on F0/F NSCDs-curcumin system
2.2.3反应时间的影响在pH=7.8和NSCDs浓度为3 mg/L的条件下,探究了反应时间对NSCDs-姜黄素体系荧光强度的影响。由图7可知,加入姜黄素后NSCDs的荧光强度迅速降低,反应时间在7 min时NSCDs荧光强度降到最小,反应在7~60 min之间荧光强度时基本保持不变。选择7 min为后续实验的反应时间。
2.3 姜黄素浓度对NSCDs掺杂碳点荧光光谱的影响
在最佳实验条件下,探究了不同浓度的姜黄素对NSCDs荧光强度的影响如图8。随着姜黄素浓度不断增大,NSCDs的荧光强度逐渐下降。

图7 反应时间对NSCDs-姜黄素体系荧光强度的影响Fig.7 Effect of reaction time on fluorescence intensity of NSCDs- curcumin system

图8 姜黄素浓度对NSCDs荧光强度的影响(内插图为校正曲线)Fig.8 Effect of curcumin concentration on fluorescence intensity of NSCDs(Inset:the calibration curve)c(1 - 15):0.2 - 15 μmol/L.
姜黄素的浓度在0.2~15 μmoL/L范围内与NSCDs的荧光强度的变化符合Lineweaver-Burk方程,线性关系良好,相关系数(R2)为0.9920,检出限为62 nmoL/L。加入10 μL姜黄素重复测定11次所得的相对标准偏差为0.65%。
2.4 共存物质的干扰性实验
在上述最佳的实验条件下,探究了常见金属离子和各种氨基酸对姜黄素猝灭NSCDs荧光强度的影响,结果如表1所示。由表可知,常见的金属离子和各种氨基酸对该体系的影响基本可以忽略,表明NSCDs对姜黄素有很好的选择性。

表1 共存物质对NSCDs-姜黄素体系的影响(姜黄素的浓度为3.33×10-7 moL/L)
2.5 反应机理
荧光猝灭分为静态猝灭和动态猝灭。基态荧光分子与猝灭剂之间通过弱的结合生成复合物,该复合物使荧光分子荧光完全猝灭的现象称为静态猝灭;猝灭剂与荧光激发态分子之间的相互作用致使荧光强度降低的过程是动态猝灭。两种猝灭分别用Lineweaver-Burk(1)和Stern-Volmer(2)方程表示。由于静态猝灭中有配合物的生成,荧光物质的紫外吸收光谱会发生变化;温度升高,配合物的稳定性会降低,Stern-Volmer猝灭常数减小[12]。而动态猝灭主要是由于分子之间的碰撞引起的,其紫外吸收光谱不会发生变化,Stern-Volmer猝灭常数随温度的升高而增大[13]。
1/(F0-F)=1/F+1/(KLBF0[Q])
(1)
F0/F=1+KSV[Q]
(2)
F0和F为分别为加入猝灭剂前后荧光物质的荧光强度,[Q]为猝灭剂的浓度,KLB和KSV分别是静态和动态猝灭常数。
由图8可知NSCDs与姜黄素的相互作用符合Lineweaver-Burk方程。表2显示随着温度的升高,NSCDs的猝灭常数减小;由图9可以看到,将不同浓度的姜黄素标准溶液加入NSCDs溶液中,NSCDs的紫外吸收逐渐升高;图10表示的是,向NSCDs溶液中加入不同浓度姜黄素后,其荧光寿命基本保持不变。根据以上实验结果初步推测NSCDs与姜黄素相互作用的机理主要为静态猝灭。

表2 不同温度下Stern-Volmer方程的参数

图9 不同浓度的姜黄素对NSCDs紫外-可见(UV-Vis)光谱的影响Fig.9 Effect of curcumin with different concentrations on NSCDs UV-Vis spectracurcumin concentration(1 - 5):0.0,0.2,0.6,0.8,1.3 μmoL/L.
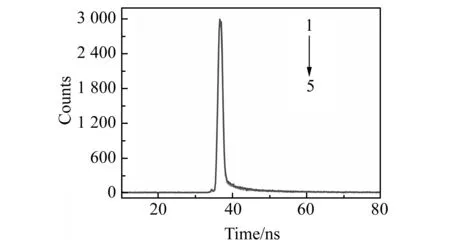
图10 不同浓度的姜黄素对NSCDs荧光寿命的影响Fig.10 Effect of different concentrations of curcumin on the fluorescence lifetime of NSCDscurcumin concentration(1 - 5):0.0,2.0,4.0,8.0,10.0 μmoL/L.
2.6 实际样品分析
为了验证该方法在实际样品中检测姜黄素的可行性,将不同浓度的姜黄素加入到人体尿样和血样中,用加标回收法进行分析,由表3知姜黄素在尿样和血样中的回收率在98%~102%之间,说明该方法的分析准确度良好,能够用于实际样品的检测。
3 结论
本实验以柠檬酸、L-半胱氨酸为原料在微波法加热的条件下成功合成了NSCDs。基于姜黄素对掺杂碳点荧光强度的猝灭作用,建立了一种快速检测姜黄素含量的方法。最佳实验条件下,姜黄素的浓度在0.2~15 μmoL/L的范围内与NSCDs的荧光强度成良好的线性关系,其检出限为62 nmoL/L。初步探讨了姜黄素与NSCDs相互作用主要为静态猝灭过程。将该方法应用于实际尿样和血样中姜黄素的测定,回收率在98.0%~102%之间,能够用于实际样品的检验。

