基于无标记核酸适配体的凝血酶表面增强拉曼散射传感器
邓 媛, 易润芳, 周晓东*, 胡继明
(1.武汉大学科学技术发展研究院,湖北武汉 430072;2.武汉大学化学与分子科学学院,湖北武汉 430072)
核酸适配体(Aptamer)是基于指数富集配体系统进化技术(SELEX)的体外筛选过程产生了大量能与各种配体高特异性结合的单链DNA或RNA序列[1],其空间结构和构象的多样性使其能通过静电作用、氢键作用、范德华力和形状匹配等各种作用形式与各种靶标分子结合[2]。核酸适配体具有亲和力高、特异性强、靶分子广等特点,同时还具有化学稳定性好、易合成和修饰等优势,使得这类体外筛选的核酸结构在构建检测各种与生命科学、临床诊断、药物发现和环境科学相关的靶标分子的新型传感器方面有着重要的应用[3 - 5]。
表面增强拉曼散射(SERS)是一种高灵敏度和高选择性的检测技术,被广泛应用于生物传感检测领域[6 - 7]。SERS与适配体技术相结合,可以实现对目标特异性和敏感性的快速、简便检测,构建一系列新型操作简便、选择性高、精确性好的传感平台[8 - 10]。Wang等[11]应用核酸适配体与SERS结合设计了一种检测凝血酶的传感器。他们将巯基修饰后的适配体通过化学键结合到金基底表面,加入凝血酶和表面同时修饰了凝血酶核酸适配体链和拉曼染料R6G的金纳米粒子(AuNPs)溶胶。凝血酶的两个活性位点分别与金基底表面和AuNPs表面的核酸适配体结合,形成“三明治夹心”结构。再通过银沉积增强后检测R6G的SERS信号实现凝血酶的定量分析。Yang等[12]利用末端带有巯基的Aptamer将凝血酶捕获,并加入对巯基苯甲酸(4-Mercaptobenzoic Acid,MBA)标记的银纳米粒子(AgNPs@MBA)。该纳米粒子通过MBA的羧基与凝血酶上的氨基发生反应而连接在基底上,通过检测MBA的SERS光谱,实现对凝血酶的间接检测。由上可以看出,大部分基于核酸适配体的检测技术所需的核酸适配体都需先经过复杂的功能化修饰和纯化,通过分析修饰在标记型核酸适配体上的信号分子,如SERS活性物质、拉曼染料分子或荧光基团来间接地检测靶标物。而修饰过后的核酸适配体价格昂贵,并可能使检测平台的稳定性降低,因此,直接检测无标记的核酸适配体分子成为现今研究的一个热点。Barhoumi等[13]报道了一种可以稳定获得核酸适配体的SERS光谱的方法。他们发现DNA的SERS谱峰主要位于736 cm-1,归属为腺嘌呤(A碱基)呼吸模式。而Domke等[14]发现,DNA序列中A碱基越多,在736 cm-1处的SERS特征峰信号强度就越强,这为核酸适配体的定量检测提供了依据。
本研究通过检测核酸适配体的内源SERS信号直接检测凝血酶,构建了一个基于无标记核酸适配体的SERS检测平台,并引入MBA为内标,设计了一种Aptamer/MBA/AuNPs复合物探针,通过核酸适配体和MBA的SERS信号的相对强度变化实现对凝血酶的定量检测,提供了一种快速、便捷、高选择性的检测凝血酶的方法。
1 实验部分
1.1 仪器与试剂
HR800共聚焦显微拉曼光谱仪(法国,Jobin Yvon公司),采谱条件:激发波长为633 nm,采用50倍长焦镜头,狭缝宽度50 μm,孔径为200 μm,曝光时间20 s,积分次数3次。
凝血酶以及牛血清白蛋(BSA)均购于Sigma公司(上海),凝血酶29个碱基的核酸适配体:5′-AGTCCGTGGTAGGGCAGGTTGGGGTGACT-3′购于生工生物工程(上海)技术有限公司,HAuCl4·3H2O、柠檬酸钠、MBA等均为国产分析纯试剂。缓冲溶液包括TE缓冲溶液(10 mmol·L-1Tris-HCl,1 mmol·L-1EDTA,50 mmol·L-1NaCl,pH=7.4)和TBB缓冲溶液(20 mmol·L-1Tris-HCl,20 mmol·L-1NaCl,5 mmol·L-1KCl,5 mmol·L-1MgCl2,pH=7.4)。实验用水为超纯水(18.2 MΩ·cm)。
1.2 核酸适配体的热预处理
核酸适配体溶解在TE缓冲溶液中,将溶液加热到95 ℃并保持10 min,然后将溶液置于冰浴中快速冷却。处理后的核酸适配体置于冰箱中保存,待用。
1.3 AuNPs的合成
本实验采用自合成的AuNPs(粒径40 nm),合成方法参照文献方法[15]。将49.5 mL的超纯水置于250 mL的两口瓶中,加入0.5 mL浓度为1%的HAuCl4溶液,于120 ℃下加热回流,再加入0.5 mL浓度为1%的柠檬酸三纳溶液后,溶液颜色先慢慢变黑进而变为酒红色,继续搅拌回流20 min,冷却过后,将合成的AuNPs再于5 000 r·min-1的转速下离心浓缩4倍后,置于阴暗处保存待用。
1.4 Aptamer/MBA/AuNPs复合物探针的合成
在玻璃管中加入880 μL上述浓缩的AuNPs溶液,再加入100 μL浓度为100 μmol·L-1的热预处理过的Aptamer溶液,混合均匀后于室温下放置24 h。向该体系中加入4 μL不同浓度的MBA溶液,混合均匀后放置过夜,备用。
1.5 凝血酶的检测
将上述制得的Aptamer/MBA/AuNPs复合物探针溶液于5 000 r·min-1的转速下离心15 min,移去上清液,再用TBB缓冲溶液重悬,重复两次,以保证除净复合物探针溶液中的未结合到AuNPs表面的Aptamer。取30 μL离心重悬后的探针溶液,分别与30 μL不同浓度的凝血酶溶液混合,于室温下反应3 h后,检测拉曼光谱。
2 结果与讨论
2.1 检测机制
图1为Aptamer/MBA/AuNPs复合物探针检测凝血酶的原理和过程。MBA通过巯基与AuNPs化学键合,而Aptamer则通过碱基N原子与Au之间的协同配位作用有效吸附到AuNPs上,形成了Aptamer/MBA/AuNPs复合物探针。该复合物探针的SERS光谱在1 075 cm-1和735 cm-1处分别出现明显的MBA(苯环取代基上的C-C 伸缩振动)和Aptamer(腺嘌呤的环呼吸振动)特征峰(图2)。当体系中加入凝血酶时,凝血酶与Aptamer特异性结合形成G-四联体,G-四联体结构不仅比结构未变化的单链Aptamer表面电荷密度大,而且该结构的形成阻止了Aptamer的碱基暴露于AuNPs中,因而形成的G-四联体不易吸附到AuNPs上,从而促使核酸适配体远离金表面。由于SERS是一种长程效应,增强效果与SERS基底和活性物质间的距离相关,尽管靠近基底表面10 nm范围内的分子都能产生SERS信号,但所获得的SERS信号仍主要来源于直接作用于基底表面的第一层信号分子的贡献。因此随着加入的凝血酶浓度的增加,越来越多的Aptamer脱离AuNPs表面,致使Aptamer拉曼信号强度下降,而MBA的信号峰强度保持不变。从而,MBA的信号峰强度可作为归一化的标准,而MBA特征峰1 075 cm-1和Aptamer特征峰735 cm-1的峰强比(I1 075/I735)与凝血酶浓度之间的关系则可作为凝血酶定量分析的依据。

图1 Aptamer/MBA/AuNPs复合物探针检测凝血酶的原理Fig.1 Principle of thrombin detection using Aptamer/MBA/AuNPs composite probe

图2 Aptamer/MBA/AuNPs复合物探针的SERS光谱图Fig.2 SERS spectra of the Aptamer/MBA/AuNPs composite probe
2.2 实验条件的优化
2.2.1热预处理的影响本实验比较了分别用热预处理前后的Aptamer制备的复合物探针的拉曼光谱。由图3可以看出,由未经过热预处理的Aptamer制备的复合物探针很难观察到735 cm-1处A碱基的环呼吸振动谱峰,而经过热预处理过的Aptamer空间结构伸展成线性构象,大大提高了Aptamer拉曼光谱的重现性,且预处理过后的SERS光谱主要是腺嘌呤的拉曼光谱,相对而言其它碱基的二级结构特征谱峰要弱得多。这是因为腺嘌呤的吸收截面大于其他碱基,因此,热预处理对Aptamer的拉曼光谱信号强度影响巨大,同时也影响光谱的重现性,是检测的关键所在。

图3 未经热预处理的(A)和热预处理后的(B)Aptamer制备的Aptamer/MBA/AuNPs复合物探针的拉曼光谱图Fig.3 Comparison of SERS spectra of Aptamer/MBA/AuNPs composite probe before(A) and after(B) thermal pretreatment of aptamer
2.2.2AuNPs溶液浓度的影响分别在制备得到的AuNPs原液和浓缩了4倍的AuNPs溶液中,依次加入MBA溶液放置24 h,再加入热预处理后的Aptamer溶液,同样放置24 h后检测拉曼光谱。使制得的Aptamer/MBA/AuNPs复合物探针溶液中Aptamer的浓度为10 μmol·L-1,且Aptamer与MBA的摩尔浓度比为20∶1,所得的拉曼光谱如图4所示。由图可知,未浓缩的AuNPs探针的拉曼光谱谱图中几乎观察不到Aptamer的拉曼信号,而浓缩过后所制得的探针的拉曼光谱中,Aptamer和MBA都有很强的信号峰。推断可能是由于Aptamer未经浓缩的探针溶液中,AuNPs的个数较少,其表面主要被MBA分子占据,使得Aptamer分子没有足够的空间和位点结合到它的表面。而浓缩过后的AuNPs颗粒较多,两种分子能有充足的位点均匀地作用到AuNPs表面。
2.2.3Aptamer和MBA修饰顺序的影响Aptamer/MBA/AuNPs复合物探针制备过程中,在AuNPs溶液中加入Aptamer和MBA的先后次序对拉曼光谱各谱峰的信号强度有很大的影响。将40 nm的AuNPs溶液通过离心和重新分散的方法浓缩4倍,再加入经热处理后的Aptamer溶液和MBA溶液,保持两种物质的加入量相同,仅改变加入顺序。每加入一种物质后于室温下放置24 h,再加入另一种物质同样放置24 h后,再测量所制备的复合物探针的拉曼光谱。结果如图5所示。由图可知,在加入量相同的情况下,Aptamer特征峰735 cm-1和MBA特征峰1 075 cm-1的峰强比(I735/I1 075)与加入次序的关系为:先加Aptamer的峰强比(I735/I1 075)>同时加入的峰强比>先加MBA的峰强比。因此,为得到Aptamer信号较强的探针分子检测凝血酶,同时提高检测的灵敏度,本实验采用先加入Aptamer再加入MBA的顺序制备Aptamer/MBA/AuNPs复合物探针。

图4 AuNPs溶液浓度对Aptamer/MBA/AuNPs复合物探针的拉曼信号的影响Fig.4 Effect of concentration of AuNPs solution on SERS signal of Aptamer/MBA/AuNPs composite probea:original aptamer solution;b:concentrated aptamer solution.

图5 Aptamer和MBA在AuNPs上修饰顺序的影响Fig.5 Effect of the modifying order for aptamer and MBA to AuNPsa:Adding aptamer firstly and MBA secondly;b:Adding aptamer and MBA at the same time;c:Adding MBA firstly and aptamer secondly.
2.2.4Aptamer和MBA加入量对检测灵敏度的影响Aptamer与MBA的量在很大程度上会影响探针检测凝血酶的灵敏度。为探讨Aptamer与MBA的浓度对复合物探针灵敏度的影响,我们制备了一系列不同Aptamer与MBA摩尔浓度比(cAptamer/cMBA:10∶1、20∶1、30∶1、40∶1、50∶1)的探针溶液,检测其SERS光谱,结果如图6(A)所示,不同的cAptamer/cMBA下,Aptamer的信号强度与MBA信号强度之比(IAptamer/IMBA)有明显的的变化。作Aptamer与MBA摩尔浓度比对IAptamer/IMBA的曲线(图6(B)),从中可知,在cAptamer/cMBA为10∶1至20∶1的浓度范围内IAptamer/IMBA变化最快,曲线斜率最大,即复合物探针的灵敏度最高,故选择cAptamer/cMBA=20∶1 制备复合物探针。

图6 Aptamer和MBA加入量对Aptamer/MBA/AuNPs复合物探针灵敏度的影响Fig.6 Effect of the amount of aptamer and MBA on the sensitivity of Aptamer/MBA/AuNPs composite probe(A)SERS spectra of Aptamer/MBA/AuNPs composite probe at different cAptamer/cMBA(a to e):10∶1,20∶1,30∶1,40∶1,50∶1;(B)curves of cAptamer/cMBA vs.I735/I1 075.
2.3 凝血酶的检测
在优化的实验条件下,使用Aptamer/MBA/AuNPs复合物探针对凝血酶进行检测。配制一系列不同浓度的凝血酶溶液,在玻璃管中加入30 μL探针溶液与30 μL各浓度的凝血酶溶液,于室温下反应3 h后,测量反应后体系的SERS光谱,结果如图7(A)所示。由图可知,不同浓度的凝血酶与修饰有Aptamer和MBA的AuNPs复合物探针溶液反应,凝血酶与Aptamer特异性结合形成G-四联体,使原本吸附在AuNPs上的Aptamer远离金表面,凝血酶浓度不同,Aptamer脱离金表面的程度也不同,由于SERS的长程效应,凝血酶浓度越大,Aptamer的SERS信号强度下降得越多,而1 075 cm-1处MBA的SERS强度则基本保持稳定。因此,以MBA为内标分子,取1 075 cm-1处MBA的特征峰为归一化标准,MBA特征峰与735 cm-1处Aptamer特征峰的相对峰强度(I1 075/I735)和凝血酶浓度之间的变化关系可作为凝血酶定量分析的依据。图7(B)为不同凝血酶浓度cthrombin下的峰强比(I1 075/I735),并进行了曲线拟合,方程为:Y=0.79-1.29×X+0.63×X2,相关系数R2为0.970。凝血酶的检测范围为100~2 000 nmol·L-1,最低检测浓度为100 nmol·L-1。
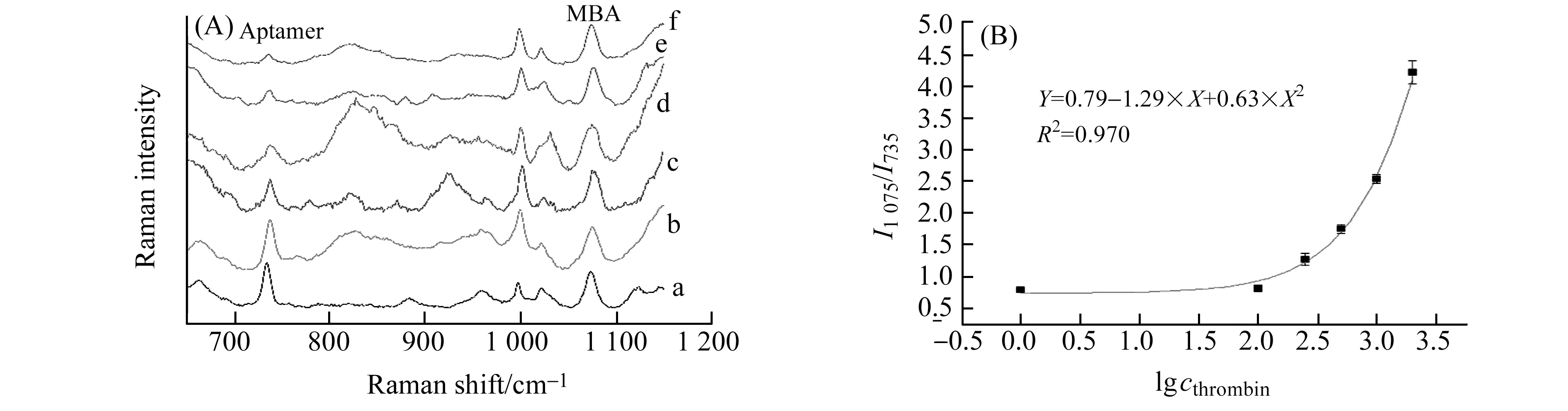
图7 Aptamer/MBA/AuNPs复合物探针对凝血酶的检测Fig.7 Thrombin detection by Aptamer/MBA/AuNPs composite probe(A)SERS spectra of Aptamer/MBA/AuNPs composite probe at different cthrombin(a to f:0,100,250,500,1 000,2 000 nmol/L);(B)Polynomial fitting curve of lgcthrombin vs.I1 075/I735.
2.4 Aptamer/MBA/AuNPs复合物探针对凝血酶检测的选择性
为验证Aptamer/MBA/AuNPs复合物探针对凝血酶检测是否有较高的特异性,我们在Aptamer/MBA/AuNPs复合物探针溶液中加入同体积、不同浓度的牛血清白蛋白(BSA)溶液,反应3 h 后检测SERS光谱(图8)。实验结果表明,BSA的加入对探针分子上的信号影响很小,即BSA对凝血酶的检测无干扰,证明了Aptamer/MBA/AuNPs复合物探针对凝血酶检测具有很好的选择性。
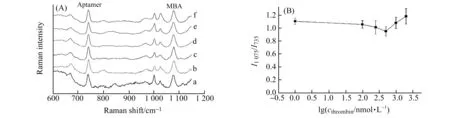
图8 不同BSA浓度下Aptamer/MBA/AuNPs复合物探针的SERS光谱(A)和lgcBSA对I1 075/I735的关系曲线(B)Fig.8 SERS spectra of Aptamer/MBA/AuNPs composite probe at different cBSA (A) and curve of lgcBSA vs.I1 075/I735(B)a to f:0,100,250,500,1 000,2 000 nmol/L.
3 结论
本文设计了一种基于无任何修饰的Aptamer的SERS探针,构建了一种基于Aptamer技术的凝血酶的SERS检测传感平台。该探针利用Aptamer上A碱基的内源SERS信号实现检测,方法快速,经济简便且选择性好。同时引入了MBA为内标,克服了SERS信号不稳定的缺点。在优化了Aptamer的热预处理、AuNPs溶液浓度、Aptamer和MBA在AuNPs上修饰顺序,以及探针制备过程中Aptamer和MBA加入量等实验条件下,以MBA和Aptamer的SERS特征峰的相对强度随凝血酶浓度的变化关系为依据,实现了一定浓度范围(100~2 000 nmol·L-1)内凝血酶的定量检测。本传感平台有很大的普适性,可检测许多其他具有相应Aptamer的靶标物,即使是无A碱基的Aptamer也可通过自行设计链长度和组成,在Aptamer中增加一定量的A碱基,构建相应的检测平台。

