Pkhd1基因缺陷对雄性小鼠生育能力的影响
毛 军,徐雨辰,高晶晶,彭党委,窦贤明,黄振宇,程 鹏,沈旭峰,张贤生
常染色体隐性多囊肾(autosomal recessive polycystic kidney disease, ARPKD)是婴儿和儿童时期最常见的囊性肾病,其发生率约为1/20 000;在人群中,其隐性致病基因-纤囊蛋白基因(polycystic kid-ney and hepatic disease 1, Pkhd1)携带率估计为1/70[1]。遗传连锁研究[2]表明,致病基因突变位于人类染色体区域6p21.1-6p12。由Pkhd1基因编码的FPC是一种包含4 074个氨基酸的完整膜蛋白。ARPKD患者的临床表现差异很大,其典型的表现为先天性肝纤维化和多囊性肾病。因此,至今对于ARPKD的研究主要集中在肾脏和肝脏。而常染色体显性多囊肾(autosomal recessive polycystic kidney disease, ADPKD)的男性生育力已有长期大量的相关研究[3],且男性ADPKD患者的生育方面有相关缺陷。但相较于ADPKD,ARPKD的发病率低和死亡率高,鲜有研究男性ARPKD患者的生育相关问题。然而,Dell[4]发现ARPKD可以在从婴儿期到成年期的任何年龄发病。而且,随着现代肝肾移植手术进步和呼吸系统并发症护理水平提高,其存活率已经得到了极大的改善。相关数据[5]显示,接受肾移植的ARPKD患者的生存率可达到78%~92%。因此,ARPKD不再局限于儿科疾病,成人患者也可有相对温和的临床表现。随着此类患者逐渐达到生育年龄,生育问题将不可避免。所以对于男性ARPKD患者,其生殖相关问题尤为迫切。研究[6]表明PKHD1基因及其产物与小鼠同源且功能相似。该研究主要通过观察APPKD模型小鼠的生殖功能,探究Pkhd1基因对雄性生育能力的影响。
1 材料与方法
1.1实验动物SPF级雄性Pkhd1基因敲除小鼠(C57BL/6)10只,此小鼠模型(Pkhd1基因是否已敲除及其敲除程度)在本团队之前的研究已作详细描述[7]。野生型小鼠各10只及若干只雌鼠,雄性鼠龄2~3个月,雌鼠鼠龄2~4个月,由中国医学科学院肿瘤医院实验动物中心提供。动物饲养环境严格保证,昼夜明暗交替时间12/12 h,温度20~24 ℃,相对湿度40%~70%,自由进食水。实验结束后,颈椎脱臼处死雄性小鼠并称重,分离每只小鼠的睾丸和附睾并称重,并计算相对体重。
1.2组织苏木精伊红染色(HE) 标本经10%中性甲醛充分固定后,经梯度酒精脱水和二甲苯透明后,制作成蜡块。4 μm连续切片,切片做HE染色。
1.3精子分离及其相关参数检测
1.3.1精子分离 颈离断处死小鼠后,分离一侧附睾尾置于1.5 ml EP管内并剪碎,滴加已预热37 ℃的HTF液1 ml,微微震荡后放入CO2培养箱(37 ℃)培养15 min,取上清液用于精子参数检测。以下操作均重复计数200个精子,且严格按照《世界卫生组织人类精液检查与处理实验室手册(第5版)》施行。
1.3.2精子浓度检测 在200×倍数显微镜下,用改良Neubauer血细胞计数板计数精子数量并计算精子浓度。
1.3.3精子活力检测 在200×倍数显微镜下观察已制备好的湿片,按照精子的活力大小,将每个所观察到的精子活力分为向前运动(PR)(精子主动地呈直线或沿一大圆周运动,不管其运动速度如何)、非向前运动(NP)(所有其他非向前运动的形式,如以小圆周泳动,尾部动力几乎不能驱使头部移动,或者只能观察到尾部摆动)和不活动(IM)(没有运动)三类,并统计分析。
1.3.4精子存活率检测 将精子用苯胺黑伊红染色(试剂购自印度 solarbio公司),在400×倍数显微镜下计数评定精子死活。头部白色被认定为活精子,头部红色被认定为死精子,并统计分析。
1.3.5精子形态学检测 精子经巴氏染色(试剂购自印度 solarbio 公司),依用亮视野在1 000×油镜下观察涂片,记录精子形态。
1.4生育力检查参照Mao et al[8]的方法,生育力实验采用雌雄合笼的方式。Pkhd1-/-和野生型雄鼠各5只,按照雌雄比2 ∶1,每个笼里放3只小鼠。每天检查雌鼠是否“见栓”,将“见栓”雌鼠替换并单独饲养至生产。每周替换未“见栓”的雌鼠。统计所有的“见栓”雌鼠、未“见栓”雌鼠、对应生产窝数、总子代数,用于计算交配率(frequency of mating,FM)、怀孕率(rate of pregnancy,RP)及平均产仔率(average number of pups,ANP)。t检验和χ2检验被用于计算两组的差异性。
2 结果
2.1Pkhd1-/-和野生型小鼠之间的肝脏、肾脏和生殖系统的形态学在3月龄的小鼠中,Pkhd1-/-和野生型的肾脏之间没有明显的差异,见图1A、1B;然而,相较于正常小鼠,3月龄的Pkhd1-/-小鼠的肝脏布满囊肿。见图1C、1D。其囊肿数量虽多,但因体积小而未压迫正常肝组织,此时肝功能基本无影响。另外,睾丸体重比(P=0.138)和附睾体重比(P=0.179)在Pkhd1-/-和野生型之间差异无统计学意义(图1E、1F)。而且,两组雄性小鼠的生殖系统(睾丸、附睾、输精管和精囊)的生物形态基本相似(图1G~N)。在大体形态上,Pkhd1基因似乎对雄性小鼠生殖系统未产生影响。
2.2精子数目、活动力和存活率分析对小鼠附睾尾的精子数目的分析显示,相较于野生型小鼠,Pkhd1-/-的精子总数显著降低(P=0.029)。见图2A。两组精子活动力的差异性主要体现在向前运动类型精子(PR)方面,而野生型的非向前运动精子(NP)比例略低于Pkhd1-/-小鼠。但是,Pkhd1-/-的总精子活动力(PR+NR)明显低于野生型组小鼠(P=0.013)。见图2B。通过苯胺黑伊红染色(图2C)显示,Pkhd1-/-和野生型小鼠的精子存活率分别为(76.40±8.289)%和(70.30±9.452)%,两组差异无统计学意义(P=0.118),见图2D。且都在正常范围(>58%)。
2.3精子形态学分析经巴氏染色后观察显示野生型和Pkhd1-/-小鼠的精子畸形率分别为11%和17%,两者差异有统计学意义(T:P=0.015; C:P=0.012)。Pkhd1-/-精子畸形率较高主要体现在其尾部卷曲比率较野生型小鼠精子高。 Pkhd1-/-精子的尾部更加容易发现胞质滴(CDs)(P=0.018)。见图3。
2.4Pkhd1基因缺陷影响雄性小鼠的生育力表1显示两组小鼠的交配频率(P=0.501)和受孕后小鼠的平均产仔率(P=0.255)差异无统计学意义;Pkhd1-/-组交配后雌鼠的受孕率(FP)明显低于野生型组(P=0.028),说明Pkhd1基因缺失可使雄性小鼠的生育力降低。

表1 Pkhd1基因缺陷可导致雄性生育力下降
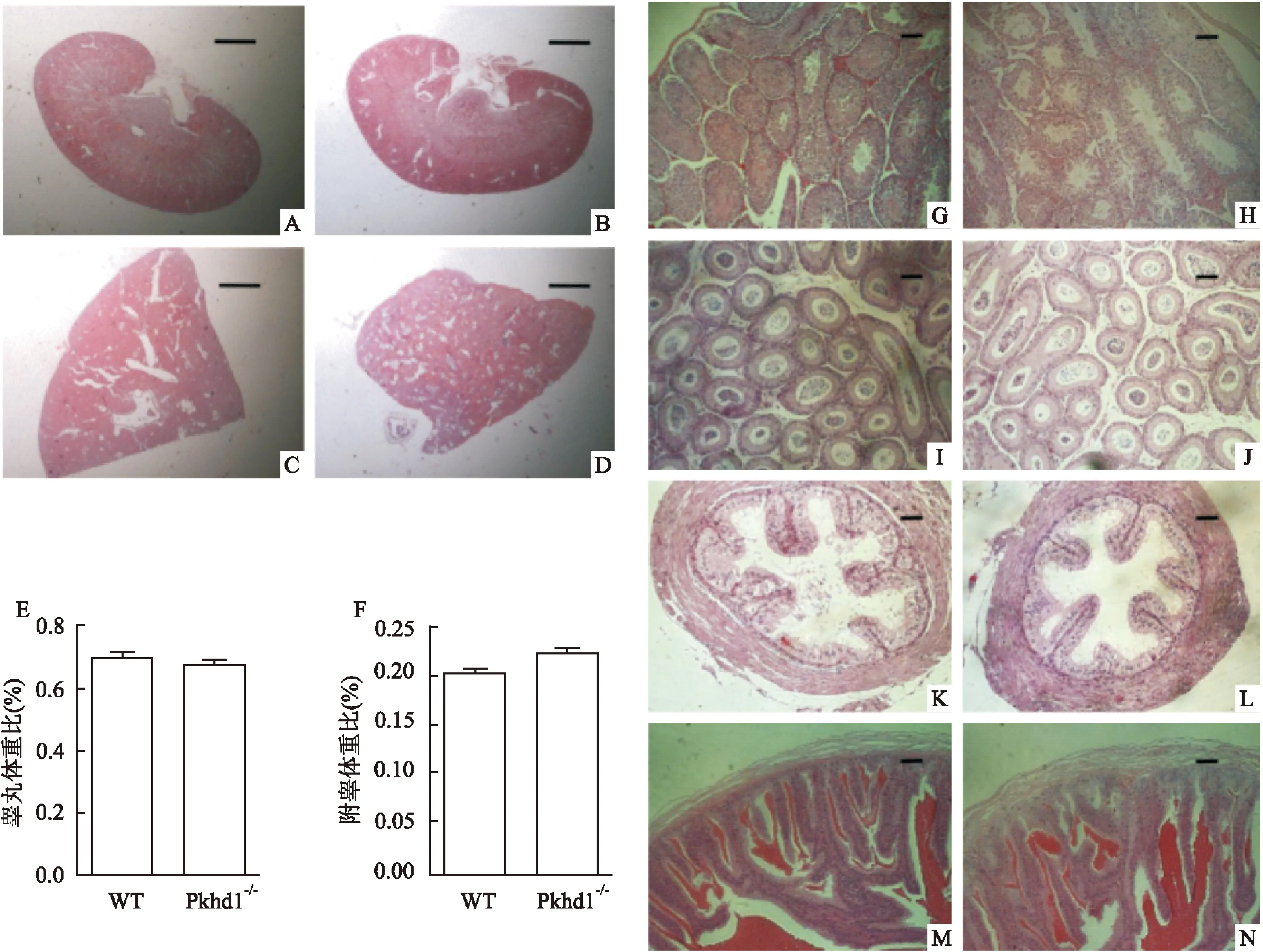
图1 WT和Pkhd1-/-小鼠的肾脏、肝脏和生殖系统的形态学分析
A:WT肾脏组织切片;B:Pkhd1-/-肾脏组织切片;C:WT肝脏组织切片;D:Pkhd1-/-肝脏组织切片;E:睾丸相对体重比;F:附睾相对体重比;G:WT睾丸;I:WT附睾;K:WT输精管;M:WT精囊;H:Pkhd1-/-睾丸;J:Pkhd1-/-附睾;L:Pkhd1-/-输精管;N:Pkhd1-/-精囊;A~D:×30;G~N:×100
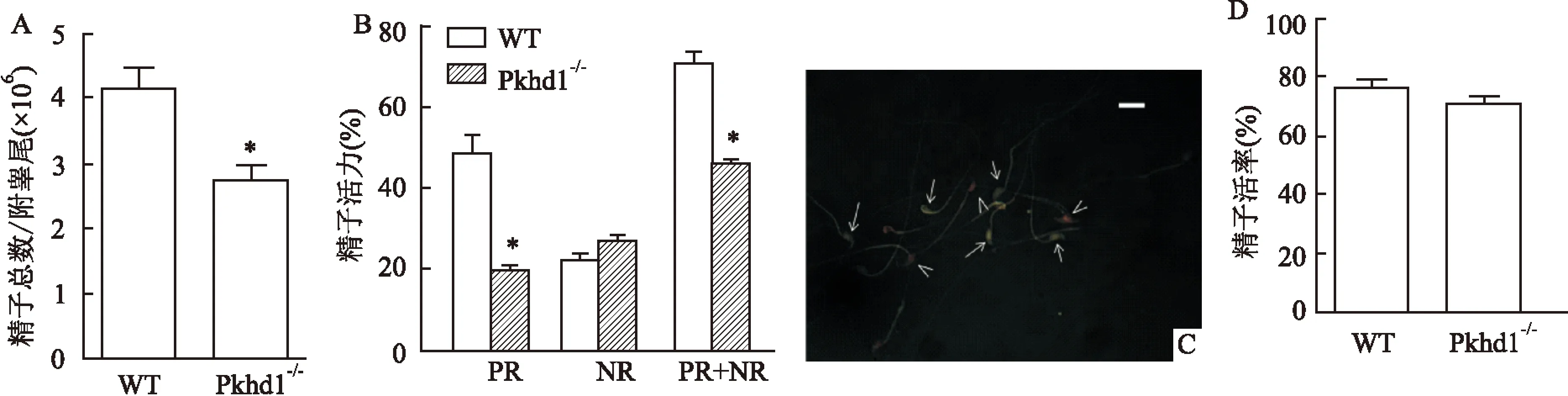
图2 Pkhd1基因缺失对精子浓度、活力和活率的影响 ×630
A:小鼠的精子数量;B:精子活力;C:Pkhd1-/-小鼠精子苯胺黑伊红染色,“↑”:活精子;“∧”:死精子;D:精子活率;与WT比较:*P<0.05
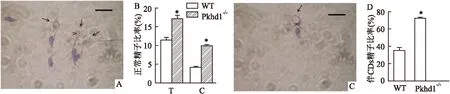
图3 Pkhd1-/-小鼠精子的形态特征
A、C:Pkhd1-/-小鼠精子巴氏染色×1 000;B:畸形精子比率;D:精子尾部伴CDs比率;T:总精子;C:尾部卷曲精子;“↑”:卷尾;“∧”:CDs;与WT比较:*P<0.05
3 讨论
随着越来越多的ARPKD患者达到生育年龄,其部分可能面临生育问题。另一方面,大量研究[3]表明男性ADPKD患者存在生育缺陷,文献中鲜有关于ARPKD患者生育力方面研究。本研究系统地对比研究了Pkhd1-/-和野生型小鼠生殖系统的大体形态、相对质量及组织学检查,结果并未发现异常。但是,Pkhd1基因选择性拼接模式复杂,并产生多种不同功能蛋白,且Ward et al[9]通过免疫组织化学研究发现FPC(PKHD1基因产物)在胚胎的睾丸和附睾中表达。这就进一步促使思考Pkhd1基因是否会对小鼠的生育能力产生影响。
基于以上研究结果及假设,对小鼠附睾尾精子进行了检测,结果显示Pkhd1-/-小鼠附睾尾精子浓度和活动力显著降低,精子的活率没有显著差距。见图3。精子的活力决定于其正常形态,尾部畸形的精子一般无活性或者运动障碍且无法使卵子受精。因此,对Pkhd1-/-和野生型两组小鼠进行了附睾尾精子的形态学检查。结果显示Pkhd1-/-小鼠精子尾部有更多的胞质滴(CDs),且其尾部趋于卷曲。见图4。在小鼠精子形成过程中,CDs来源于精子细胞的胞质中,主要附着在精子尾部的中间部分。Xu et al[10]研究发现CDs的异常可能对精子发生和精子活力产生影响。之前有研究[11]表明CDs被认为与渗透压的调节有关,因为当精子在低渗透性的情况下,附睾精子的鞭毛很容易盘绕在CDs的位置上,这可能是由CDs上附着的几个水通道蛋白的缺陷而导致的结果。在ARPKD中,尽管其囊肿形成、生长和扩张的病理生理学仍不清楚,但是有研究[12]表明,ARPKD患者的水通道AQP1的表达和功能异常,且与ARPKD患者的囊肿扩张有关。这提示在ARPKD小鼠中,异常的水通道可能是造成异常CDs的原因,而且CDs异常可以导致ARPKD小鼠精子尾畸形率上升,这些因素均可降低Pkhd1-/-小鼠的精子活力。
精子鞭毛结构和生物起源很复杂,最近的蛋白质组学分析显示了超过700种蛋白质与其相关。在小鼠的精子发生过程中,基因异常会导致不同的表型,包括精子尾部的卷曲。尾部鞭毛的基因丝由中心体变形组装而成,是精子尾部的重要组成部分。Zhang et al[13]研究报告显示FPC定位于细胞中心粒,并参与中心粒的复制,且破坏FPC可影响中心粒功能并导致细胞分裂缺陷。因此,Pkhd1基因缺陷可能影响原始生殖细胞的有丝分裂和精原细胞的减数分裂,导致小鼠精子浓度下降;Pkhd1基因的破坏也可能会影响鞭毛的基因丝结构,导致精子尾动力系统的功能紊乱,最终致使雄性小鼠精子活力下降。
需要注意的是,小鼠生育能力过强,所以并不是一个完美的反映人类生育力的动物模型。人类更容易受到不健康的生活方式和致病因素的影响,包括吸烟、环境污染、生殖道感染和遗传疾病等。有报道[14]表明诸如活性氧和辐射等累积性破坏在男性不育方面起着关键作用。此外,ARPKD小鼠模型与人类ARPKD严重症状相比,其临床表现有一些不同:多数Pkhd1-/-小鼠可以摆脱胚胎致死而存活到成年,并表现出较轻的临床症状[7]。本研究中,小鼠的生育力实验结果表明Pkhd1-/-小鼠的生育能力明显低于野生型小鼠。因此,推测Pkhd1基因缺失不仅会降低男性生育能力,更可能会造成部分患者不育。对于此类人群,必须指出的是,在青春期罹患终末期肾病的患者,即使通过肾移植手术治愈,但其精子发生并不能恢复,可能是因为青春期对睾丸发育及精子发生至关重要[15]。因此,在青少年ARPKD患者发展为尿毒症之前,可以采取一些预防措施,如精液冻存等。
综上,Pkhd1基因缺失可以使小鼠精子异常和相关参数下降,包括精子浓度减少、活力减弱、精子尾畸形率升高和CDs残留比例提高。生育力实验进一步验证了Pkhd1-/-小鼠生育能力明显降低。Pkhd1基因导致男性生育力下降的作用机制仍需进一步研究。且患有ARPKD的青少年可能面临生殖问题的风险,需要更多这方面的关注。

