甲状旁腺激素(1-34)联合鲑鱼降钙素对绝经后骨质疏松压缩性骨折患者骨密度、骨代谢的影响
夏 涛
西安市第一医院(西安710002)
主题词 骨质疏松/药物疗法 甲状旁腺激素肽/治疗应用 降钙素/治疗应用 骨密度
绝经后妇女是骨质疏松症高发人群,其由于雌激素分泌量下降,骨密度和骨矿物质含量降低,骨脆性增加,从而导致绝经后骨质疏松症(Postmenopausal osteoprosis,PMO)的发生[1]。由PMO导致的椎体压缩性骨折发生率较高,治疗后恢复较慢,常会导致患者呼吸功能下降、慢性腰背部剧烈疼痛等临床症状的发生,具有较高的复发率、致残率和致死率,对患者的生活质量产生较大影响[2]。通过药物治疗控制患者术后病情发展,促进成骨是目前治疗PMO压缩性骨折的有效方式[3]。甲状旁腺激素(1-34)[Parathyroid hormone 1-34,PTH(1-34)] 能够有效促进骨形成,提高骨质量,加快骨折的愈合速度,鲑鱼降钙素针剂能够限制骨吸收,促进骨细胞增生[4]。本文对120例患有PMO压缩性骨折的患者进行治疗,以期探索PTH(1-34)联合鲑鱼降钙素针剂对绝经后骨质疏松压缩性骨折患者骨密度、骨代谢的影响。
资料与方法
1 一般资料 选择2014年6月到2017年5月因PMO压缩性骨折进行治疗的患者120例,随机分为联合组和对照组。其中联合组患者60例,年龄48~75岁,平均年龄(68.41±7.32)岁,平均骨折数量(2.36±0.74)处,平均腰背痛时间(6.31±3.05)个月。对照组患者60例,年龄50~76岁,平均年龄(69.62±7.84)岁,平均骨折数量(2.28±0.63)处,平均腰背痛时间(6.54±2.94)个月。两组患者在一般资料如年龄、骨折程度和手术方式等方面,差异无统计学意义(P>0.05)。所选患者均符合WHO关于原发性骨质疏松症的诊断标准[5]。纳入标准:患者均经X线或MRI确诊为椎体压缩性骨折;患者均为自然绝经;绝经时间2年以上;患者腰背痛持续时间超过3个月;近1月内未服用过对骨代谢有影响的药物;近半年内未接受过抗骨质疏松药物治疗者;患者为原发性骨质疏松。排除标准:严重外伤史;严重脏器功能不全者;患有糖尿病等其他可能会导致骨质疏松的疾病;对本研究所用药物过敏者;不同意或不能全程参与本研究者。
2 治疗方法 患者术后进行常规的康复治疗,同时口服碳酸钙D3片(国药准字:H10950029),1片/d。 对照组在常规治疗的基础上使用鲑鱼降钙素注射液(注册证号:H20150152)进行肌肉注射,第1天50 IU,从第2天起100 IU/d,治疗20 d,随后休息20 d后,重复上述过程,总治疗时间6个月。联合组在对照组的基础上使用PTH(1-34)(注册证号 H20078031),20 μg/d,在大腿或者腹部患者自行注射,治疗6个月。
3 观察指标 ①骨密度:采用X线骨密度仪(深圳市艾克瑞电气有限公司)测定治疗前、治疗3个月和治疗6个月时患者的骨密度变化,选取患者腰椎(L1-4)、大转子和股骨颈部位的骨密度进行测量。②骨代谢:治疗前、治疗3个月和治疗6个月时,抽取患者空腹状态下静脉血5 ml,离心后取上清液,放射性免疫法测定骨钙素(BGP)和β-胶原降解产物(β-CrossLaps)的含量变化,ELISA法测定I型胶原羧基末端交联肽(CTX-1)、骨碱性磷酸酶(BALP)的含量。
4 疗效评价 使用视觉模拟疼痛评分表(VAS)评价治疗前、治疗3个月和治疗6个月时患者的疼痛程度,分值范围0~10分,分数越高,表示疼痛越剧烈;使用Oswestry功能障碍指数评分表(ODI)评价治疗前、治疗3个月和治疗6个月时患者腰痛、生活、睡眠质量、社交、外出、行走等10个方面的功能,每项分数范围0~5分,分数越高,表示功能障碍越严重。
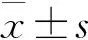
结 果
1 两组患者治疗前后骨密度变化 见表1。治疗前两组患者腰椎(L1-4)、大转子和股骨颈部位的骨密度没有统计学差异(P>0.05);治疗3个月后,腰椎(L1-4)部位的骨密度显著高于治疗前(P<0.05),大转子和股骨颈部位的骨密度与治疗前相比,没有统计学差异(P>0.05);治疗6个月后,联合组与对照组腰椎(L1-4)和大转子的骨密度显著高于治疗前(P<0.05),股骨颈的骨密度没有统计学差异(P>0.05);与联合组相比,治疗6个月后,对照组腰椎和大转子的骨密度显著较低(P<0.05),股骨颈的骨密度没有统计学差异(P>0.05)。

表1 两组患者治疗前后骨密度变化(g/cm3)
注:与治疗前相比,*P<0.05;与治疗3个月相比,#P<0.05;与同时间联合组相比,△P<0.05
2 两组患者治疗前后骨代谢指标变化 见表2。治疗前两组患者BGP、β-CrossLaps、BALP和CTX-1没有统计学差异(P>0.05);治疗3个月后,联合组BGP、BALP和CTX-1显著高于治疗前(P<0.05),与治疗前相比,β-CrossLaps的变化没有统计学差异(P>0.05),对照组BGP和BALP显著高于治疗前(P<0.05),与治疗前相比,β-CrossLaps和CTX-1的变化没有统计学差异(P>0.05);治疗6个月后,联合组与对照组BGP和BALP显著高于治疗前(P<0.05),β-CrossLaps和CTX-1显著低于治疗前(P<0.05);与联合组相比,治疗6个月后,对照组BGP和BALP的变化显著较低(P<0.05),β-CrossLaps和CTX-1的变化显著高于联合组(P<0.05)。

表2 两组患者治疗前后骨代谢指标变化
注:与治疗前相比,*P<0.05;与治疗3个月相比,#P<0.05;与同时间联合组相比,△P<0.05
3 两组患者治疗前后的VAS和ODI评分变化 见表3。治疗前,两组患者的VAS和ODI评分没有统计学差异(P>0.05);随着治疗时间的增长,两组患者的VAS和ODI评分显著降低(P<0.05);治疗3个月和6个月时,与联合组相比,对照组的VAS和ODI评分显著较高(P<0.05)。
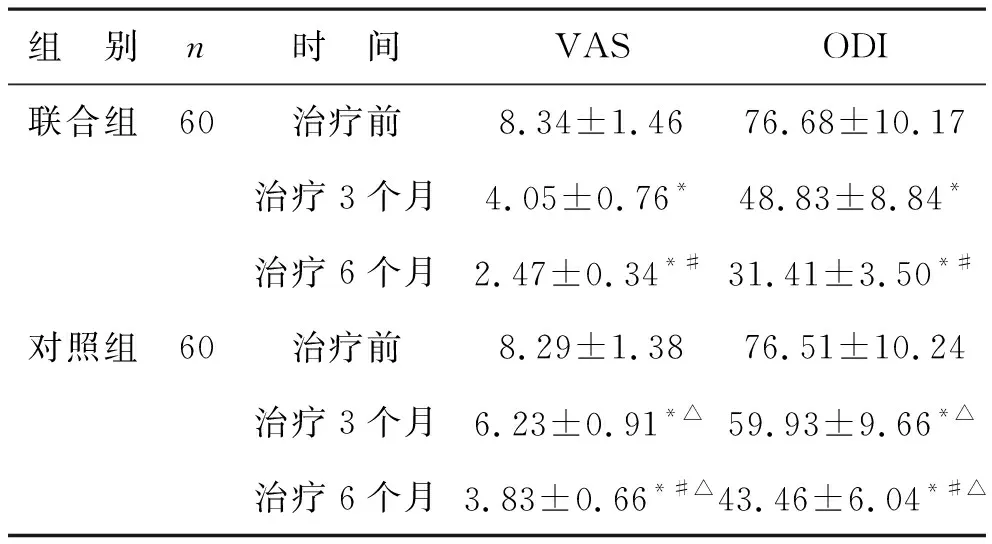
表3 两组患者治疗前后的VAS和ODI评分(分)
注:与治疗前相比,*P<0.05;与治疗3个月相比,#P<0.05;与同时间联合组相比,△P<0.05
讨 论
压缩性骨折是PMO的常见并发症,绝经后妇女由于雌激素水平降低,年龄偏高,成骨细胞数量降低,且由于肠胃功能和咀嚼功能的减弱,体内钙的吸收利用减少,使体内骨吸收大于骨形成,骨强度降低,因此轻加外力即有可能造成椎体压缩性骨折的发生[5-7]。本研究结果表明,PKP和PVP术后PTH(1-34)和鲑鱼降钙素针剂联合使用能够显著增加患者腰椎(L1-4)和大转子处的骨密度,这可能是与PTH(1-34)能够提高肾脏和小肠对Ca2+的重吸收能力,促进破骨细胞活性和骨重建,从而增加骨密度和骨量,防止骨折的复发有关[8-9]。
PMO的发生与骨代谢指标水平的变化密切相关。血清BGP是由骨骼中的成骨细胞分泌生成的蛋白质,其变化与骨代谢密切相关,当骨代谢失去平衡时,BGP含量波动明显,为检测骨代谢的特异性指标,有研究表明,血清BGP含量的变化可能与血糖含量变化有一定的关系[10-11]。研究发现,β-CrossLaps为人体内Ⅳ型胶原纤维代谢后所产生,在PMO发展的过程中,β-CrossLaps有明显升高,这与其可能参与到体内磷酸盐的沉积,增加骨丢失速度,从而使骨脆性增加,骨密度降低有关[12]。BALP是描述骨形成的重要指标,当骨形成增加时,BALP含量显著升高[13]。CTX-1可以反应骨骼中I性胶原的变化,在骨骼不断重建的过程中,I型胶原不断降解,部分进入血清,因此可以通过测定CTX-1的变化判断骨吸收的情况,从而预测骨质疏松再次发生的可能性[14]。本研究结果表明,经过PTH(1-34)和鲑鱼降钙素针剂的联合使用,BGP、β-CrossLaps、BALP和CTX-1均发生显著变化,其中BGP和BALP的变化显著升高(P<0.05),β-CrossLaps和CTX-1的变化显著降低(P<0.05),这表明在治疗过程中,骨形成逐渐大于骨吸收,患者的骨质疏松症明显好转,联合的变化更大(P<0.05)。
本研究表明,经过6个月的治疗后,两组患者的VAS评分和ODI评分显著改善,其中联合组的变化更大,这可能与PTH(1-34)能够促进患处骨痂的形成,缓解背部疼痛程度,从而提高生活质量有关。
综上所述,PTH(1-34)和鲑鱼降钙素针剂联合使用能够显著增加患者骨密度,提高骨代谢中BGP和BALP含量,降低β-CrossLaps和CTX-1含量,改善患者的疼痛程度及生活质量。

