新型疫苗佐剂Ov-ASP-1佐剂活性功能区的设计、表达及生物学特性研究
, , , ,
Ov-ASP-1是盘尾丝虫L3时期分泌的一种重要蛋白,研究发现Ov-ASP-1不仅自身能有效诱导机体内的体液免疫和细胞免疫应答,还能增强多种抗原或疫苗的免疫原性[1-4]。但至今Ov-ASP-1的佐剂活性功能区仍然未知。因此前期我们对Ov-ASP-1全长序列进行分析,设计并合成了9个肽用于佐剂活性功能区的探索。根据前期制备的Ov-ASP-1单克隆抗体和9个肽的结合情况,我们发现了Ov-ASP-1上的B细胞优势表位及Th表位所在的氨基酸序列。并以晶体空间结构相似的同家族蛋白Na-ASP-2为模型[5],设计了Ov- ASP-1佐剂活性功能片段ASPPRM,它包含完整 PR-1核心结构域[6-7]和优势Th表位,同时去除B细胞优势表位。
本研究根据前期Ov-ASP-1单克隆抗体的研究结果[8],设计并优化表达了Ov- ASP-1的功能区 ASPPRM重组蛋白,并通过免疫小鼠进行生物学特性分析。因此本研究为进一步研究ASPPRM在体内的免疫增效作用及Ov-ASP-1佐剂活性功能区研究奠定基础。
1 材料与方法
1.1材料 克隆载体PMD18T为TaKaRa公司产品;表达载体 pQE30为QIAGEN公司产品。限制性内切酶购自 NEB公司,质粒提取试剂盒及感受态 DH5α为北京全式金生物科技公司产品。卡那霉素、羧苄青霉素为中国药品生物制品检定所产品, IPTG购自金科宏达公司, Ni-charged resin及内毒素鲎试剂检测试剂盒购自金斯瑞公司,去内毒素凝胶(Detoxi-Gel Endotoxin Removing Gel)购自 Thermo公司, PEG-6000购自 Roche公司,蛋白 Marker、蛋白定量试剂盒购自天根公司,鼠抗 His抗体、 HRP-山羊抗小鼠 IgG抗体购自北京中杉金桥公司, ELISA显色液 A、 B及终止液购自北京万泰生物制药公司,超敏发光液购自北京 MILLIPORE公司, PVDF膜购自 MILLIPORE公司,透析袋 MD34为北京瑞达恒辉公司产品,酶联免疫检测仪(ELx808)购自 BioTek公司。感受态细胞 M15为本室保存。
1.2 方法
1.2.1Ov-ASP-1功能区ASPPRM的设计 根据前期Ov-ASP-1单克隆抗体的研究结果[8],在保留Ov- ASP-1佐剂活性功能区的前提下,尽量去除 B细胞优势表位,使自身抗体反应减弱,因此从全长Ov-ASP-1氨基酸序列上去掉前端 P2(21-35 aa)所在氨基酸序列。又保留了能引起较强细胞免疫反应的P14(175-190 aa)所在氨基酸序列,设计了包含155个氨基酸残基的Ov-ASP-1的功能域,命名为ASPPRM。根据原核表达的密码子偏性特征,对APPRM进行密码子优化处理并在其基因两端插入BamH I和HindIII两个酶切位点,送南京金斯瑞公司全基因合成。
1.2.2重组表达质粒pQE30/ASPPRM的构建 将全基因合成的 ASPPRM连接至 PMD18 T,用BamHⅠ、HindⅢ双酶切并回收 ASPPRM基因,连接至 pQE30上构建重组质粒 pQE30/ ASPPR,转化入感受态细胞 M15,培养得到 pQE30/ M15/ ASPPRM。
1.2.3重组蛋白ASPPRM的诱导表达及表达特性分析 将复苏鉴定正确的pQE30/ASPPRM甘油菌以1∶100的比例接种于含Amp 、Kan 的双抗LB培养基中,37 ℃震荡、 200 r/min培养2.5 h。然后在诱导的菌液中加入IPTG 至终浓度为1 mmol/L,继续诱导4 h,取菌液进行SDS-PAGE分析,同时设未诱导(即不加 IPTG)为对照组。同时将收集的菌液进行Western Blot检测确定pQE30/ASPPRM是否正确表达目的蛋白。
1.2.4重组蛋白ASPPRM的大量表达及纯化 ASPPRM重组蛋白表达纯化的步骤参照文献[2]并结合Ov-ASP-1的纯化复性方法进行。即大量诱导表达后,将收集的新鲜菌液用超声裂解(条件为冰浴条件下功率200 W,超声2 s,间歇2 s,共裂解30 min)。12 000 r/min离心10 min后得到粗制包涵体,再用包涵体洗液Ⅰ(0.5 TritonX-100,10 mmol/ L EDTA)、Ⅱ(10 TritonX-100,10 mmol/ L EDTA)、Ⅲ(10 mmol/ LEDTA,2 mol/ L尿素)依次重悬洗涤,最后将包涵体沉淀用8 mol/ L尿素重悬处理达到包涵体变性的目的,4 ℃过夜。次日4 ℃ 12 000 r/min,离心40 min。后用0.45 μm滤器过滤后上柱。依据Ni柱说明书,分别用从浓度到低浓度的咪唑进行洗脱,收集各梯度洗脱液进行SDS-PAGE分析。
1.2.5重组蛋白ASPPRM的复性及内毒素检测 根据SDS-PAGE结果将纯度较高的洗脱液置于透析袋中,利用梯度复性法,即从6 mol/L—4 mol/L—laemmili(25 mmol/ L Tris,192 mmol/ L 甘氨酸,0.1% SDS,pH=8.3)—PBS在4 ℃进行透析复性。复性结束收集蛋白用Balford法测定蛋白浓度,参照天根公司考马斯亮蓝蛋白定量试剂盒说明书。最后根据鲎试剂说明书对ASPPRM蛋白进行内毒素检测,去内毒素后分装保存于-70 ℃备用。
1.2.6重组蛋白ASPPRM的生物活性分析 将BALB/c 雌性小鼠随机分组,每组6只,共4组,分组依次为ASPPRM+OVA、Ov-ASP-1+OVA组、OVA及PBS对照。蛋白抗原OVA: 10 μg/只,ASPPRM蛋白及Ov-ASP-1蛋白(均25 μg/只/次)溶于PBS中使用。每只小鼠免疫200 μL。免疫途径采用肌肉注射免疫。间隔3周免疫1次,共免疫2次。免疫后2周小鼠尾静脉采血并分离血清用于ASPPRM特异性IgG抗体效价的ELISA检测。以OVA为抗原进行包被4 ℃过夜,包被浓度为1 μg/mL,以待检小鼠血清为一抗37 ℃孵育 1 h,以羊抗鼠的IgG-HRP按1∶5000稀释作为二抗37 ℃孵育 1 h,酶标仪检测D450值>2倍对照组D450平均值即判断为阳性。
1.3统计学处理方法 本研究数据统计学分析用SPSS17.0版本进方差分析,P<0.05为差异有统计学意义。作图用GraphPad软件5.01版本。
2 结 果
2.1重组表达质粒pQE30 /ASPPRM的构建及酶切鉴定 根据前期Ov-ASP-1单克隆抗体的研究结果[8],去掉B细胞优势表位所在的氨基酸序列P2(21-35 aa),并保留了能引起较强细胞免疫应的P14(175-190 aa),在此基础上进行密码子优化,设计了包含155个氨基酸残基的Ov-ASP-1功能片段ASPPRM。全基因合成后连接至原核表达载体,获得重组表达质粒pQE30 /ASPPRM。如图1所示,用BamH I单酶切重组质粒后,得到大于3.4 kb的单一条带(图1,第4条泳道)。经BamH I和HindIII双酶切后,得到与载体pQE30(3.4 kb)和ASPPRM基因(465 bp)大小相符的两条带(图1,第3条泳道)。为进一步验证送公司测序,序列完全正确。以上结果证实重组表达质粒pQE30/M15/ASPPR构建成功。

注:M:Trans2K Plus DNA Marker;1: BamH I和Hind III双酶切空载体pQE30;2:ASPPRM经PCR扩增产物;3:BamH I和Hind III双酶切重组质粒pQE30 /ASPPRM;4:BamH I酶切pQE30 /ASPPRM;5:重组质粒pQE30 /ASPPRM图1 重组质粒pQE30/ASPPRM 酶切鉴定Fig.1 Identification of recombinant plasmid pQE30/ASPPRM enzyme digestion
2.2ASPPRM的诱导表达及Western Blot鉴定 经SDS-PAGE检测结果显示(图2A),ASPPRM连接于pQE30载体后,经IPTG 1 mmol/L,220 r/min,37 ℃诱导4 h能在M15大肠杆菌中成功诱导表达,在原核表达系统中ASPPR蛋白大小约为17 kD,而未加诱导剂的菌液则无法产生目的蛋白。为检测是否正确表达目的蛋白,进一步应用山羊抗小鼠His抗体作为一抗对 ASPPRM进行Western Blot鉴定,结果表明我们成功获得了Ov-ASP-1的功能片段的重组蛋白ASPPRM(图2B)。
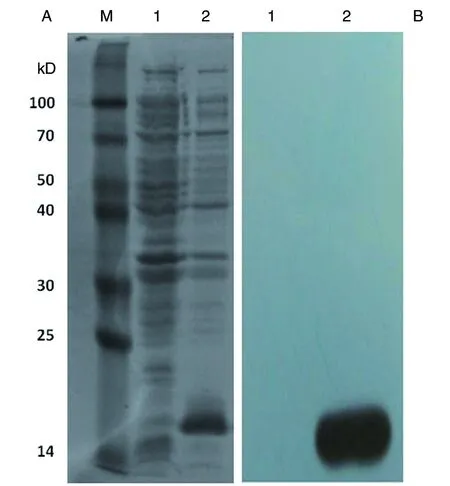
注:M:protein ruler I (14-100 kD);1:未诱导;2:诱导图2 ASPPRM重组蛋白小量诱导表达后的SDS-PAGE(A)及Western Blot鉴定(B)Fig.2 Identification of expression of the recombinant protein ASPPRM by SDS-PAGE and Western blot
2.3ASPPRM蛋白的纯化及复性 由于前期设计的功能片段ASPPRM上带有His标签,因此利用镍离子柱亲和层析的方法进行纯化。如图3所示,超声上清中几乎没有目的蛋白,而8 mol/L脲溶解液中有大量目的蛋白,因此ASPPRM蛋白主要以包涵体形式表达。从低浓度的咪唑(20 mmol/L,50 mmol/L)洗涤缓冲液洗涤开始,即可洗脱下来较高纯度的ASPPRM蛋白及少量杂蛋白,而高浓度的咪唑(100 mmol/L、200 mmol/L)洗脱液中同样有目的蛋白,且纯度达到90%以上。在30 kD左右位置也可见微量的二聚体形式的目的蛋白。因此收集50 mmol/L、100 mmol/L及200 mmol/L咪唑洗脱缓冲液洗脱下来的蛋白均可用于进一步复性。

注:M:protein ruler I (14-100 kd);1:未诱导;2:诱导; 3:超声上清;4:8 mol/L脲溶解液; 5:包涵体沉淀; 6:蛋白穿柱液; 7:20 mmol/L咪唑洗涤缓冲液; 8:50 mmol/L咪唑洗涤缓冲液; 9:100 mmol/L咪唑洗脱缓冲液; 10:200 mmol/L咪唑洗脱缓冲液图3 ASPPRM在大肠杆菌中表达及纯化Fig.3 Expression and purification of the recombinant protein ASPPRM
2.4ASPPRM蛋白的Western Blot鉴定 为了验证本研究中表达纯化的ASPPRM就是本研究期望得到的蛋白,我们以山羊抗小鼠His抗体作为一抗,对ASPPRM和Ov-ASP-1进行Western Blot鉴定。结果如图4B所示,山羊抗小鼠His抗体能与ASPPRM、Ov-ASP-1产生特异性的结合,且条带位置和SDS-PAGE(图4A)上一致。因此以上结果充分说明了ASPPRM就是我们需要的Ov-ASP-1的功能片段蛋白。
2.5ASPPRM的生物学活性分析 经鲎试剂检测,样品内毒素含量小于 0.025 EU/mL,符合免疫小鼠的安全使用标准。OVA由于在无佐剂情况下无法诱导免疫应答,常作为模式抗原应用于佐剂活
性的研究。因此我们以OVA作为模式抗原来初步评价ASPPRM是否具有佐剂活性。由图5可知,二免后2周间接ELISA检测结果显示,ASP-PRM+OVA组产生的IgG抗体高于OVA不加佐剂组的IgG抗体(图5B),差异有统计学意义(P<0.05),而与Ov-ASP-1组差异没有统计学意义(P> 0.05),而免疫前四组小鼠血清中均无抗体(图5A)。这说明ASPPRM具有增强OVA免疫原性的作用,显示其可能具有佐剂活性。

注:M:protein ruler I (14-100 kD)图4 重组蛋白Ov-ASP-1和ASPPRM复性后的SDS-PAGE(A)及Western Blot鉴定(B)Fig.4 Identification of the recombinant protein ASP-1 and ASPPRM after renaturing by SDS-PAGE and Western blot

图5 免疫前(A)及二免后2周(B)小鼠血清中抗OVA抗体IgG检测Fig.5 Anti-OVA IgG antibody titer in BALB/c immunized with ASPPRM and OVA
接着,我们进一步分析ASPPRM诱导的IgG抗体亚类的产生情况。间接ELISA检测IgG1抗体发现,ASPPRM组产生的IgG1抗体高于不加佐剂组及PBS组,差异有统计学意义(P<0.05),而与Ov-ASP-1组比较,没有统计学差异(P>0.05)(图6B)。检测IgG2a的结果发现,ASPPRM组产生的IgG2a与Ov-ASP-1相当,但高于不加佐剂组及PBS组(图6C)。
综上所述,ASPPRM不但具有免疫增效作用,而且其诱导的免疫反应具有Th1型偏倚的特点。因此我们设计并表达的重组蛋白ASPPRM保留了Ov-ASP-1的佐剂活性,可进一步以多种模式抗原系统性分析ASPPRM的佐剂活性。

A:抗OVA特异性IgG;B:抗OVA亚类IgG1;C:抗OVA亚类IgG2a图6 二免后2周小鼠血清中抗OVA抗体IgG及亚类检测Fig.6 Anti-OVA antibody in BALB/c immunized with ASPPRM and OVA
3 讨 论
目前国内外的研究发现蠕虫来源的免疫调节剂在疾病的新型疗法上有不可估量的应用价值,例如一种源于绦虫囊尾蚴设计合成,分子量为19个氨基酸的肽(GK-1),研究发现其具有佐剂活性。研究人员将其和灭活的流感疫苗共同免疫小鼠,发现小鼠体内针对抗流感病毒的抗体增加,且具有减少局部炎症反应并提高机体清除病毒的能力[9]。再如,有研究者发现在炎症中常见的热休克蛋白(HSP),在机体中可参与抗原提呈、T细胞活化等免疫应答的一系列过程,也具有独特的佐剂活性[10]。然而这两种蠕虫来源的新型免疫调节剂的特点是优先诱导Th2型体液免疫应答,但几乎无法诱导细胞免疫反应。众所周知,细胞免疫是针对细胞内的病原体,尤其是机体对抗病毒所不可或缺的免疫应答方式。因此如今迫切需要一种安全无毒又能有效诱导细胞免疫应答的新型佐剂来应对各种传染病,尤其是以病毒为病原体的传染病。
许多寄生虫体内都存在ASP蛋白,例如犬钩虫,十二指肠钩虫,美洲钩虫,盘尾丝虫,马来丝虫,捻转血矛线虫等[11]。而Ov-ASP-1是盘尾丝虫L3时期分泌的一种重要蛋白[12],研究人员发现Ov-ASP-1单独免疫小鼠时,就可以诱导机体产生高滴度的IgG1、IgG2a。因此推测其在宿主体内具有免疫调节功能,具有佐剂的潜在价值。于是进一步将Ov-ASP-1以佐剂的形式和多种形式抗原如蛋白抗原、多肽抗原或灭活疫苗分别免疫小鼠,发现其均能增强这些抗原的免疫原性,而且从产生的抗体类型看能同时诱导机体产生Th1/Th2型体液免疫和细胞免疫应答,甚至具有Th1型优势[13-15]。但至今Ov-ASP-1的佐剂活性功能区仍然未知。在本研究中,我们发现ASPPRM有可能是Ov-ASP-1的功能区,因为它具有潜在的佐剂活性,而且在PBS中比Ov-ASP-1稳定性更好,易于保存。
Ov-ASP-1与Na-ASP-2同属CAP(cysteine-rich secretory proteins (CRISPS), antigen 5 (Ag5), and pathogenesis-related 1 (Pr-1))蛋白超家族[6],采用在线SWISS-MODEL软件对Ov-ASP-1 和Na-ASP-2蛋白(蛋白质数据库:1U53)作同源性分析,尽管同源性为35%,但二者空间结构十分相似[5]。由于Na-ASP-2的晶体结构已成功解析,分析发现其具有CAP超蛋白家族中特征性的PR-1核心结构域。因此我们试图对照Na-ASP-2的结构特征来预测分析Ov-ASP-1的空间结构,并寻找ASP-1可能的佐剂活性功能区。
前期我们对Ov-ASP-1全长序列进行分析,设计并合成了9个肽用于佐剂活性功能区的探索。根据ASP-1单克隆抗体的研究结果[8],我们发现9个肽中P2(21-35 aa)和P7(96-111 aa) 能与Ov-ASP-1的单克隆抗体血清发生特异性结合。因此,我们推测P2和P7是B细胞优势表位,所诱导的自身免疫原性较强。为了保持中间结构的完整性,我们保留了P7但去除了P2所在的氨基酸序列。同时通过ELISPOT检测结果发现只有P14(175-190 aa)能刺激T细胞分泌IFN-γ。由于在介导胞内病毒杀伤作用中,Th1型细胞免疫应答起到非常重要的作用。因此,我们推测保留了P14这个Th表位的ASPPRM具有引起较强Th1型细胞免疫反应的优势,有利于病毒的清除。进一步的实验也证实了这一推测,ASPPRM组小鼠体内产生的IgG2a抗体高于不加佐剂组,具有Th1型偏倚的特点。综合以上结果,我们设计了一个Ov-ASP-1的功能片段,命名为ASPPRM(35-189 aa),它既保留了完整的PR-1保守区域和末端Th1型表位所在氨基酸序列,又去掉了前端B细胞优势表位所在氨基酸序列。研究结果显示,我们设计的ASPPRM在原核系统中成功表达,重组蛋白大小在17kd左右,而且在PBS中它比Ov-ASP-1稳定性更好,易于保存。通过WB鉴定发现,重组蛋白ASPPRM就是我们想要获得的蛋白。
综上所述,我们成功制备了具有生物活性的ASPPRM蛋白,为系统研究Ov-ASP-1佐剂活性结构域的功能奠定了基础,同时也为系统研究 ASPPRM 的免疫增效作用和对不同抗原(蛋白、多肽等)的免疫增强作用奠定了基础。
——一道江苏高考题的奥秘解读和拓展

