柯萨奇病毒A组16型VP1蛋白的原核表达及纯化
潘朋歌,李克生,杜惠芬,曾潮宁
(1.宁夏医科大学生育力保持教育部重点实验室/宁夏回族自治区生殖与遗传重点实验室,宁夏银川 750004;2.甘肃省医学科学研究院医学生物技术研究中心,甘肃兰州730050;3.兰州雅华生物技术有限公司,甘肃兰州 730050)
柯萨奇病毒(coxsackie virus,CV)属于小核糖核酸病毒科,肠道病毒属,可导致多种人类疾病,如呼吸道感染、手足口病、结膜炎、疱疹性咽颊炎、发热性皮疹、心肌炎、急性弛缓性麻痹及脑炎等[1-2]。柯萨奇病毒被分为A、B两组,其中 A组16型(CVA16)作为引起儿童手足口病的主要肠道病毒之一而备受关注[3]。
CVA16为无包膜的单股正链RNA病毒,基因组只含有1个开放读码框,编码产生一个相对较长的多聚蛋白前体,经蛋白酶水解形成P1、P2、P3这3个功能区,其中P1区编码病毒的结构蛋白VP1~VP4,构成病毒衣壳,而P2、P3区编码非结构蛋白[4]。当病毒感染宿主细胞时,VP1蛋白与细胞上的受体结合导致VP4释放,进而使得病毒基因组进入细胞。此外,CVA16的中和抗原决定簇大多位于VP1功能区,且VP1基因与肠道病毒血清型相对应,可作为CVA血清型或肠道病毒属内不同血清的分类依据[5-7]。虽然VP1蛋白被作为研究CVA16的主要目标而被广泛关注,但是目前对CVA16 VP1免疫性方面的研究仍然较少。该研究将CVA16VP1全基因克隆到原核表达载体pET30a,构建重组表达质粒pET30a-CVA16-VP1,原核表达并纯化 CVA16 VP1,以期为CVA16诊断试剂开发和疫苗研制奠定基础。
1 材料与方法
1.1材料
1.1.1菌株。大肠杆菌DH5α、BL21(DE3)感受态细胞、表达质粒pET30a由宁夏医科大学生育力保持教育部重点实验室保存;序列合成与测序由苏州金唯智生物科技有限公司完成。
1.1.2工具酶及主要试剂。限制性内切酶Hind Ⅲ/XhoI、T4DNA连接酶、质粒小提试剂盒、琼脂糖凝胶电泳回收试剂盒购自TaKaRa公司;DNA Marker、蛋白Marker购自Fermentas公司;卡那霉素、氨苄青霉素等为上海生物工程技术服务有限公司产品;猴抗 CVA16 血清购自 ATCC;HRP 标记的羊抗猴 IgG 购自 Sigma 公司;镍金属鳌合层析柱购自Pharmacia公司;其他试剂均为国产分析纯。
1.2方法
1.2.1重组质粒pET30a-CVA16-VP1的构建。根据GenBankCVA16VP1基因序列,对目的基因进行密码子优化,按照优化后的基因序列,人工合成CVA16VP1全基因,共891 bp,同时在CVA16VP1基因5’端引入Hind Ⅲ酶切位点,3′端删除终止密码子引入XhoⅠ酶切位点。合成的CVA16VP1基因和表达载体pET30a分别用Hind Ⅲ和XhoⅠ双酶切,酶切完全后回收目的载体和片段,按一定比例(1∶3~1∶5)混匀,加入等体积T4DNA连接酶,16 ℃过夜连接。采用热激法将上述连接液转化至新鲜制备的E.coliDH5α感受态细胞,在含有卡那霉素(100 μg/mL)的LB固体培养基上于37 ℃过夜培养。
1.2.2重组质粒pET30a-CVA16-VP1的鉴定。挑取平板上的单菌落于LB液体培养基(含有卡那霉素)中,37 ℃摇菌过夜,按照质粒小提试剂盒的操作说明提取质粒DNA。以该质粒DNA为模板,用pET30a的通用引物T7/T7 terminator进行PCR扩增,PCR条件为95 ℃ 10 min;95 ℃ 30 s,58 ℃ 90 s,72 ℃ 30 s,共30个循环;72 ℃ 10 min。将琼脂糖凝胶电泳鉴定大小正确的阳性质粒送测序,将测序结果与密码子优化后的VP1基因序列比对以确定插入序列的正确性。
1.2.3融合蛋白CVA16-VP1的诱导表达。将测序正确的重组质粒pET30a-CVA16-VP1转化到感受细胞E.coliBL21(DE3)中,转化细胞涂于含卡那霉素的LB培养基平皿中,37 ℃恒温箱中过夜培养。随机挑取阳性克隆到5 mL LB液体培养基(含卡那霉素)中,37 ℃、180 r/min过夜培养至OD600为0.5~1.0,次日按1∶50~1∶100的比例接种到300 mL含卡那霉素的LB液体培养基中,37 ℃、180 r/min培养至OD600为0.5~1.0,取出1 mL未诱导菌作为阴性对照,4 ℃暂存。加入IPTG至终浓度为1 mmol/L,37 ℃继续培养4 h,离心收集菌体。按0.1 g/mL向菌体沉淀中加入PBS缓冲液,充分混匀,-70 ℃反复冻融3~4次,冰浴超声破碎至溶液透明,4 ℃ 12 000 r/min离心15 min,收集上清。向沉淀中加入适量2 mol/L的尿素溶液(20 mmol/L Tris-HCl,pH 8.0;0.5 mol/L NaCl;2 mol/L尿素;2% Triton)重悬,室温静置30 min,12 000 r/min离心10 min,弃上清;重复上述步骤1次;最后加入包涵体溶解缓冲液(20 mmol/L Tris-HCl,pH 8.0;0.5 mol/L NaCl;8 mol/L尿素;0.2 mmol/L DTT;2% Triton)重悬,4 ℃充分溶解。分别将未诱导的菌液、诱导后的菌液、上清及尿素洗涤后的样品处理后进行SDS-PAGE分析。
1.2.4重组蛋白的结构复性及纯化。将8 mol/L尿素溶解后的样品,通过Sephacryl S-300凝胶层析进行结构复性,柱床规格20 mm×400 mm , 0.01 mmol/L 7.4 PBS、0.25 mL/min 流速洗脱,收集主蛋白峰;Ni-NTA亲和层析纯化,咪唑梯度洗脱,收集目的蛋白。pH 8.0 Sephacryl S-300凝胶柱脱盐,超滤离心,浓缩抗原。SDS-PAGE分析抗原纯度,紫外分光光度计测定蛋白浓度。
1.2.5纯化产物的Western Blot 鉴定。将纯化的重组CVA16 VP1 蛋白经 SDS-PAGE 分离后,电转移1 h至硝酸纤维素膜上,加入 5%脱脂奶粉,室温封闭 1 h;PBST缓冲液冲洗,加入1∶2 000 稀释的猴抗 CVA16 血清,室温孵育 1 h;PBST缓冲液冲洗,再加入 HRP 标记的羊抗猴 IgG(1∶2 000 稀释),室温孵育 1 h;PBST 缓冲液洗膜,最后加 TMB显色。
2 结果与分析
2.1重组质粒pET30a-CVA16-VP1的鉴定重组质粒pET30a-CVA16-VP1经pET30a通用引物T7/T7 terminator扩增,琼脂糖凝胶电泳检测可观察到一条约1.3 kb的条带,与理论值相符;进一步的测序结果显示,基因序列与密码子优化后的序列一致,说明重组质粒构建成功,结果如图1。

注:M.DL 2000 Marker;1,2.重组质粒的PCR鉴定产物Note:M.DL2000 DNA Marker;1,2.PCR identification of pET30a-CVA16-VP1图1 pET30a-CVA16-VP1重组质粒的鉴定Fig.1 The identification of recombinant plasmid pET30a-CVA16-VP1
2.2重组蛋白CVA16-VP1的诱导表达将重组表达质粒pET30a-CVA16-VP1转化到大肠杆菌表达菌株BL21(DE3) 中,1 mmol/L IPTG诱导后,成功表达出VP1蛋白,未经诱导的菌体未见表达,经SDS-PAGE电泳分析,其分子量大约为38.7 kDa,与预期值相符(图2:1~2)。目的蛋白在细胞中以包涵体的形式存在(包涵体经洗涤、溶解,8 mol/L尿素时可看到有大量目的蛋白析出)(图2:3~7)。
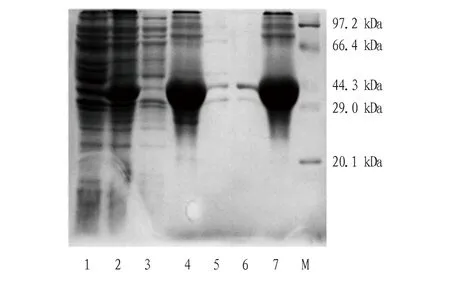
注:M.蛋白Marker;1.pET30a-CVA16-VP1转化菌未诱导;2.pET30a-CVA16-VP1转化菌经IPTG诱导;3.破碎后上清;4.破碎后沉淀;5. 2 mol/L尿素洗涤;6. 2 mol/L尿素二次洗涤;7. 8 mol/L尿素溶解包涵体Note:M.Protein Marker;1.pET30a-CVA16-VP1 tansformed E.coli,not induced;2.pET30a-CVA16-VP1 tansformed E.coli induced with IPTG;3.The supernatant after sonication;4.The precipitation after sonication;5. 2 mol/L Urea;6.Secondary 2 mol/L Urea;7. 8 mol/L Urea图2 重组蛋白CVA16-VP1在E.coli中表达的SDS-PAGE分析Fig.2 SDS-PAGE analysis of recombinant protein VP1 expressed in E.coli induced by IPTG
2.3重组蛋白的结构复性及纯化8 mol/L尿素溶解液经Sephacryl S-300凝胶层析进行结构复性和Ni-NTA亲和层析柱亲和层析纯化,获得了纯度约90%的目的蛋白,结果见图3。紫外分光光度法测蛋白浓度,蛋白浓度达2 mg/mL。

注:M.蛋白质Marker;1.纯化的CVA16-VP1重组抗原Note:M.Protein Marker; 1.Purified VP1 recombinant antigen图3 纯化的CVA16-VP1重组抗原SDS-PAGE 分析Fig.3 SDS-PAGE of purified VP1 recombinant antigen
2.4重组蛋白VP1的WesternBlot测定将纯化后的重组蛋白VP1与猴抗 CVA16 血清进行Western Blot分析,显色后在硝酸纤维膜上出现单一条带(图4),表明表达的重组蛋白即为VP1蛋白。

注:1.阴性对照;2.纯化的重组蛋白Note:1.Negative control;2.Purified VP1图4 纯化蛋白的Western Blot分析Fig.4 Western blotting of purified VP1
3 讨论
手足口病(hand foot and mouth disease,HFMD)是一种全球性的急性儿科传染病,主要由肠道病毒71型(EV71)和CVA16 引起[8]。EV71在HFMD的流行中一直占主要地位,部分急性患者可引发严重并发症甚至死亡[9];而CVA16的感染症状较为轻微[3],因此在过去的数十年EV71一直是研究的重点,CVA16常被忽略。目前EV71灭活疫苗已经成功上市[10],但这些疫苗对CVA16感染导致的手足口病是没有交叉保护作用的[11-12]。近些年又有研究发现,CVA16感染的患者在重症阶段同样可引发严重并发症甚至死亡[7],不同的是患者年龄更小,而且CVA16的感染往往反复,致使患儿持久不愈[13-14]。因此,目前对于CVA16的研究就显得尤为重要,而VP1 作为CVA6 主要外膜蛋白之一和抗原区的一部分,成为CVA6疫苗和临床诊断试剂研究良好的候选抗原。
该试验成功构建了重组表达质粒 pET30a -CVA16-VP1,并转入表达菌株E.coliBL21(DE3)中进行优化表达,经SDS-PAGE分析,证明VP1蛋白在大肠杆菌中成功表达并主要以包涵体形式存在,表达蛋白经复性、纯化,纯度达90%以上;Western Blot证实表达的重组蛋白即为VP1,为此抗原的临床诊断应用奠定了基础。

