11β-羟基类固醇脱氢酶诱发脂质蓄积的实验研究
胡蒙亮 高丰衣 任航江 韩亭亭 满 永 李国平 黎 健
随着经济的快速发展和现代生活方式与饮食习惯的改变,非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)已经成为影响发达国家三分之一成年人和越来越多儿童的重要代谢性疾病[1],在中国人群中NAFLD也已经成为重要的公共健康问题之一[2]。最近的研究表明,I型11β-羟基类固醇脱氢酶(11β-hydroxysteroid dehydrogenase type,11β-HSD1)与肝脏脂质代谢密切相关,在 NAFLD 的发生过程中发挥重要作用[3]。在成年哺乳动物中,11β-HSD1广泛分布于肝脏、脂肪、性腺和脑中,通过活化局部组织中的糖皮质激素水平在糖脂代谢中发挥重要作用[4],但对其在脂代谢作用方面的调控机制知之甚少。本研究通过肝脏过表达11β-HSD1,探究其对肝脏脂质代谢的影响及调控机制。

表1 检测基因的引物
注:SREBP1c:固醇调节元件结合蛋白1c;ACC1:乙酰辅酶A羧化酶;FAS:脂肪酸合成酶;SCD1:硬脂酰辅酶A去饱和酶
材料与方法
1.材料 实验动物品系为C57BL/6遗传背景雄性小鼠,12周龄,普通饮食,动物饲料购自北京华阜康生物科技股份有限公司;蛋白激酶B(AKT)抗体、糖原合酶激酶-3β(GSK)抗体、磷酸化蛋白激酶B(Phospho-AKT, Ser473)抗体、磷酸化糖原合酶激酶-3β(Phospho-GSK-3β, Ser9)抗体、脂肪酸合成酶(FAS)抗体、硬脂酰辅酶A去饱和酶(SCD1)、抗体乙酰辅酶A羧化酶(ACC1)抗体购自美国CST公司;11β-HSD1抗体购自美国R&D公司;HRP标记的山羊抗兔IgG相关抗原抗体、HRP标记的兔抗山羊IgG相关抗原抗体、β肌动蛋白(β-actin)抗体购自北京中杉金桥生物公司;固醇调节元件结合蛋白(SREBP1)抗体购自美国Santa Cruz公司;BCA蛋白浓度检测试剂盒购自美国Thermo公司。
1.方法 (1) 腺病毒的扩增与纯化 在293A细胞中扩增腺病毒Ad-GFP和Ad-11β-HSD1,用试剂盒(Vivapure Adeno PACK 100 kit, Vivascience)纯化,测定OD值,冻存于-80℃。小鼠尾静脉注射腺病毒Ad- GFP和Ad-11β-HSD1,剂量为每只小鼠5.0×1010病毒颗粒。
(2)动物模型的建立 取20只C57BL/6小鼠,适应性饲养2周后,随机数字表法分为两组,每组10只,其中对照组尾静脉注射腺病毒Ad-GFP,另一实验组尾静脉注射腺病毒Ad-11β-HSD1,注射后每天观察小鼠的生活状态。小鼠注射腺病毒后,耐受性良好,饮食正常。
(3)肝脏组织脂质含量的测定 腺病毒感染小鼠两周后,禁食4h后称量小鼠体质量,并进行眼眶后静脉丛采血,离心收集血浆。采血后进行麻醉处死,收集肝脏组织后称重,并冻于液氮备用。切取肝脏组织100mg左右,根据参考文献[5]进行肝脏脂质内容物提取,酶法测定TC和TG含量。
(4)肝脏组织冰冻切片油红O染色 取小块肝脏组织,OCT包埋,切为8~10μm厚冰冻切片并贴片于洁净载玻片。10%甲醛固定15min,PBS洗1min,60%异丙醇浸洗数秒,取出切片并完全干燥后油红O工作液室温染色30min,60%异丙醇分化数秒,PBS洗3次,苏木素复染核8s,流水冲洗返蓝,甘油封片后镜检,照相。
(5)脂代谢相关蛋白和胰岛素信号通路相关蛋白的免疫印迹法分析 冻存的组织标本采用RIPA蛋白质提取缓冲液提取总蛋白, BCA法测定蛋白浓度。每个样品取20μg总蛋白进行SDS-PAGE凝胶电泳,PVDF膜湿转3h,5%脱脂牛奶室温封闭1h,相应一抗于4℃摇床孵育过夜,TBST洗膜3次,每次10min。相应二抗室温孵育3h,洗膜3次,每次10min,用化学发光液显影,并用凝胶成像仪照相,采用Image J软件分析蛋白条带灰度值。
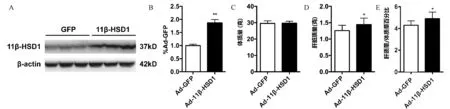
图1 肝脏过表达11β-HSD1小鼠表型A:小鼠肝脏组织11β-HSD1蛋白表达水平;B: Western blot条带灰度分析统计图;C:小鼠体质量统计图;D:小鼠肝脏质量统计图;E:小鼠肝质量/体质量百分比统计图。注:与对照组比较,n=10,*P<0.05,**P<0.01
(6)检测实时荧光定量PCR检测 用Trizol提取肝脏组织总RNA,测定浓度及RNA质量后,取5μg RNA反转录成cDNA第一链,将cDNA稀释20倍后进行目的基因的检测,总反应体系为20μL:2×SYBR Green PCR Mix 10μL,上下游引物各2.5μL,模板cDNA 5μL。反应完毕后分析产物溶解曲线判断反应的特异性并通过计算2-△△ct得到目的基因的相对表达量,引物设计见表1。
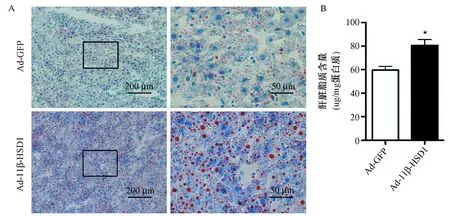
图2 肝脏组织脂质含量的检测 A:肝脏组织中脂质油红O染色结果;B:肝 脏组织中三酰甘油含量测定结果。注:与对照组比较,n=10,*P<0.05
结 果
1.尾静脉注射腺病毒Ad-11β-HSD1后,肝脏过表达该基因并使肝质量增大 本实验通过小鼠尾静脉注射腺病毒Ad-11β-HSD1,构建小鼠非酒精性脂肪肝模型来研究其调控机制。腺病毒感染2周后,实验组与对照组比较,小鼠肝脏成功过表达11β-HSD1[(1.000±0.053)vs.(1.869±0.125),P<0.01](图1A~B),但两组小鼠体质量差异无统计学意义,体质量分别为(29.56±1.58)g,(29.69±1.20)g(图1C)。过表达11β-HSD1后,实验组小鼠肝质量为(1.44±0.20)g,显著高于对照组的(1.26±0.16)g,(P<0.05,图1D)。并且实验组小鼠的肝质量/体质量百分比也显著高于对照组[(4.3±0.4)vs. (4.9±0.6),P<0.05],图1E。
2.肝脏过表达11β-HSD1后,引起肝脏脂质蓄积 酶法测定血浆脂质含量,结果显示两组小鼠血浆胆固醇和三酰甘油含量并无差异(数据未显示)。肝脏组织冰冻切片油红O染色结果显示,实验组小鼠肝脏过表达11β-HSD1后,肝脏脂质蓄积相对于对照组明显增多,脂滴变大且分布广泛(图2A)。酶法测定肝脏组织脂质含量,结果显示肝脏过表达11β-HSD1后,肝脏脂质含量相比对照组增加35.0%[(59.61±3.2)vs. (80.47±5.1),P<0.05],图2B。这一结果与油红O染色结果相一致,进一步证实肝脏过表达11β-HSD1后,可使肝脏脂质蓄积。
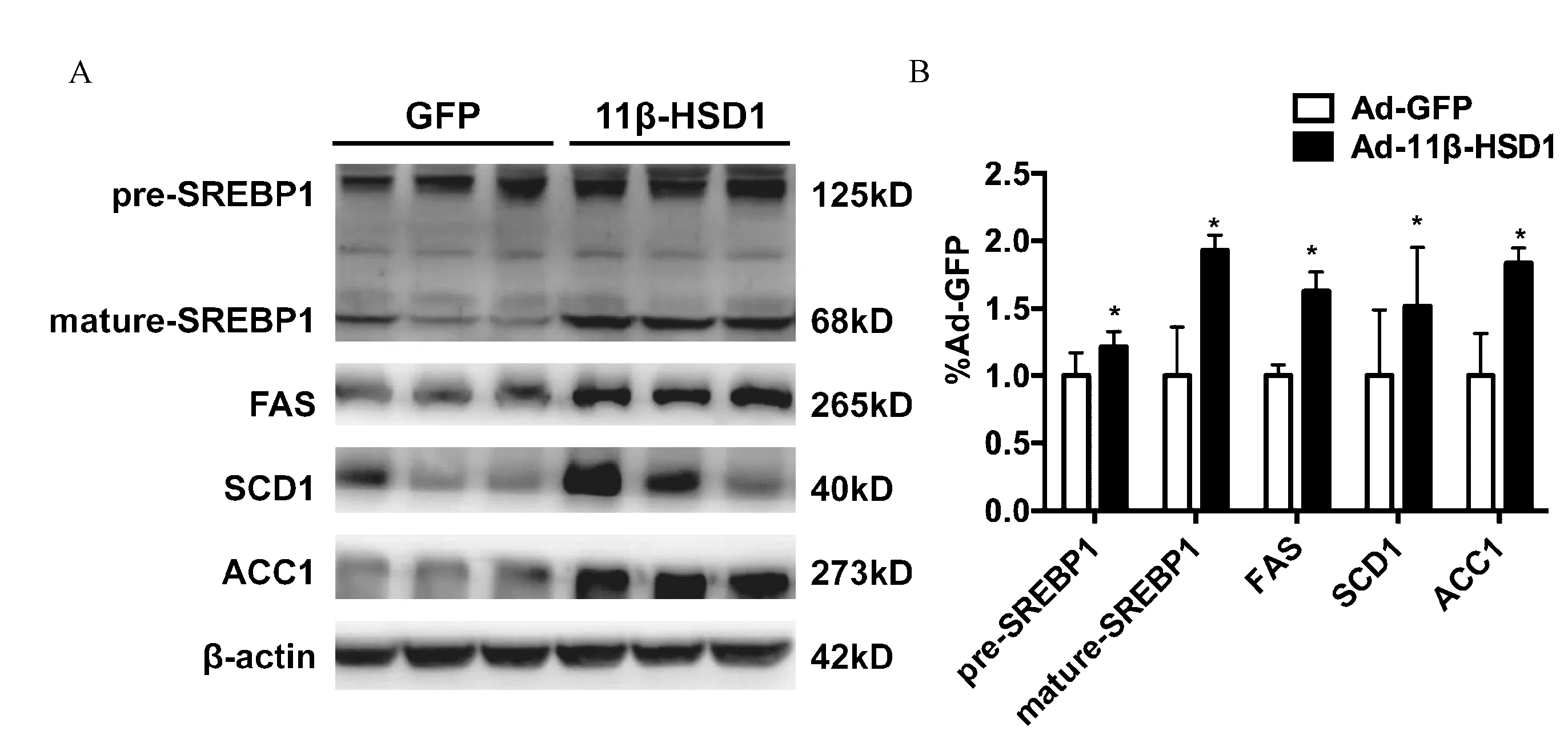
图3 肝脏过表达11β-HSD1后增加脂质合成相关蛋白 A. Western blot检测脂质合成相关蛋白水平; B. Western blot条带灰度分析统计图。注: n=10, *P<0.05
3.肝脏过表达11β-HSD1后,脂质合成相关蛋白表达显著增加 提取肝脏组织的总蛋白后,我们首先检测了长链脂肪酸合成途径中主要的调控蛋白SREBP1,结果如图3A~B显示,相对于对照组,过表达11β-HSD1后,SREBP1无论是前体还是成熟肽均显著增加,其下游调控蛋白FAS、SCD1也明显上调,脂肪酸合成通路重要蛋白ACC1表达显著升高,这些结果说明11β-HSD1过表达后,激活了脂质合成通路,这可能是导致肝脏脂质蓄积的原因之一。
4.肝脏过表达11β-HSD1后脂质合成相关基因含量变化 肝脏组织提取RNA,反转录为cDNA,通过实时荧光定量PCR仪检测脂质合成相关基因表达水平。结果显示肝脏过表达11β-HSD1后,小鼠肝脏组织脂质合成相关基因表达水平并没有显著改变(图4),说明脂质合成通路的激活可能发生在基因转录后水平。
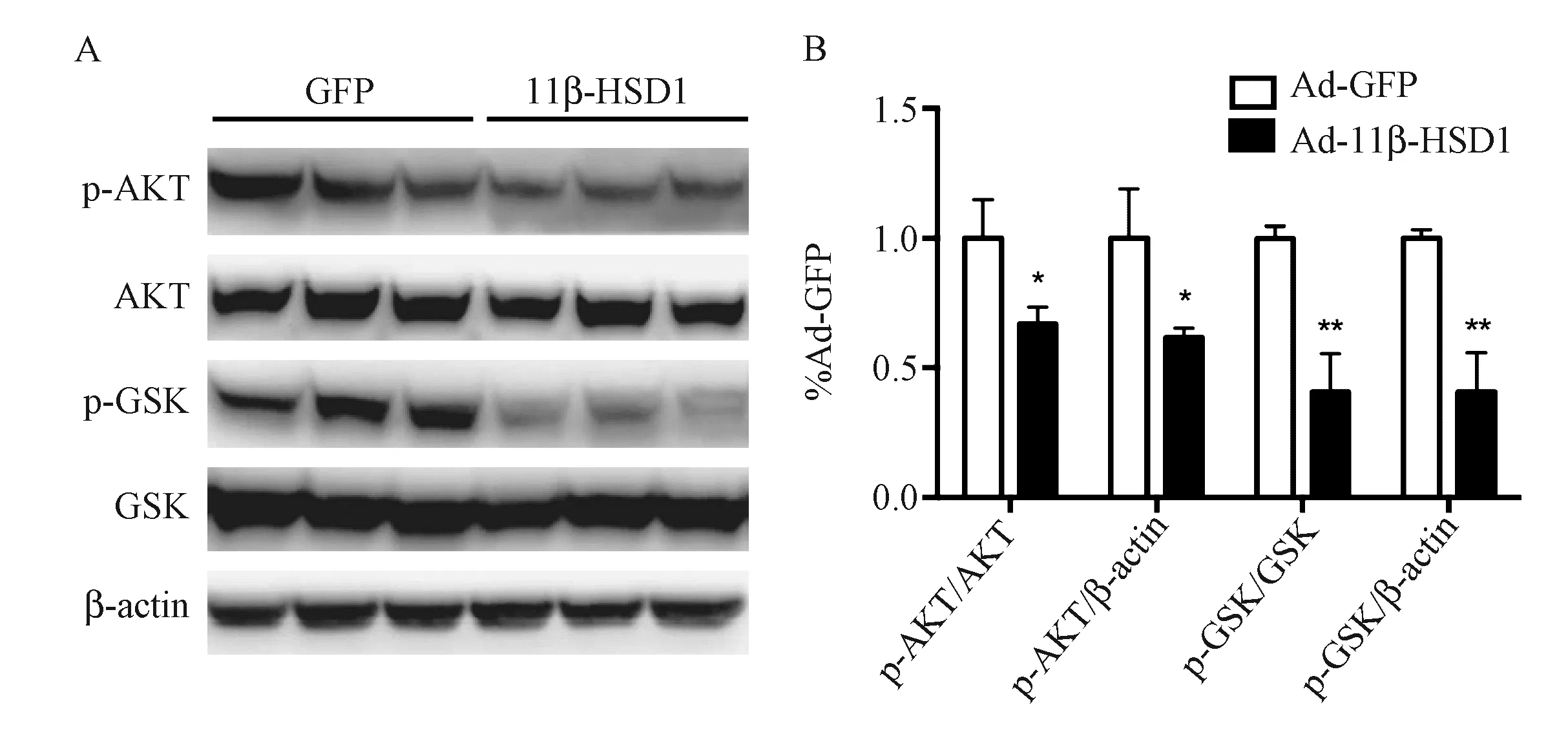
图5 胰岛素信号通路改变 A. Western blot检测胰岛素信号通路相关蛋白表达水平;B. Western blot条带灰度分析统计图。注:n=10,*P<0.05,**P<0.01
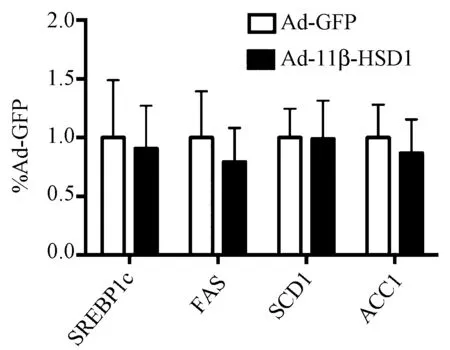
图4 脂质合成相关基因表达水平(n=10)
5.肝脏过表达11β-HSD1后,降低了AKT、GSK磷酸化水平 本实验也对两组小鼠肝脏组织胰岛素信号通路进行了测定,结果显示,肝脏过表达11β-HSD1后,AKT和GSK的磷酸化水平相较于对照组明显下降,P<0.05(图5A~B)。上述结果表明,11β-HSD1过表达后,影响了胰岛素信号通路,这有可能进一步影响了脂代谢。
讨 论
本实验通过肝脏过表达11β-HSD1,研究该基因对脂质蓄积的作用及其调控机制。结果显示,肝脏脂质蓄积而体质量并未发生改变,这与肝脏组织特异性11β-HSD1转基因动物的实验结果一致,形成轻度脂肪肝,并伴随胰岛素抵抗[3]。然而在该研究中发现,虽然普通饮食能够最终导致脂质蓄积,但高脂饮食条件下并不能引起该转基因小鼠肝脏的脂质增加,机制目前仍然不清楚[3]。本实验采用普通饮食喂养,长链脂肪酸合成通路被激活,脂肪酸合成途径的主调控因子SREBP1表达显著增加,同时激活了下游通路FAS、SCD1的表达,脂质合成相关蛋白ACC1含量也显著增加。这提供了一个11β-HSD1过表达后引起肝脏脂质蓄积的解释。为了进一步阐明11β-HSD1如何调控长链脂肪酸的合成途径,我们也同时检测了上述基因的转录水平。结果显示,这些基因在mRNA水平没有变化,说明11β-HSD1很可能是参与了长链脂肪酸合成途径中相关蛋白的转录后调控。这一结果得到了11β-HSD1肝脏特异性转基因动物[3]和肝脏敲低11β-HSD1的支持[6-7]。
肝脏脂质蓄积与胰岛素抵抗密切相关[8-10]。本实验通过蛋白免疫印迹检测到p-AKT和p-GSK磷酸化水平降低,表明胰岛素信号通路受损,胰岛素敏感性降低,其机制可能是11β-HSD1通过活化区域性的糖皮质激素钝化了胰岛素信号通路[11-12],从而继发地影响脂代谢紊乱。Alberts等[13]研究表明,采用选择性抑制剂BVT.2733抑制11β-HSD1后,可显著提高胰岛素敏感性,这项研究间接支持了我们的实验结果。而最近Stefan等[14]在一个多中心、随机、双盲、安慰剂对照的人群研究中发现,经过抑制剂RO509315112的12周治疗后,可显著改善脂肪肝,但并未提高肝脏胰岛素敏感性。这些差异可能由遗传背景或者抑制剂本身的特异性等原因所导致。
本实验通过尾静脉注射腺病毒感染小鼠,腺病毒本身或可引起炎症、肝肾毒性等不良反应,故在后续的研究中我们将采用肝脏组织特异性11β-HSD1转基因动物模型进一步验证。同时,对于脂质蓄积我们重点探讨了11β-HSD1对脂质合成的影响,并未检测脂质吸收、分泌和β-氧化等其它因素,我们将在后续研究中继续探讨。此外,本课题组对11β-HSD1的上游调控因子TNFα的研究结果表明,TNFα处理HepG2可诱导11β-HSD1表达升高,进一步诱发胰岛素抵抗[15-16],同时也引起脂质蓄积。
本研究推测,11β-HSD1可能通过损伤胰岛素信号通路,并激活脂肪酸合成通路而促进小鼠脂肪肝形成。首次阐释了瞬时过表达11β-HSD1可诱发肝脏脂质蓄积,并损害胰岛素信号通路。这为脂肪肝等代谢性疾病的防治提供了新的治疗靶点和理论依据。

