激酶非催化的C-叶域蛋白质1对人脐静脉内皮细胞衰老作用的影响及机制
姬劲锐 镐振选 刘 静 韩文杰 刘恒亮
激酶非催化的C-叶域蛋白质1(kinase non-catalytic C-lobe domin containing 1,KNDC1) 是最新发现的蛋白,其功能与(ras guanyl-nucleotide exchange factor,RasGEF)活性相关,在很多信号转导通路的中扮演重要角色[1]。前期研究表明very-KIND的RasGEF活性通过c-JUN氨基末端激酶1(c-Jun N-terminal kinase 1, JNK1)和/或细胞外信号调控激酶(extracellular signal-regulated kinase,ERK),经由Ras-Raf-MAPK通路诱导微管关联蛋白2(recombinant microtubule associated protein 2,MAP2)的磷酸化,MAP2磷酸化后与微管结合的活性增加,可以促进神经细胞树突的长度增加,研究还发现抑制或敲低very-KIND的表达可以促进培养中的小脑颗粒细胞和海马神经元的树突生长,这表明其作为一种信号分子在发育过程中调控或者抑制神经元树突生长[2-3],研究表明,敲除KNDC1能延缓人内皮细胞衰老[4]。然而,KNDC1过表达对人脐静脉内皮细胞(human umbilical vein endothelial cell, HUVEC)功能的影响和分子机制尚不清楚。本研究通过构建KNDC1腺病毒表达载体,转染HUVECs,产生KNCD1过度表达的HUVECs,进而探讨其对HUVECs衰老的影响及分子机制。
材料与方法
1.细胞和试剂 脐静脉内皮细胞(HUVEC)为本实验室从新生儿脐静脉中分离。KNDC1腺病毒(Santa Cruz Biotechnology公司)。ECM培养液、胰蛋白酶(Invitrogene公司)。胎牛血清(PAA公司)。β一半乳糖苷酶染色试剂盒(上海碧云天公司)。青霉素、链霉素(华北制药)。SOD、GPx 检测试剂盒(南京建成生物工程研究所)。抗KNDC1、抗β-actin(Santa Cruz Biotechnology 公司)。兔及鼠二抗(Cell Signaling Technology)。Trizol(Invitrogene公司)。RT-PCR试剂盒(TAKARA公司)。PCR引物(深圳华大基因)。
2. 细胞获取和培养 人脐静脉内皮细胞在无菌条件下从北京医院新生儿脐带中分离后用含5%胎牛血清的M199培养基(HyClone 公司)在37.5℃、5% CO2孵箱(Thermo 公司)中传代培养。原代培养的细胞为0代(P0),然后第一代为1代(P1)。传代数定义为随后的传代次数。培养基每2或3d更换一次,待细胞生长铺满培养基80%~90%时以0.125%胰蛋白酶消化后传代培养。待细胞传代6次后被接种在6孔培养板上。这项研究是由北京医院伦理委员会批准进行。所有参与者监护人均签署知情同意书。
3. 腺病毒转染 KNDC1腺病毒交由上海Geneway生物科技公司合成。将第六代人脐静脉内皮细胞分为三组:①空白对照组;②阴性对照组,人脐静脉内皮细胞转染空白腺病毒;③K30/60/90,实验组,人脐静脉内皮细胞转染30/60/90 pfu/cell腺病毒载体。
4. RNA表达分析 内皮细胞经上述处理后,用TRIZOI试剂提取每组细胞总RNA后通过qPCR检测内皮细胞的KNDC1的mRNA的表达。检测过程中以GAPDH作为内部参考,通过比较循环阈值(CT)计算相关mRNA的表达水平。CT值的含义是:每个反应管内的荧光信号达到设定的域值时所经历的循环数。因此每个模板的CT值与该模板的起始拷贝数存在负性关系,即起始拷贝数越多,CT值越小,使用Sequence Detector System software version 2.1进行数据分析。
5. SA-β-半乳糖苷酶(SA-β-gal)染色 ECM培养基中的第6~10代内皮细胞用于实验,内皮细胞被转染不同浓度的KNDC1腺病毒后,孵育48h后,吸除细胞培养基,用磷酸盐缓冲0.9氯化钠溶液(phosphate buffered saline,PBS)冲洗2次后在室温下用固定液固定15min。除去固定液后,用PBS冲洗3次,每次3min,并用含40 mmol柠檬酸,磷酸钠等组成的工作液染色,然后将在37°C下培养10h,用普通光学显微镜下观察并拍照:当细胞处于衰老状态时,细胞胞浆呈蓝色者,即为β-半乳糖苷酶染色阳性,然后计算出的细胞染色阳性总数占总细胞数的百分率,即为β-半乳糖苷酶染色阳性率。实验共重复3次。
6. Westemblot检测衰老相关蛋白 培养瓶中的内皮细胞被冷的PBS充分冲洗两次,弃去PBS洗液,每瓶内皮细胞加120μL的蛋白裂解液(1mL RIPA裂解液加5μL蛋白酶抑制剂100mmol),均匀滴入内皮细胞上,使用干净的刮棒将蛋白裂解液分布均匀,将其于冰上,待裂解30min后收集细胞裂解液,放置离心机中在4℃条件下,以12 000r/min,离心20min,收集上清液后获得胞浆蛋白。蛋白质浓度用BCA试剂盒使用Bio-Rad蛋白法测定。相同蛋白质量(30μg/泳道)用10% SDS-PAGE分离并转移到PVDF薄膜上。短暂清洗后,将PVDF膜置于脱脂牛奶封闭液中,室温封闭30min,将PVDF膜分别放进以下新鲜配制的一个或多个1∶1 000稀释原代兔抗体培养:KNDC1、p53、p-p53等。在4℃条件下,孵育原代抗体并与相应的山羊抗兔二抗体孵育1h。蛋白条带用高性能的放射自显影胶片观察,化学发光试剂曝光后用凝胶成像分析系统分析。采用图像分析系统对western印迹结果进行分析。

图1P1~5 SA-β-gal染色细胞衰老情况;B:PCR检测KNDC1的mRNA水平;C:western blot检测KNDC1的表达水平,注:与P1比较,*P<0.05
7. 细胞抗氧化酶测定 体内的主要酶性抗氧化剂包括超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶和谷胱甘肽过氧化物酶(glutathione peroxidase, GPX)。哺乳动物SOD有三种同工酶,存在于胞浆和细胞膜中的含铜与锌超氧化物歧化酶(CuZn- Superoxide dismutase, CuZn-SOD),线粒体基质中的含锰超氧化物歧化酶(Mn-Superoxide dismutase, Mn-SOD)以及分泌到细胞外的细胞外超氧化物歧化酶(extracellular superoxide dismutase, EcSOD)。大部分EcSOD锚在细胞表面硫酸肝素蛋白聚糖和组织间隙机制,但也存在于细胞外液中。因为O2-难以穿过细胞膜,SOD同工酶主要在他们各自的部位发挥保护作用,催化O2-生成H2O2,再由过氧化氢酶催化生成水和氧气,进而清除氧代谢产物对机体的毒害作用。谷胱甘肽过氧化物酶(glutathione peroxidase, GPX)主要是在胞浆和线粒体基质中,GPX系统是水溶性的,膜脂过氧化生成的磷脂氢过氧化物只在受到磷脂酶A2水解成游离的脂氢过氧化物后才能与之反应。如同SOD有EcSOD一样,GPX也有细胞外谷胱甘肽过氧化物酶(extracellular glutathione peroxidase, EcGPX),它不但能催化H2O2和烷氢过氧化物还原,还能催化磷脂氢过氧化物还原,它在保护细胞外液成份和细胞表面免受过氧化物损伤方面起重要作用。本实验通过分光光度法检测各组脐静脉内皮细胞中SOD活性和GPX含量。
8.统计学分析 采用SPSS19.0软件进行统计分析。所有计量数据以均数±标准差表示,三组比较采用单因素方差分析比较,两组间比较采用SNK方法进行。 以P<0.05为差异有统计学意义。
结 果
1. 体外培养的不同代次内皮细胞的改变 衰老细胞生长缓慢,具有典型的增大、扁平的形态特点。随着细胞代龄的增加,SA-β-gal染色显示衰老内皮细胞数目逐渐增多(图1P1~5)。观察KNDC1是否与正常细胞的衰老有关,人脐静脉内皮细胞不同代次的KNDC1表达水平用qPCR和Western blot分析,结果示随着人脐静脉内皮细胞代次的增加,KNDC1转录水平(图1-B)和表达水平升高(图1-C)。
2.各组脐静脉内皮细胞KNDC1转录与表达情况 为了进一步探讨KNDC1与人脐静脉内皮细胞衰老的关系,我们通过对第六代内皮细胞转染KNDC1腺病毒后发现,实验组内皮细胞KNDC1 mRNA水平较对照组增高239%~344% (P<0.05)。与之类似的是,KNDC1蛋白表达量也出现了显著的增高(P<0.05),并且呈现剂量反应性增高。①Werstern blot 显示 KNDC1 在各剂量实验组表达量均明显增高。②与空白对照组及阴性对照组相比,30epu/cell、60epu/cell、90epu/cell KNDC1腺病毒实验组KNDC1蛋白表达量分别增高了2.2、2.8及3.6倍,差异有统计学意义(P<0.05)。③30epu/cell、60epu/cell、90epu/cell KNDC1腺病毒实验组KNDC1 mRNA表达量是空白对照组的2.4、2.6及3.4倍,与空白对照组比,差异均有统计学意义(P<0.05,图2)。
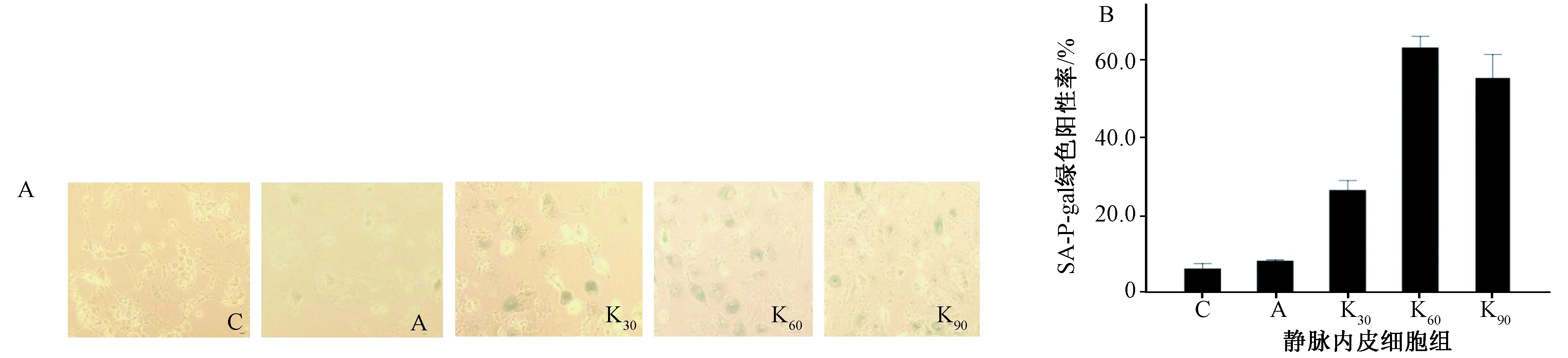
图3 转染KNDC1腺病毒后SA-β-gal染色情况 注:C 空白对照组;A 阴性对照组,转染空白腺病毒;K30/60/90 实验组, 转染30/60/90epu/cell KNDC1腺病毒

图2 KNDC1的转录水平与表达
3.各组内皮细胞β-半乳糖苷酶染色情况 KNDC1过表达能显著促进人脐静脉内皮细胞衰老,表明与对照细胞相比KNDC1过表达的细胞具有更高的SA-β-gal染色阳性率。本研究转染30epu/cell空白腺病毒、30epu/cell、60epu/cell、90epu/cell KNDC1腺病毒作用于HUVECS 24h,随着KNDC1腺病毒浓度的增加,衰老细胞比例逐渐增多(P<0.01),显出明显的剂量依赖性,各组衰老细胞比例分别为(6.2±1.3)% (C), (8.2±0.3)% (A), (26.3±2.5)% (K30), (62.9±2.8)% (K60) and(55.3±5.8)% (K90)。三个实验组衰老细胞比例均较空白对照组差异有统计学意义,实验组60epu/cell组与30epu/cell组,差异有统计学意义,而与90epu/cell组,差异无统计学意义,因此下面实验中KNDC1腺病毒实验组均转染60epu/cell KNDC1腺病毒,见图3。
4.人脐静脉内皮细胞KNDC1过表达对p53及磷酸化p53活性的影响 为了进一步探讨在HUVECs衰老过程中相关衰老基因的参与,我们通过免疫印迹分析检测其磷酸化形式的活化。我们发现p-p53作为细胞周期的一个重要的抑制剂,其表达显著增加,也观察到KNDC1腺病毒实验组与空白对照组对比(244.3±19.5)vs.(113.5±9.0),与空白对照组相比,KNDC1腺病毒实验组内皮细胞p53表达量差异无统计学意义(P>0.05),磷酸化p53较空白对照组有显著性增高(P<0.05)这表明,p53通路可能是一个调节HUVECs衰老过程的重要中介。详见图4。
5.转染KNDC1腺病毒对内皮细胞抗氧化酶SOD及GPx活性的影响 我们以前的研究表明,敲除KNDC1可通过降低细胞内活性氧(ROS)来延迟HUVECs衰老。在本实验中我们验证了实验组和对照组SOD和GPx的变化,转染KNDC1 24h后,内皮细胞内抗氧化酶活性均明显降低,GPx活性为(0.82±0.062),SOD活性为(0.84±0.079),差异均有统计学意义(P<0.05)。通过这样研究我们发放KNDC1过度表达的内皮细胞通过抑制细胞内抗氧化剂(SOD或Gpx)和刺激活性氧(ROS)的产生来显著增加细胞衰老进程。详见图5。
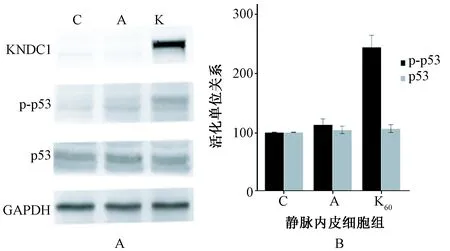
图4 人脐静脉内皮细胞KNDC1过表达对P53及磷酸化p53活性的影响 注:C: 空白对照组;A: 阴性对照组,转染空白腺病毒;K: 实验组,转染 60epu/cell KNDC1腺病毒

图5 转染KNDC1腺病毒对内皮细胞抗氧化酶SOD及GPx活性的影响注:C: 空白对照组;A: 阴性对照组,转染空白腺病毒;K:实验组,转染60epu/ cell KNDC1腺病毒
讨 论
增龄是冠状动脉性疾病(CAD)的重要危险因素,而血管内皮细胞衰老在其发生和发展中起着重要的作用[5]。衰老细胞表现出与衰老相关的β-半乳糖苷酶(SA-β-半乳糖苷酶)染色阳性、扁平细胞形态和基因表达模式等特征[6]。
KNDC1作为一种新型RasGEF蛋白,已被认为是一个与细胞衰老相关蛋白[7]研究发现KNDC1过度表达抑制海马神经元和小脑颗粒细胞树突的生长,而敲除KNDC1可促进海马神经元和小脑颗粒细胞树突长度的增加[8]。然而,KNDC1对血管内皮细胞的调控功能和机制还不清楚。由于人脐静脉内皮细胞在体外培养时的有限的分裂能力被用建立生物衰老模型[9]。因此,在本研究中,体外培养HUVECs作为生物衰老模型,观察KNDC1对衰老的影响。因此,在本研究中,通过体外培养HUVECs建立生物衰老模型,观察KNDC1对内皮细胞衰老的影响,探讨其导致内皮细胞衰老的分子机制。在实验中,我们发现,短期内(24h)KNDC1腺病毒转染HUVECs导致衰老。随着传代次数的增加,衰老的人脐静脉内皮细胞的数量也增加(图1-A),SA-β-半乳糖苷酶染色阳性数量增加(图2),KNDC1 mRNA转录水平(图1-B)和表达水平增加(图1-C)。
为了进一步探讨KNDC1对内皮细胞衰老影响,我们采用基因转染技术,在实验中通过同源重组法重组腺病毒获得含有KNDC1基因腺病毒载体。然后将含KNDC1基因的腺病毒载体转染人脐静脉内皮细胞中。通过比较不同剂量KNDC1腺病毒转染阳性率,我们发现,60pfu /cell组与90pfu /cell组阳性率相似,但是明显高于30pfu /cell组。RT-PCR和Western blot显示在24h后,KNDC1腺病毒载体组mRNA和蛋白的表达水平明显高于空载体组和空白对照组,差异有显著性(P<0.05,图2)。据观察,当转染KNDC1腺病毒载体的内皮细胞KNDC1表达上调时,其细胞典型的形态较同代次的对照组发生显著改变,包括:体积增大,多核化和更高的SA-β-gal染色阳性率。
KNDC1过表达导致对细胞生长调节密切相关基因(p-p53)表达的改变,这与之前的研究一致[10]。以前的研究证实p53是DNA损伤反应的调节因子,p53/p21被认为在过氧化氢诱导的细胞生长、休止和复制衰老中起作用[11]。转录因子p53无疑是抑制衰老的最重要的蛋白之一,其多个功能作用于维持基因组的完整性[12],特定环境下执行的特定生物反应包括短暂或永久性细胞周期阻滞到细胞死亡[13]。在这项研究中,Western blot实验表明,转染KNDC1腺病毒载体的内皮细胞,p53的表达无明显变化,但是磷酸化p53显著增加。据报道,p53蛋白稳定性的调控主要是一些蛋白修饰,p53蛋白的磷酸化、乙酰化或磷酸化修饰均起到稳定p53的作用[14]。因此磷酸化p53增高说明KNDC1通过调节p53蛋白修饰,增加功能性p53的表达量,继而激活下游基因,而发挥致衰老作用[15]。
最近研究表明,p53通过调节能量代谢和氧化应激来发挥其抗增殖作用[16]。细胞内ROS水平的增加是与衰老相关的应激因子之一[17]。在我们的研究中,我们发现与对照组相比,磷酸化p53水平增加,这将导致ROS的剂量依赖性增加产生。因此,p53通路的激活可能是对ROS诱导的DNA损伤的应答[18]。急性应激时,p53可以下调抗氧化酶的表达,如SOD和GPX,此外,p53还表现出促氧化的活性,可能会加剧细胞应激状态下的氧化应激反应[19]。ROS也可以激活p53和启动p53依赖的应激反应通路,如细胞周期阻滞,衰老和凋亡[20]。因此,p53和ROS正反馈循环促使应激细胞凋亡或衰老。此外,p53的活化引发一系列下游转录事件导致细胞生长抑制和衰老。这些结果表明,KNDC1过表达促进内皮细胞衰老,可能在细胞衰老的进展中起重要作用。p53被证明是一个诱导KNDC1相关细胞衰老的重要基因。
综述所述,KNDC1过表达抑制人脐静脉内皮细胞增殖,促进其衰老。关于作用机制,,KNDC1过表达通过启动p53信号通路增加ROS表达。p53-ROS正反馈环在调控KNDC1介导的细胞衰老中发挥重要作用,通过增加磷酸化p53蛋白的表达,KNDC1促进p53表达并放大p53-ROS反馈环的作用,进而加速细胞衰老的进程。因此,KNDC1在介导细胞衰老过程中的完整信号通路应该继续研究,这将为衰老相关疾病提供新的治疗方向。

