小肠黏膜下层促血管内皮细胞体外增殖及成血管化作用
焦自钊,薛武军,安茂竹,付海霞,李 杨,李凤楼,盛练芬
(1.济宁医学院附属日照市人民医院血液净化科,山东日照 276800;2.西安交通大学第一附属医院肾脏病医院肾移植科,陕西西安 710061)
目前组织工程学在人工皮肤、血管、骨、心脏瓣膜等组织再建方面已取得了长足的进展,但是人工组织的血管化障碍问题依然是限制组织工程产品临床应用的主要因素之一[1-3]。加速组织血管化,为组织提供足够的营养物质,是构建有效的组织工程产品亟待解决的主要问题。小肠黏膜下层(small intestinal submucosa, SIS)是一种天然细胞外基质材料,在组织工程学实验研究中作为支架材料已得到成功应用[4-6]。研究发现,SIS除主要成分Ⅰ、Ⅲ型胶原纤维外,还含有血管内皮生长因子(vascular endothelial growth factor, VEGF)及碱性成纤维细胞生长因子(basic fibroblast growth factor, b-FGF)等促进血管内皮细胞增生及血管生成的细胞因子[7-9]。因此,本研究拟分离、培养脐静脉内皮细胞(umbilical vein endothelial cells, UVECs),并与制备的SIS体外共培养,研究SIS对UVECs体外增殖及成血管化功能的影响,为利用SIS制备血管化组织工程产品奠定实验基础。
1 材料与方法
1.1材料猪空肠段小肠来自经过检疫的健康成年猪(西安市肉联加工厂提供);脐带组织来自健康孕妇足月妊娠经剖腹产娩出的新生儿脐带组织(西安交通大学第一附属医院产科提供),取标本前经医院伦理委员会及患者知情同意。
酶联免疫吸附试验(ELISA)试剂盒(VEGF、b-FGF)及异硫氰酸荧光素(FITC)标记的兔抗人的CD31抗体、藻红蛋白(PE)标记的兔抗人vWF抗体(美国 Sigma 公司);胶原酶Ⅱ及胰酶(德国Roche公司);胎牛血清(FBS)及RPMI 1640培养基(美国Gibico公司);兔抗猪Ⅰ、Ⅲ型胶原蛋白抗体及锥虫蓝(北京中杉公司);倒置式显微镜及VANOX型荧光显微镜(日本Olympus公司);5100型细胞培养箱(美国NAPCC公司)。
1.2UVECs的分离、培养及鉴定按文献[10]方法,用PBS液冲洗脐静脉血液后灌注1 g/L的胶原酶Ⅱ使其充盈,37 ℃培养箱中孵育15 min,收集消化液,并用含100 mL/L胎牛血清的RPMI 1640培养基冲洗管腔,将消化液与冲洗液一并收集,1 000 r/min,离心5 min;RPMI 1640完全培养基(含200 mL/L胎牛血清、20 ng/L hVEGF121、L-谷氨酰胺2 mmol/L、青霉素100 U/mL、链霉素100 μg/mL)重悬沉淀,调整细胞密度并以5×104/cm2接种于预先用10 g/L明胶溶液铺被的细胞培养瓶中,37 ℃、饱和湿度、50 mL/L CO2培养箱中培养。应用FITC标记的兔抗人CD31抗体、PE标记的兔抗人vWF抗体对UVECs进行免疫荧光鉴定。
1.3SIS的制备及鉴定按文献[11]方法稍加改良制备SIS,每次制备取健康成年猪新鲜空肠5 cm,清水冲洗干净后浸泡于冰无菌生理盐水中。切开小肠,冰无菌生理盐水冲洗,清除小肠内外壁粘附物。沿管腔纵向刮除黏膜层、浆膜及肌层,得到约100 μm厚的半透明状SIS基质。依次按以下步骤进行去细胞处理:将基质在含100 mmol/L乙二胺四乙酸(EDTA)和10 mmol/L氢氧化钠(NaOH)的溶液中浸泡8 h(pH 11~12),1 mol/L盐酸(HCl)和1 mol/L氯化钠(NaCl)溶液中浸泡8 h,再于含1 mol/L NaCl的磷酸缓冲盐(PBS)溶液中(pH 7~7.4)浸泡16 h,PBS溶液浸泡2 h,每次更换浸液前用去离子水将基质冲洗干净。25 kGy γ-射线照射消毒灭菌。
组织学鉴定:观察制备的SIS大体外观后,将SIS基质于4 g/L的多聚甲醛中固定24 h,制作4 μm厚石蜡切片,HE染色后观察SIS纤维结构,应用兔抗猪Ⅰ、Ⅲ型胶原蛋白抗体对SIS进行免疫组化染色。
1.4ELISA检测SIS的细胞因子水平将SIS剪切成边长2.5 cm正方形,置于6孔板板孔,每孔加入PBS液2 mL,4 ℃震动孵育24 h。设单独PBS液为对照组,每组设6个平行孔。按兔抗猪VEGF及b-FGF的ELISA试剂盒方法测定上清液VEGF及b-FGF浓度。
1.5SIS和UVECs共培养设UVECs和SIS共培养组及UVECs单独培养组。每组取8个6孔板,设48个平行孔,均用10 g/L明胶溶液铺板。共培养组:剪切成边长2.5 cm正方形SIS,粗面向上铺平,按密度1×104个/孔种入UVECs,37 ℃、饱和湿度、50 mL/L CO2培养箱中培养。UVECs单独培养组:每孔种植1×104个UVECs,不铺SIS。
倒置显微镜下观察UVECs的生长特性及成血管化情况。每天每组取6孔培养的UVECs,2.5 g/L的胰酶消化,锥虫蓝染色计数,每孔计数3次,取平均数,共计数8 d。绘制各组UVECs细胞生长曲线,计算细胞群体倍增时间。
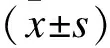
2 结 果
2.1血管内皮细胞的形态与鉴定结果倒置显微镜下观察(图1),UVECs贴壁单层生长,铺路石样镶嵌排列,细胞为扁平多角形,边界清楚;胞核清晰可见,为圆形或椭圆形。UVECs的CD31、vWF血管内皮细胞相关抗原免疫荧光检测呈阳性反应,结合其形态学特征,证实培养的细胞为血管内皮细胞。

图1UVECs的形态及免疫荧光鉴定
Fig.1 Morphological and immunofluorescence identification of UVECs (×100)
A:倒置显微镜下观察结果;B:FITC-CD31免疫荧光抗体染色阳性;C:PE-vWF免疫荧光抗体染色阳性。
2.2SIS的组织学观察及鉴定情况分离获得的SIS为乳白色半透明状,无破损,无平滑肌细胞及血管残留,平铺后可见明显的脉络状胶原。HE染色见SIS胶原纤维结构平整呈网织状均匀排列,无断裂,无细胞成分;免疫组化染色见SIS的兔抗猪Ⅰ、Ⅲ型胶原蛋白染色均呈阳性反应(图2),符合SIS组织学特点。
2.3SIS的细胞因子检测结果ELISA检测SIS组上清液各因子水平分别为VEGF(48.83±5.67)ng/mL,b-FGF(72.36±8.71)ng/mL;PBS液对照组未检测到VEGF及b-FGF。表明SIS含有一定量的VEGF、b-FGF等促进血管内皮细胞增生及成血管化的生长因子。

图2SIS的组织学观察及鉴定结果
Fig.2 Histological examination of SIS (A、B,×200; C,×100)
A:SIS的HE染色;B:SIS的兔抗猪Ⅰ型胶原蛋白染色呈阳性反应;C:SIS的兔抗猪Ⅲ型胶原蛋白染色呈阳性反应。
2.4SIS的促进血管内皮细胞增生及成血管化作用培养24 h时,倒置显微镜下可见,UVECs单独培养组UVECs形态未发生变化,细胞密度相对稀疏;UVECs和SIS共培养组UVECs细胞生长相对致密,细胞突起相互连接形成血管样结构,说明UVECs在SIS上具有血管形成功能(图3A、图3B)。培养8 d的UVECs生长曲线可见UVECs和SIS共培养组曲线上移,UVECs在第2天进入对数生长期,持续时间为3 d;UVECs单独培养组则在第3天UVECs进入对数生长期,持续时间为2 d。培养第4、5天时,UVECs和SIS共培养组UVECs计数分别为(7.91±0.42)×104、(9.15±0.48)×104,均大于UVECs单独培养组的(4.26±0.27)×104、(6.71±0.31)×104(P<0.01)。根据公式DT=T×Lg2/(LgNt―LgNo)(DT:倍增时间;T:培养时间;Nt:对数生长期终点计数;No:首次细胞计数),计算UVECs群体倍增时间,UVECs和SIS共培养组为(1.28±0.21)d,明显短于UVECs单独培养组的(2.14±0.37)d(P<0.01,图3C)。

图3UVECs的血管化及生长曲线
Fig.3 Vascularization and growth curve of UVECs (A、B, ×200)
A:UVECs单独培养组;B:UVECs+ SIS共培养组;C:UVECs的生长曲线,与UVECs单独培养组比较,*P<0.01。
3 讨 论
近年来,尽管组织工程领域的研究取得了飞速发展,但能够用于临床的组织工程产品数量非常有限,主要原因之一就是组织工程的血管化问题难以解决,以致组织工程产品的种子细胞因不能及时得到血液供应而发生缺血缺氧性坏死[1-3]。加速组织工程产品的血管化,为组织工程产品种子细胞提供足够的营养物质,从而构建有效的血管化组织工程产品已引起了广泛的关注。
组织工程学所需要的主要材料包括种子细胞、天然或非天然的生物支架材料及促进细胞增生、分化的生物活性因子[12-14]。SIS是一种不含细胞的天然细胞外基质材料,主要由Ⅰ、Ⅲ型胶原纤维构成,具有良好的组织相容性,已作为生物支架材料广泛用于组织缺损修复的研究(血管、骨、皮肤、硬脑膜、膀胱等),并取得了良好的效果[15-17]。研究发现,细胞外基质是细胞微环境的主要成分,不仅为各种细胞提供骨架结构与附着位点,而且在细胞的黏附、迁移、增殖、分化、组织特异性维持、凋亡诱发相关基因表达抑制等方面发挥着重要作用,如细胞外基质与细胞表面整合素的结合可以激活细胞内Ras-Raf-MEK-ERK等细胞增殖信号转导通路,从而避免细胞进入凋亡的级联步骤以致细胞失巢凋亡(anoikis)[18-19]。SIS生物支架材料除胶原蛋白外还含有丰富的蛋白多糖和纤维粘连蛋白,与细胞外基质组成和结构类似,能够为细胞植入重建合适的微环境,从而促进细胞与组织间的粘附及细胞的增殖和分化[20]。在组织血管化方面,研究发现SIS不但包含多种促进血管内皮细胞增殖及成血管化的生长因子,如VEGF及b-FGF等,而且VEGF及b-FGF等生长因子在组织工程中还呈独特的三维分布,如VEGF主要分布在血管周围,b-FGF与纤维结构相连,呈弥散分布[7-9]。基于SIS的细胞外基质特点,我们考虑SIS和血管内皮细胞共培养可以为血管内皮细胞提供骨架结构与附着位点,有利于血管内皮细胞在SIS上黏附、迁移、增殖;并且SIS所含的促进血管内皮细胞增殖和成血管化的生长因子及其独特的三维分布,更有利于血管内皮细胞增殖及血管内皮细胞形成管状的血管样结构。
本研究通过免疫组化及ELISA检测制备的SIS,发现制备的SIS含有Ⅰ、Ⅲ型胶原蛋白及促血管内皮细胞生长因子(VEGF、b-FGF)等组分且不含细胞,证实了制备的SIS具有细胞外基质特性,且含有多种促进血管内皮细胞增殖及成血管化的生长因子。应用SIS与UVECs体外共培养发现,UVECs和SIS共培养组UVECs密度较UVECs单独培养组相对致密,且有血管样结构形成;UVECs生长曲线显示,对数生长期的UVECs细胞数在UVECs和SIS共培养组大于UVECs单独培养组;计算UVECs群体倍增时间,UVECs和SIS共培养组短于UVECs单独培养组。以上结果说明,SIS的细胞外基质特性及其所含促血管内皮细胞生长因子等组分能够促进血管内皮细胞的增殖及成血管化。这提示应用SIS作为生物支架材料进行组织工程构建能够促进组织工程产品的血管化,也为利用SIS制备血管化组织工程产品并进行体内移植奠定了实验基础。

